Российский многоцентровой опыт выполнения робот-ассистированных операций у больных раком прямой кишки
Введение
Робот-ассистированная хирургия является новым направлением в онкологической колопроктологии. Несмотря на отсутствие доказательной базы о клинически значимых преимуществах данного метода, он прочно вошел в рутинную практику ведущих хирургических клиник Европы, Америки и некоторых стран Азии. Что же послужило причиной быстрого распространения дорогостоящей и малоизученной технологии?
В доказательной медицине существует мнение о том, что большинство хирургических исследований по умолчанию обречены на провал из-за доминирующего влияния субъективных факторов. При участии более одного центра роль хирурга будет превалировать над ролью техники, рандомизация будет неприемлемой либо этически, либо с точки зрения того же хирурга. Мы принимаем большинство нововведений, таких как тотальная мезоректумэктомия, тотальная мезоколонэктомия, экстралеваторная экстирпация прямой кишки, на основании ретроспективных когортных исследований, пользуясь здравым смыслом, анатомическими и эмбриологическими обоснованиями. Малоинвазивная хирургия стала исключением: ее приход в онкологию вызвал столько разногласий, что рандомизация оказалась насущной необходимостью. Спустя несколько лет перспектива открытой операции по поводу локализованного рака ободочной кишки в руках обученного лапароскопической технике хирурга уже представляется неоправданной.
Если роль малоинвазивных технологий после завершения ряда крупных многоцентровых исследований можно считать установленной, насколько оправдано их повторение для роботической хирургии? Некорректно воспринимать эту технологию как нечто кардинально новое, это лишь эволюция лапароскопической техники, полностью сохранившая все ключевые принципы своего прародителя: пневмоперитонеум, электроинструменты, последовательность этапов операций. Ключевые различия кроются в деталях. Существует фактор, который невозможно оценить в рамках доказательной медицины, но который не может не влиять на итоговый результат операции, – комфорт оперирующего хирурга. Дополнительная степень свободы инструментов, высококачественная трехмерная визуализация с виртуальным «погружением» в операционное поле, эргономически удобное положение сидя – транслируются ли эти преимущества в показатели качества хирургического лечения, важные для пациента?
Хирургия рака прямой кишки (РПК) – одна из последних областей, в которых использование малоинвазивных технологий до сих пор вызывает ряд разногласий. Техническая сложность операций, высокая кривая обучения приводят к появлению очень разнородных результатов клинических исследований. В 2 работах – ALaCaRT 1 и ACOSOG Z6051 2 – преимущество осталось на стороне открытой хирургии. Ключевая проблема состоит в сложностях мобилизации дистальных отделов прямой кишки, так как данная зона анатомически труднодоступна для любого вида операций. Большинство современных хирургов имеют наибольший опыт в выполнении именно открытых вмешательств, что могло повлиять на результаты процитированных выше исследований. Сложности мобилизации дистальных отделов прямой кишки заставляют хирургов искать новые решения. Примером этого является использование трансанальной мезоректумэктомии. Лапароскопическая техника может обеспечить лучшую визуализацию данной области, однако ограничения «угла атаки» длинных прямых инструментов также создают сложности в условиях узких пространств малого таза. Роботическая хирургия с наличием хорошей визуализации и дополнительной степени свободы инструментов потенциально может улучшить качество вмешательств в данной области. Чтобы проверить данную гипотезу, мы провели ретроспективное исследование собственного опыта подобных вмешательств.
Материалы и методы
В многоцентровое когортное исследование, основанное на проспективно собранных данных, включены пациенты с РПК, которым выполняли лапароскопические и роботические хирургические вмешательства в период с 2010 по 2016 г. в клинике госпитальной хирургии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова», СПб ГБУЗ «Городская больница
№ 40 Курортного административного района» (г. Сестрорецк), ФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» и ГБУЗ «Клинический онкологический диспансер № 1» (г. Краснодар). Критериями включения пациентов в исследование были наличие гистологически верифицированного РПК и возраст младше 85 лет. Из исследования исключали пациентов с первично-множественными злокачественными новообразованиями.
Целью исследования стала оценка качества мезоректумэктомии после лапароскопических и роботических операций на разных этапах освоения метода. Дополнительно изучали интра- и послеоперационные осложнения, длительность вмешательства, интраоперационную кровопотерю, показатели общей и безрецидивной выживаемости.
Все операции выполняли хирурги, имеющие опыт малоинвазивных колоректальных вмешательств. Пациенты, которым проводили роботические операции, были разделены на 2 группы в целях ограничения влияния фактора обучения на полученный результат и оценки его влияния на качество хирургии: те, которым вмешательства были выполнены в 1-й год освоения метода, и те, которым операции выполнялись в последующие годы. Таким образом, были сформированы 3 исследуемые группы: лапароскопической хирургии (Л), роботической хирургии в 1-й год освоения техники (Р1) и роботической хирургии в более поздний период (Р2).
Послеоперационные осложнения оценивали по классификации Clavien–Dindo 3. Качество мезоректумэктомии оценивали по шкале Quirke 4. Общую выживаемость рассчитывали от даты поступления пациента в хирургический стационар до даты последнего наблюдения пациента или его смерти. Безрецидивную выживаемость рассчитывали от даты поступления больного в хирургический стационар до даты последнего наблюдения пациента без признаков прогрессирования заболевания или до даты прогрессирования, или даты смерти. Анализ выживаемости проводили методом Kaplan–Meier, для сравнения кривых выживаемости использовали log-rank-тест.
Для вычисления вероятности развития определенных событий в разных исследуемых группах использовали вычисление отношения шансов в таблицах сопряженности 2 × 2. Во всех случаях использовали 95 % доверительный интервал (ДИ). Качественные признаки сравнивали с помощью χ2-теста с поправкой Йетса на непрерывность или точного критерия Фишера при малых выборках. Также использовали таблицы сопряженности 2 × 2. Для критериев с нормальным распределением применяли тест Стьюдента, в остальных случаях – U-критерий Манна–Уитни. Всегда использовали двустороннее значение р. Статистический анализ данных проводили с помощью программы IBM SPSS Statistics 20.0 (IBM, США).
Результаты
В табл. 1 представлены основные характеристики исследуемых групп пациентов, которые потенциально могли оказать влияние на характер и сложность выполняемых оперативных вмешательств.
В период освоения роботической хирургии реже оперировали пациентов мужского пола, так как их анатомически более узкое пространство малого таза создавало больше сложностей для выполнения оперативного вмешательства. Различия между группами не достигли статистической достоверности (р = 0,073), в том числе между группами Р1 и Р2 (р = 0,09). Также в группе Р1 чаще оперировали больных с верхнеампулярным РПК, однако различия не были достоверны по сравнению с группой Р2 (р = 0,13). Следует отметить, что доли пациентов с ожирением и тех, которым была проведена химиолучевая терапия, не различались в группах Р1 и Р2. Однако в группе Л достоверно большее число пациентов получили комбинированное лечение.
Таблица 1. Основные характеристики исследуемых групп пациентов с раком прямой кишки
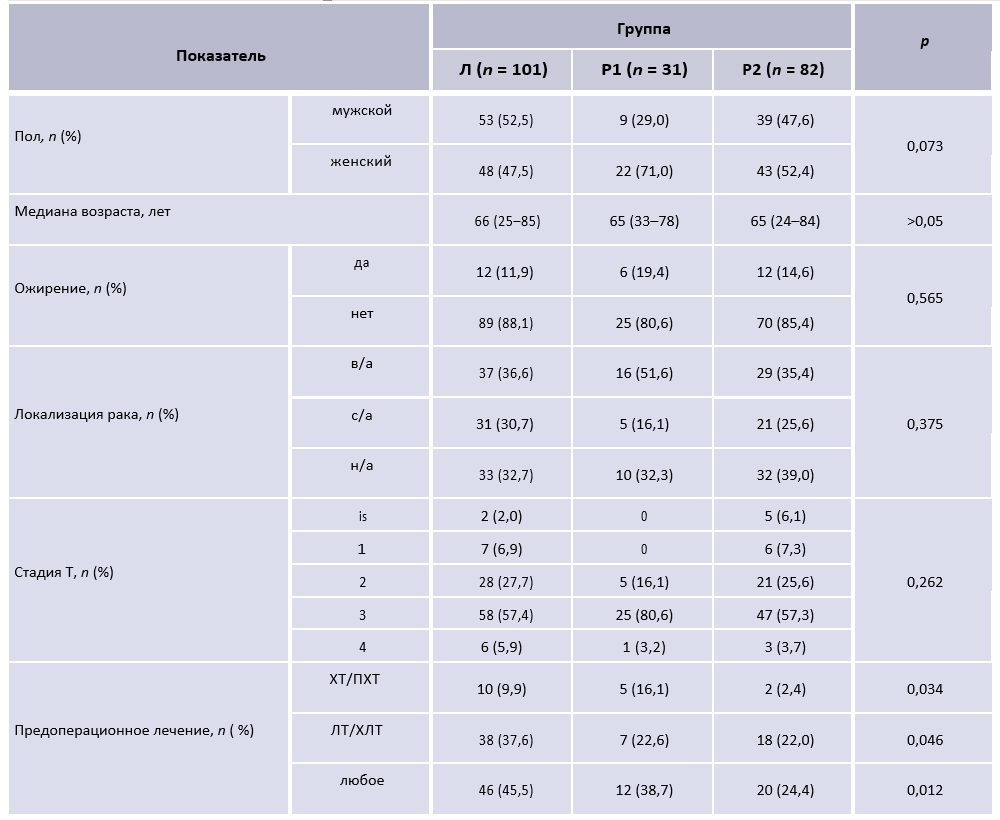
Примечание. Л – лапароскопические операции, Р1, Р2 – роботические операции (здесь и в табл. 2–4, 6, 7); ХТ – химиотерапия; ПХТ – полихимиотерапия; ЛТ – лучевая терапия; ХЛТ – химиолучевая терапия; в/а – верхнеампулярный; с/а – среднеампулярный; н/а – нижнеампулярный.
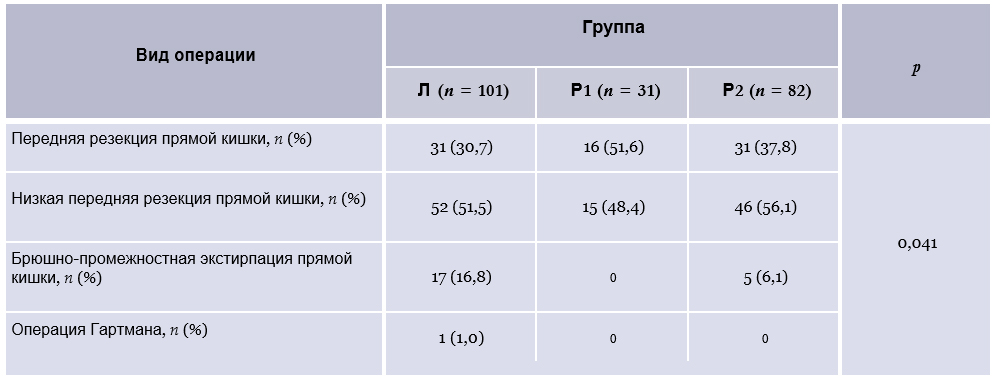
В табл. 2 представлены виды операций, выполненных в исследуемых группах.
Различия между группами были обусловлены в основном отсутствием операции Гартмана в группах Р1 и Р2 и значительно более редким выполнением брюшно-промежностной экстирпации прямой кишки по сравнению с группой Л. Как уже было отмечено, в группе Р1 было больше больных верхнеампулярным РПК, что транслировалось в более частое выполнение передней резекции прямой кишки. Частота низких передних резекций прямой кишки была сопоставима между группами.
Конверсии отмечены только в группах роботических операций (n = 5); различия с группой Л не достигли достоверных значений. Причинами конверсий были местное распространение опухолевого процесса (n = 4) и спаечные изменения в брюшной полости (n = 1). Следует отметить, что конверсии во время роботических операций с одинаковой частотой требовались в период освоения методики и в последующей практике (1 (3,2 %) и 4 (4,9 %) соответственно, р = 1).
Таблица 2. Виды операций в исследуемых группах пациентов с раком прямой кишки
Кровопотеря была незначительной во всех группах, что характерно для большинства малоинвазивных вмешательств (табл. 3).
В то время как на этапе освоения метода продолжительность роботических операций была выше, чем лапароскопических (р = 0,028), стандартизация техники операции и использование в дальнейшем оптимизированного метода докинга роботического хирургического комплекса позволили достоверно снизить время операции по сравнению с лапароскопической группой – на 42 мин (р <0,0001).
Таблица 3. Интраоперационные показатели в исследуемых группах пациентов с раком прямой кишки

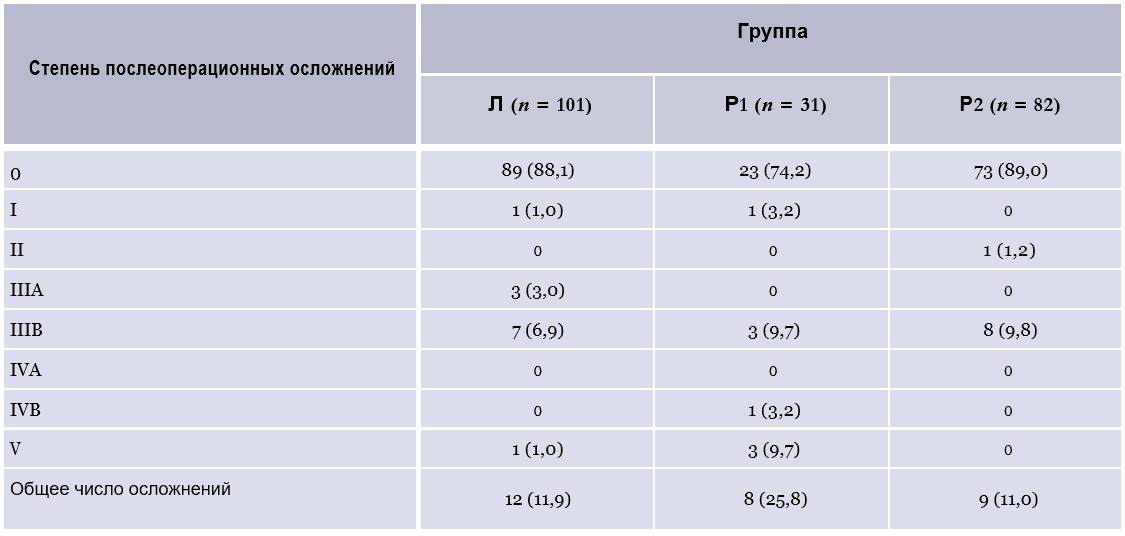
Одним из ключевых критериев является безопасность нового метода, в том числе в период его освоения. Данные по послеоперационным осложнениям суммированы в табл. 4.
Общая частота осложнений была невысокой и составляла от 11,0 до 25,8 %. Частота осложнений III степени и выше была максимальной в группе Р1 (22,6 %), минимальной – в группе Р2 (9,8 %). Различия не были достоверны между группами Л и Р2 (р = 0,677), Л и Р1 (р = 0,132), Р1 и Р2 (р = 0,11).
Несостоятельность анастомоза редко развивалась у пациентов с РПК в нашем исследовании: данное осложнение в группе лапароскопической хирургии наблюдалось у 7 (6,9 %) пациентов, в группах роботической хирургии – у 6 (5,3 %). Различия не были статистически достоверны (р = 0,404).
Поздние послеоперационные осложнения отмече- ны только у 2 (2 %) в группе лапароскопической хирургии и у 2 (1,8 %) – в группах роботической хирургии. Во всех случаях это был стеноз аппаратного анастомоза, который был излечен методом эндоскопического бужирования.
Таблица 4. Частота послеоперационных осложнений по классификации Clavien–Dindo в исследуемых группах пациентов с раком прямой кишки, n (%)
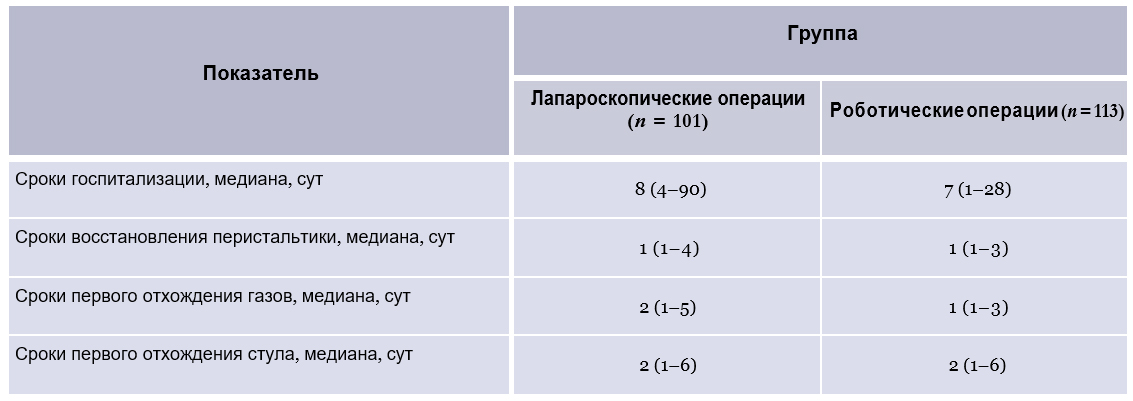
Традиционно для малоинвазивных вмешательств, как в группе лапароскопической, так и в группах роботической хирургии, удавалось добиться раннего восстановления функции желудочно-кишечного тракта и непродолжительных сроков госпитализации (табл. 5). Клинически значимых различий между группами по этим критериям не было.
Таблица 5. Основные характеристики послеоперационного периода у исследуемых пациентов с раком прямой кишки
Наиболее значимым с точки зрения хирургической техники показателем является частота выполнения резекций в объеме R0 (табл. 6).
Таблица 6. Морфологические характеристики удаленных препаратов у исследуемых пациентов с раком прямой кишки

Частота проведения резекций в объеме R0 достоверно не отличалась между группами (р = 0,738). Отмечалась выраженная тенденция (р = 0,06) к достоверности различий между группами Р1 и Р2. Различий по числу удаленных лимфатических узлов не отмечено.
Качество мезоректумэктомии было оценено у 131 пациента с РПК (табл. 7).
Таблица 7. Качество мезоректумэктомии в исследуемых группах пациентов с раком прямой кишки, оцененное по шкале Quirke
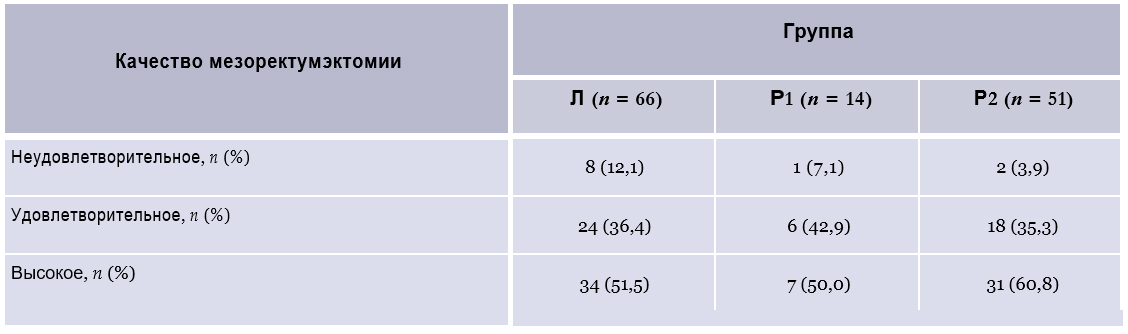
Отмечена тенденция к более частому достижению удовлетворительного и высокого качества препаратов в группе Р2 по сравнению с группой Л, но она не достигла статистически достоверных значений (р = 0,18).
Отдаленные результаты лечения проанализированы у всех пациентов, у которых на момент операции отсутствовали отдаленные метастазы. Среди всех больных с РПК таких было 93 в группе Л и 109 – в группах Р1 и Р2. Медиана наблюдения составила 21,9 (7,4– 79,6) мес.
Рецидивы развились у 12 (5,9 %) из 202 пациентов с неметастатическим РПК: 8 (8,6 %) случаев в группе Л и 4 (3,7 %) случая в группах роботической хирургии (2 (6,5 %) – в группе Р1 и 2 (2,6 %) – в группе Р2). Различия не были статистически достоверны (р = 0,25). Метастазы развились у 21 (10,4 %) из 202 пациентов: 13 (14 %) случаев в группе Л и 8 (7,3 %) случаев в группах роботической хирургии (3 (9,7 %) – в группе Р1 и 5 (6,4 %) – в группе Р2). Различия также не были достоверны (р = 0,269). Общая выживаемость не различалась между группами Р1 и Р2 (р = 0,821), Л и Р1 (р = 0,143), Л и Р2 (р = 0,68) (рис. 1).
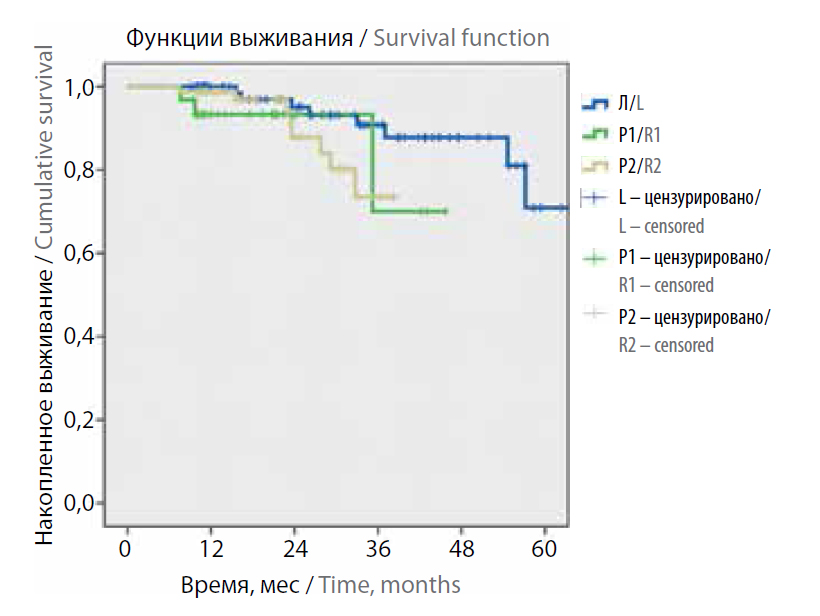 Рис. 1. Общая выживаемость больных неметастатическим раком прямой кишки в зависимости от хирургического доступа и опыта роботической хирургии
Рис. 1. Общая выживаемость больных неметастатическим раком прямой кишки в зависимости от хирургического доступа и опыта роботической хирургииБезрецидивная выживаемость также не различалась между группами Р1 и Р2 (р = 0,131), Л и Р1 (р = 0,088), Л и Р2 (р = 0,794) (рис. 2).
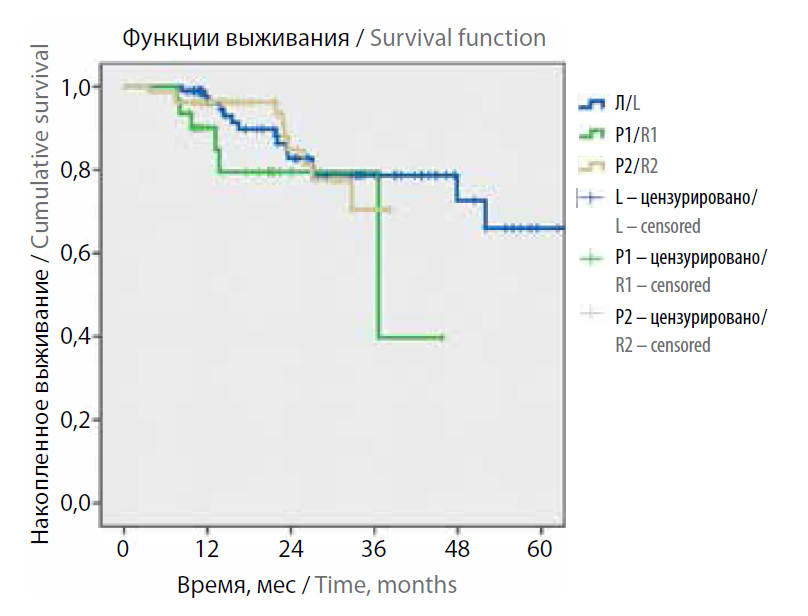 Рис. 2. Безрецидивная выживаемость больных неметастатическим раком прямой кишки в зависимости от хирургического доступа и опыта роботической хирургии
Рис. 2. Безрецидивная выживаемость больных неметастатическим раком прямой кишки в зависимости от хирургического доступа и опыта роботической хирургииОбсуждение
Мы представили результаты первого в России мультицентрового исследования, посвященного роботической хирургии РПК. Кроме того, представленный нами опыт – крупнейший в стране на сегодняшний день.
Достигнутая в нашем исследовании продолжительность роботических операций – одна из наиболее низких, представленных в литературе. Даже на этапе освоения метода медиана времени операции составила 270 мин, что существенно ниже, чем в ряде крупных исследований (365 мин у A.P. Saklani и соавт. 5, 342 мин у F. Feroci и соавт. 6, 441 мин у Y.S. Kim и соавт.7, 361 мин у M.S. Cho и соавт. 8). Нам удалось найти только 1 исследование, в котором медиана продолжительности роботических операций по поводу РПК была ниже, чем в группе Р2 нашего исследования, –
S.H. Baik и соавт. сообщили о проведении таких операций за 190 мин 9. Столь малую продолжительность операций мы связываем с эффективной организацией работы операционной команды и оптимальным методом докинга роботического хирургического комплекса.
Частота осложнений после роботических опера ций у больных РПК, по опубликованным данным, колеблется от 5,4 до 45,6 % 7, 9. Следует отметить, что интерпретировать данные результаты стоит с точки зрения качества не только хирургического лечения, но и учета всех аспектов послеоперационного периода. Из-за отсутствия учета осложнений низкой степени рядом исследователей данный показатель значительно колеблется в доступных работах. Частота осложнений в группах Л и Р2 нашего исследования сопоставима со средними показателями данных литературы. Тенденция к более высокому числу осложнений в группе Р1, хотя и не достоверная, говорит о необходимости качественной подготовки и аккуратного внедрения нового метода в клиническую практику. В группе Р1 нами также отмечена крайне высокая летальность – 9,7 %, однако столь высокие показатели могут быть связаны с особенностями вы- борки: данная группа – самая малочисленная в на- шей работе и включает всего 31 пациента. Только у 1 из 3 погибших больных причиной смерти были осложнения, непосредственно связанные с техникой операции (острая кишечная непроходимость). Из 2 других пациентов один погиб от острого коронарного синдрома, другой – от массивного кровотечения из варикозных вен пищевода.
Хотя в нашей работе не удалось получить статистически достоверных различий в частоте R0-резекций, наиболее высокие показатели (98,8 %) достигнуты именно в группе Р2. В метаанализе Y. Sun и cоавт. на материале 324 роботических и 268 лапароскопических операций по поводу РПК также было продемонстрировано преимущество использования роботического хирургического комплекса для достижения свободной от опухоли границы резекции: относительный риск 0,5, 95 % ДИ 0,25–1,01, р = 0,05 10. Возможно, что и отме- ченные в нашей работе тенденции могли быть статистически достоверными в более крупной выборке.
Более высокая частота достижения R0-резекций в группе Р2 была связана и с более частым (60,8 %) выполнением мезоректумэктомии высокого качества (III степени по шкале Quirke) в этой группе. Следует также отметить, что на этапе освоения роботической техники качество мезоректумэктомии в группе Р1 было сопоставимо с качеством мезоректумэктомии в группе Л (50,0 и 51,5 % соответственно).
Медиана наблюдения в нашем исследовании позволяет судить только о результатах первых 2 лет после лечения. Нами не отмечено различий между исследуемыми группами. В наиболее крупном доступном метаанализе F.G. Wilder и соавт. также отсутствуют различия по отдаленным результатам лапароскопических и роботических операций у больных РПК 11. Исходя из субъективного опыта использования различных доступов в хирургии РПК, следует отметить, что преимущества роботизированного комплекса в полной мере реализуются далеко не у всех пациентов. Разница в возможности прецизионного выполнения операции наиболее актуальна у так называемых сложных больных. Успешные операции в таких случаях находят свое отражение в более высоких суррогатных показателях качества хирургического лечения (частота R0-резекций, качество мезоректумэктомии). Если учесть, что даже при низком качестве удаления препарата только у небольшой доли пациентов это послужит причиной прогрессирования заболевания, мы никогда не сможем получить статистически достоверных преимуществ ни одной новой хирургической технологии по критериям отдаленных результатов лечения. Остается вопросом, позволит ли использование робота снизить кривую обучения для поколения начинающих хирургов. В нашем исследовании все специалисты имели исходный опыт малоинвазивной хирургии, что не позволяет адекватно оценивать кривую обучения роботической технике.
К достоинствам нашего исследования относятся анализ не только непосредственных, но и отдаленных результатов лечения и сравнение эффективности использования роботического хирургического комплекса на разных этапах освоения метода. Слабой стороной работы являются сравнительно небольшая медиана наблюдения и отсутствие морфологического исследования по методу P. Quirke в части наблюдений, что ограничивает репрезентативность представленного анализа качества мезоректумэктомии.
Выводы
Таким образом, роботическая хирургия может безопасно применяться у больных РПК, но ее внедрение в клиническую практику должно проводиться в условиях доступности программ обучения и под контролем опытного специалиста. Использование роботического хирургического комплекса в условиях оптимизированной системы докинга и достаточного хирургического опыта позволяет сократить время операций на прямой кишке, не повышает риск послеоперационных осложнений и обеспечивает более высокое качество мезоректумэктомии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Контакты: Дмитрий Владимирович Гладышев gladyshevd@gmail.com