Непосредственные результаты робот-ассистированных и лапароскопических вмешательств в хирургии рака сигмовидной и прямой кишки
Актуальность. За последние десятилетия лапароскопическая колоректальная хирургия стала новым стандартом лечения колоректальных заболеваний. Растущий интерес к роботическим вмешательствам обусловлен обеспечением стабильного трехмерного изображения с камеры, управляемой хирургом; угловых инструментов, имитирующих движение рук хирурга; хорошей эргономики и фильтрации физиологического тремора.
Цель – провести сравнительный анализ непосредственных результатов робот-ассистированных и традиционных лапароскопических вмешательств в хирургии рака сигмовидной и прямой кишки.
Материал и методы. В проспективное нерандомизированное исследование были включены 64 больных с новообразованиями сигмовидной и прямой кишки в период с сентября 2019 по апрель 2021 г. Основную группу составил 31 пациент, оперированный с использованием робота, контрольную – 33 пациента после лапароскопических вмешательств. Всем больным были сформированы аппаратные колоректальные анастомозы.
Результаты. Робот-ассистированные вмешательства были достоверно продолжительнее лапароскопических (263 против 225 мин, р=0,025). Сроки удаления дренажей из брюшной полости в основной группе были меньше, чем в группе сравнения (3,06 против 4,4 сут после операции, p=0,002). Средний послеоперационный койко-день составил 7,13 сут после робот-ассистированных вмешательств и 8,33 сут после лапароскопических (р=0,043). При робот-ассистированных операциях с патологическим препаратом удалялось большее количество лимфатических узлов, чем при лапароскопических (16,19±8,8 и 12,21±8,9 соответственно, р=0,045). Не было различий между сравниваемыми группами по объему интраоперационной кровопотери, коэффициенту конверсии в лапаротомию, а также по частоте развития послеоперационных осложнений.
Заключение. Робот-ассистированные резекционные вмешательства на прямой кишке безопасны и не уступают в непосредственных результатах аналогичным лапароскопическим операциям, при этом позволяют устранить большинство недостатков лапароскопической хирургии.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Для цитирования: Беджанян А.Л., Сумбаев А.А., Петренко К.Н., Фролова Ю.В., Темирсултанова Х.Р., Гончаров А.Л., Андрейцев И.Л. Непосредственные результаты робот-ассистированных и лапароскопических вмешательств в хирургии рака сигмовидной и прямой кишки // Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2022. Т. 10, № 2. С. 103–111. DOI: https://doi.org/10.33029/2308-1198-2022-10-2-103-111
На протяжении всей истории хирургии, в том числе и минимально инвазивной, хирурги старались усовершенствовать методы лечения пациентов и минимизировать оперативную травму. За последние несколько десятков лет благодаря прогрессивному развитию различных технологий и подходов, предлагаемых для лечения известных заболеваний, были достигнуты огромные успехи как в области минимально инвазивной хирургии в целом, так и в колоректальной хирургии.
С момента публикации в 1991 г. D.L. Fowler и соавт. [1] первых 2 случаев лапароскопической резекции сигмовидной кишки за последние 3 десятилетия лапароскопическая колоректальная хирургия стала новым стандартом для хирургического лечения колоректальных заболеваний. Перед открытой хирургией она имеет ряд преимуществ, таких как меньшее количество осложнений в ране и со стороны дыхательной системы (вследствие более быстрой активизации пациентов), более быстрое разрешение послеоперационного пареза желудочно-кишечного тракта (ЖКТ), меньшее количество спаек в брюшной полости, сокращение пребывания в стационаре, хороший косметический результат. При этом лапароскопические операции сопоставимы с открытыми по радикальности резекции, общей и безрецидивной выживаемости у пациентов с колоректальным раком (исследования CLASICC, COLOR II, COREAN) [2–5].
Тем не менее исследования ALaCaRT и ACOSOG [6, 7] не выявили преимуществ лапароскопической резекции в сравнении с открытой у пациентов с II–III стадией рака прямой кишки при сравнении качества удаленного препарата, что, возможно, связано с присущими лапароскопической технике недостатками (нестабильное и зависимое от ассистента изображение, ограничение степеней свободы движения инструментов, усиленный эффект тремора), которые особенно проявляются при работе в ограниченном пространстве малого таза [8–10].
Эти недостатки могут помочь преодолеть роботизированные хирургические системы за счет обеспечения стабильного трехмерного изображения с камеры, управляемой хирургом; использования угловых инструментов EndoWrist (Intuitive Surgical Inc.) с 7 степенями свободы, имитирующими движение рук хирурга; хорошей эргономики и фильтрации физиологического тремора [11]. После описания в 2001 г. Weber и соавт. первых робот-ассистированных операций на толстой кишке уже было выпущено несколько поколений роботизированного хирургического комплекса da Vinci® (Intuitive Surgical Inc., Саннивейл, Калифорния), являющегося наиболее распространенным и используемым в настоящее время [12].
Растущий интерес к роботу и все более активное его использование в колоректальной хирургии отчасти обусловлены вышеописанными техническими преимуществами перед лапароскопией. Но наряду с улучшенными техническими возможностями хирурга литературой подтверждаются данные о лучших или сопоставимых клинических результатах для пациента. Так, в ряде опубликованных метаанализов продемонстрирована достоверно меньшая кровопотеря при робот-ассистированных колоректальных операциях по сравнению как с лапароскопическими [13, 14], так и с открытыми [15]. А крупное международное рандомизированное сравнительное исследование ROLLAR [16] на 471 пациенте продемонстрировало более низкий коэффициент конверсии в роботизированной группе по сравнению с лапароскопической, а также сопоставимые результаты относительно несостоятельности колоректального анастомоза.
По данным производителя, роботизированных систем da Vinci® (компании Intuitive) на конец 2021 г. во всем мире насчитывается около 6500 роботизированных хирургических систем da Vinci®, в том числе 34 системы в России. Всего выполнено 10 млн робот-ассистированных операций во всем мире, начиная с первых в 2000 г. В России с 2007 г. выполнено свыше 23 тыс. робот-ассистированных оперативных вмешательств, и их количество продолжает ежегодно увеличиваться [17]. Целью данного исследования является сравнительный анализ результатов робот-ассистированной и традиционной лапароскопической техник резекции при раке прямой и сигмовидной кишки.
Материал и методы
Нами проанализированы результаты 31 робот-ассистированной (основная группа) и 33 лапароскопических (группа сравнения) плановых резекционных вмешательств на прямой кишке с формированием аппаратного колоректального анастомоза в период с сентября 2019 г. по апрель 2021 г. Исследование являлось проспективным нерандомизированным. Все 33 лапароскопических операции в группе сравнения и 16 роботассистированных операций в основной группе были выполнены в ГНЦ РФ ФГБНУ «РНЦХ им. акад. Б.В. Петровского», другие 15 последовательно выполненных робот-ассистированных вмешательств – на базе ГБУЗ «ГКБ № 31» ДЗМ. Все операции в каждом из учреждений выполнялись одной бригадой хирургов. Для включения пациентов в исследование использовались следующие критерии:
- возраст старше 18 лет;
- наличие верифицированной злокачественной опухоли прямой кишки или ректосигмоидного перехода;
- выполнение лапароскопической или роботассистированной резекции прямой кишки с формированием аппаратного колоректального анастомоза;
- согласие пациента на участие в исследовании.
Проведение неоадъювантной химиолучевой терапии и формирование разгрузочной илео- или колостомы не являлись критериями исключения. Пациенты были исключены из исследования в следующих случаях:
- отказ пациента на любом этапе исследования;
- осложненные опухоли (перфорация, абсцесс);
- декомпенсация коморбидных заболеваний;
- острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК) в анамнезе за 6 мес и менее до госпитализации;
- планируемый лапаротомный доступ.
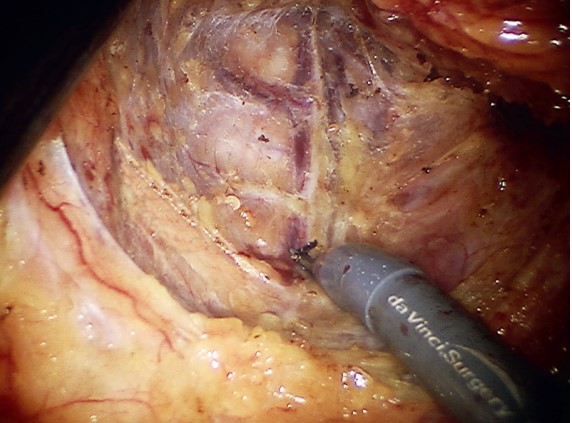 Робот-ассистированная тотальная мезоректумэктомия
Робот-ассистированная тотальная мезоректумэктомия
Операции как при лапароскопическом, так и при роботизированном способе выполнялись в положении пациента на спине с разведенными и согнутыми в коленных и тазобедренных суставах ногами, фиксированными при помощи упоров типа «сапожки». При этом пациенты позиционировались в положение Тренделенбурга (угол наклона 25–30о) с поворотом на правый бок. Все лапароскопические операции были выполнены с использованием лапароскопической стойки Karl Storz (Karl Storz SE & Co. KG, Германия). Робот-ассистированные вмешательства выполнялись при помощи роботизированного комплекса da Vinci Si (Intuitive Surgical Inc., Саннивейл, Калифорния). При обеих методиках применялась стандартизированная техника лапароскопического вмешательства с соблюдением онкологической радикальности [18] и включала следующие этапы: сосудистую изоляцию с пересечением нижних брыжеечных артерии и вены; медиальную и латеральную мобилизацию нисходящей ободочной и сигмовидной кишки с брыжейкой (при необходимости мобилизация селезеночного изгиба ободочной кишки); мобилизацию прямой кишки с мезоректальной клетчаткой и ее пересечение (рис.); пересечение кишки по проксимальной границе; формирование циркулярного аппаратного анастомоза. При локализации опухоли в верхнеампулярном отделе прямой кишки или в ректосигмоидном переходе выполнялась частичная (парциальная) мезоректумэктомия. Пациентам с опухолью средне- и нижнеампулярного отделов прямой кишки была выполнена тотальная мезоректумэктомия (ТМЭ).
В сравнительный анализ были включены следующие характеристики пациентов: возраст, пол, индекс массы тела (ИМТ), класс физического статуса Американского общества анестезиологов (ASA), сопутствующая патология, неоадъювантная химиолучевая терапия, выполненная операция, патологическая T-стадия опухоли, экстрамуральная сосудистая инвазия и поражение мезоректальной фасции. Периоперационные показатели включали продолжительность операции, кровопотерю, конверсию в лапаротомию, наличие эпидурального компонента анестезии, количество наркотических обезболивающих во время операции, время докинга (стыковки) при робот-асссистированных операциях. Краткосрочные послеоперационные результаты оценивались при помощи количества послеоперационных койко-дней, наличия осложнений, повторных госпитализации и операции, 30-дневной летальности, сроков удаления последнего дренажа. В анализ были включены также количество удаленных лимфоузлов и чистота границ резекции (R0).
Статистическая обработка и анализ полученных данных проводились с использованием программного обеспечения Statistica 13 компании StatSoft. Статистически значимым принималось значение p<0,05.
Результаты
В группе робот-ассистированных операций было выполнено 19 передних и 12 низких передних резекций прямой кишки. В лапароскопической группе сравнения выполнено 22 передних, 10 низких передних резекций прямой кишки и 1 брюшноанальная резекция.
Не было статистически значимого (p>0,05) различия между группами по полу, возрасту, ИМТ, наличию сопутствующей патологии, статусу ASA [19] и Т-критерию опухоли, согласно международной классификации TNM. Распределение пациентов по группам сравнения и их характеристики представлены в табл. 1. Среди сопутствующей патологии в обеих группах превалировали сердечно-сосудистые заболевания. В анализ также включены заболевания дыхательной системы, ЖКТ и прочие (варикозная болезнь вен нижних конечностей, хроническая ишемия головного мозга, хроническая болезнь почек, гиперплазия простаты, миома матки, сахарный диабет).
У 1 пациента в роботизированной группе и у 3 пациентов в группе лапароскопии по данным предоперационной магнитно-резонансной томографии (МРТ) в опухолевый процесс была вовлечена мезоректальная фасция. Также экстрамуральная венозная инвазия имелась у 2 пациентов в основной и у 3 пациентов в контрольной группах, а поражение экстрамуральных лимфатических узлов на дооперационном этапе было выявлено у 2 и 4 пациентов в основной и контрольной группах соответственно.
Таблица 1. Распределение пациентов по группам
|
Показатель |
Группа |
р |
|
|---|---|---|---|
|
основная (n=31) |
контрольная (n=33) |
||
|
Возраст, годы, М±SD |
63,34±9,9 |
63,28±9,4 |
0,63 |
|
Медиана индекса массы тела, кг/м2 (Q1–Q3) |
27 (24,1–29) |
27 (24–29) |
0,07 |
|
Ожирение |
8 (25,8%) |
6 (18,2%) |
0,89 |
|
Пол: |
|||
|
мужчины |
16 (51,6%) |
15 (45,5%) |
0,80 |
|
женщины |
15 (49,4%) |
18 (54,5%) |
|
|
Сопутствующая патология: |
|||
|
сердечно-сосудистая система |
22 (71%) |
26 (79%) |
0,32 |
|
дыхательная система |
2 (7%) |
5 (15%) |
0,27 |
|
желудочно-кишечный тракт |
10 (32,3%) |
7 (21%) |
0,32 |
|
прочие |
16 (52%) |
17 (52%) |
0,81 |
|
всего пациентов с коморбидной патологией |
29 (93,5%) |
27 (81,8%) |
0,16 |
|
Класс ASA: |
0,09 |
||
|
I |
3 (9,7%) |
1 (3%) |
|
|
II |
21 (67,7%) |
18 (54,6%) |
|
|
III |
7 (22,6%) |
14 (42,4%) |
|
|
Курение |
5 (16,1%) |
4 (12,1%) |
0,65 |
|
Операция: |
0,53 |
||
|
передняя резекция |
19 (61,3%) |
22 (66,7%) |
|
|
низкая передняя резекция |
12 (38,7%) |
10 (30,3%) |
|
|
брюшно-промежностная экстирпация |
1 (3%) |
||
|
pT стадия опухоли: |
0,32 |
||
|
0 |
2 (6,4%) |
5 (15,2%) |
|
|
1 |
1 (3,2%) |
0 |
|
|
2 |
10 (32,3%) |
9 (27,3%) |
|
|
3 |
18 (58,1%) |
18 (54,5%) |
|
|
4 |
0 |
1 (3%) |
|
|
Неоадъювантная химиолучевая терапия |
5 (16,1%) |
9 (27,3%) |
0,29 |
|
MRF+ |
1 (3,2%) |
3 (9,1%) |
0,34 |
|
EMVI+ |
2 (6,4%) |
3 (9,1%) |
0,69 |
|
EMLN+ |
2 (6,4%) |
4 (12,1%) |
0,44 |
Примечание. ASA (American Society of Anesthesiologists) – Американское общество анестезиологов; MRF (mesorectalfascia) – мезоректальная фасция; EMVI (extramural vascular invasion) – экстрамуральная сосудистая инвазия; EMLN (extramurallymph node) – поражение экстрамуральных лимфатических узлов.
Полученные интраоперационные и послеоперационные результаты представлены в табл. 2.
Таблица 2. Интраоперационные и послеоперационные результаты
|
Показатель |
Группа |
р |
|
|---|---|---|---|
|
основная (n=31) |
контрольная (n=33) |
||
|
Средняя продолжительность операции, мин |
263 |
225 |
0,025 |
|
Средняя кровопотеря, мл |
70,6 |
81,6 |
0,49 |
|
Конверсия (лапаротомия) |
1 |
2 |
0,17 |
|
Средний послеоперационный койко-день |
7,13 |
8,33 |
0,043 |
|
Количество наркотических анальгетиков во время операции, М±SD |
8,16±1,85 |
6,57±1,88 |
0,0003 |
|
Удаление последнего дренажа (средние сутки после операции) |
3,06 |
4,4 |
0,002 |
|
Количество удаленных лимфоузлов, М±SD |
16,19±8,8 |
12,21±8,9 |
0,045 |
|
R0-резекция |
31 (100%) |
32 (96,7%) |
0,33 |
|
Осложнения (I степень по Clavien–Dindo) |
4 (12,9%) |
8 (24,2%) |
0,25 |
|
Повторная госпитализация (30 дней) |
0 |
0 |
– |
|
Повторная операция (30 дней) |
0 |
0 |
– |
|
Летальность (30 дней) |
0 |
0 |
– |
|
Несостоятельность анастомоза |
0 |
0 |
– |
Послеоперационные осложнения развились у 4(12,9%) пациентов в основной и у 8 (24,2%) пациентов в контрольной группах. Все они относились к I степени по классификации Clavien–Dindo. Повторных 30-дневных госпитализаций, операций,30-дневной летальности, а также несостоятельности анастомоза не было ни в одной из сравниваемых групп.
В ходе проведенного регрессионного унивариантного анализа (табл. 3) было выявлено достоверное влияние продолжительности операции и частоты конверсии в лапаротомию на частоту послеоперационных осложнений, что также статистически значимо коррелировало с длительностью нахождения в стационаре после операции. При мультивариантном анализе статистически значимая взаимосвязь послеоперационных осложнений установлена только с продолжительностью операции и количеством послеоперационных койкодней.
Таблица 3. Унивариантный и мультивариантный анализ факторов, влияющих на осложнения
| Фактор | Унивариантный анализ | Мультивариантный анализ | |||||
|---|---|---|---|---|---|---|---|
| ОШ | 95% ДИ нижний | 95% ДИ верхний | p | 95% ДИ нижний | 95% ДИ верхний | p | |
| Возраст | 1,0008 | 0,018 | 0,405 | 0,38 | |||
| Индекс массы тела | 1,01 | 0,05 | 0,5 | 0,49 | |||
| Пол | 2,22 | 0,09 | 0,10 | 0,24 | |||
| Класс ASA | 1,10 | 0,08 | 0,11 | 0,25 | |||
| Курение | 0,30 | 0,37 | 0,29 | 0,54 | |||
| Сопутствующая патология | 2,31 | 0,19 | 0,18 | 0,27 | |||
| Операция | 0,20 | 0,33 | 0,38 | 0,62 | |||
| Химиолучевая терапия | 0,82 | 0,53 | 0,48 | 0,14 | |||
| pT стадия опухоли | 1,18 | 0,12 | 0,26 | 0,81 | |||
| Продолжительность операции | 1,42 | 0,004 | 0,69 | 0,008 | 0,13 | 0,55 | 0,0016 |
| Кровопотеря | 1,41 | 0,0007 | 0,09 | 0,26 | |||
| Конверсия | 0,004 | 1,45 | 0,57 | 0,004 | 0,008 | 0,399 | 0,06 |
| Послеоперационный койко-день | 0,43 | 0,09 | 0,53 | 0,007 | 0,16 | 0,57 | 0,0006 |
| Количество удаленных лимфоузлов | 1,007 | 0,007 | 0,14 | 0,35 | |||
| Количество наркотических анальгетиков во время операции | 0,72 | 0,007 | 0,27 | 0,92 | |||
| Удаление последнего дренажа | 0,66 | 0,07 | 0,27 | 0,65 | |||
Примечание. ОШ – отношение шансов; ДИ – доверительный интервал.
Обсуждение
Развитие минимально инвазивной хирургии изменило подход к хирургическому лечению колоректальных заболеваний, позволив хирургам в более удобных условиях выполнять, а пациентам переносить, сложные колоректальные резекции. Роботизированные вмешательства как еще один метод малоинвазивной хирургии были разработаны для преодоления присущих лапароскопическим операциям трудностей и продолжают все шире использоваться во всем мире. Но наряду с достижениями и преимуществами этой технологии все еще присущи и некоторые недостатки, например высокая стоимость и длительность операций[20]. Однако последний фактор является предметом дальнейших дискуссий.
В нашем исследовании средняя продолжительность робот-ассистированных операций была больше лапароскопических, что соответствует результатам ряда других ранее проведенных исследований [21–23]. В то же время другие авторы продемонстрировали схожее время при роботизированных и лапароскопических вмешательствах на прямой кишке [24, 25]. Также по результатам нашего исследования объем использованных наркотических обезболивающих во время операции был больше в робот-ассистированной группе, что связано с большей продолжительностью этих операций. Стоит отметить, что значительный вклад в продолжительность робот-ассистированных вмешательств вносит процесс докинга – стыковкии расстыковки робота [26–28], и время операцииможет быть уменьшено по мере повышения опыта хирургической бригады [29, 30].
Как показывают наши результаты, продолжительность пребывания в стационаре после операции в робот-ассистированной группе была достоверно короче в среднем на 1 день, чем в лапароскопической (р=0,043). Также частота послеоперационных осложнений была ниже после робот-ассистированных вмешательств (12,9 против 24,2%). И хотя эта разница не явилась статистически значимой (р=0,25), следует предположить, что легкие послеоперационные осложнения (парез кишечника, серомы и инфицирование послеоперационных ран и др.) могут обусловливать более длительное нахождение в стационаре после лапароскопических резекций прямой кишки. Ряд другихавторов также отмечают более короткий послеоперационный койко-день после робот-ассистированных колоректальных операций по сравнению с лапароскопическими [31–33]. Еще одним фактором,влияющим на длительность госпитализации после операции, является продолжительность дренирования брюшной полости. Мы удаляли дренаж из малого таза при объеме отделяемого <100 мл,и удаление после роботизированных операций происходило в среднем на 1 сут раньше, чем после лапароскопических (3,06 против 4,4 сут, р=0,002).S.P. Ye и соавт. продемонстрировали схожие результаты в своем исследовании [34].
При анализе патоморфологических данных мы установили, что среднее количество удаленных лимфатических узлов в препарате составило 16,19±8,8 шт. в группе робот-ассистированных операций и 12,21±8,9 шт. в группе лапароскопических вмешательств (р=0,045). Возможно, такой результат является следствием хорошей визуализации и более точной диссекции при роботизированных операциях. Подобные результаты получили F. Ferrara и соавт., в их исследовании количество удаленных лимфоузлов в роботизированной и лапароскопической группах составило 18,8 и 14,6 соответственно (р<0,001) [35]. Однако большинство научных работ, включая крупное международное сравнительное исследование ROLLAR, демонстрируют схожее количество удаленных лимфоузлов как при робот-ассистированных, так и при лапароскопических колоректальных хирургических вмешательствах [16, 28].
Ни в одной из групп не было повторных 30-дневных госпитализаций и операций, 30-дневной летальности, а также несостоятельности анастомоза, что, вероятно, связано со сравнительно небольшим объемом выборки исследуемых групп.
Заключение
Робот-ассистированные резекционные вмешательства на прямой кишке осуществимы, безопасны и не уступают в непосредственных результатах аналогичным лапароскопическим операциям, а также могут устранить большинство недостатков лапароскопической хирургии. Результаты нашего исследования показали, что робот-ассистированные операции при раке прямой кишки связаны с более ранним удалением дренажа из брюшной полости, меньшей продолжительностью нахождения в стационаре после операции и большим количеством удаляемых ́ с патологическим препаратом лимфоузлов. Пока, по нашим данным, робот-ассистированные операции продолжительнее лапароскопических, но мы рассчитываем, что время будет уменьшаться по мере накопления опыта хирургической бригадой. Роботизированная колоректальная хирургия – новое, актуальное и совершенствующееся направление в развитии малоинвазивной хирургии, которое нуждается в дальнейших масштабных исследованиях.