Интракорпоральный изоперистальтический линейный колоректальный «бок-в-бок» (overlap) анастомоз: концепция создания и первые результаты
Резюме
ВВЕДЕНИЕ: аппаратный циркулярный анастомоз долгие годы остается вариантом выбора при лапароскопической передней резекции прямой кишки, хотя частота несостоятельности и стриктур составляют 11,2% и 13,0%, соответственно. Техника формирования данного анастомоза сопряжена с техническими особенностями фиксации упорного устройства циркулярного сшивающего аппарата, что в большинстве случаев требует экстракорпорального этапа операции. Последний увеличивает продолжительность операции и уменьшает преимущества лапароскопического доступа, в том числе делает нецелесообразным удаление препарата через естественные отверстия (Natural Orifice Specimen Extraction, NOSE). ЦЕЛЬ: описать опыт применения нового интракорпорального линейного колоректального анастомоза по методике «overlap» при лапароскопической передней резекции прямой кишки. ПАЦИЕНТЫ И МЕТОДЫ: в статье представлены результаты применения нового линейного «overlap» анастомоза у пациентов, перенесших лапароскопическую переднюю резекцию прямой кишки в период с октября 2023 г. по февраль 2024 г. Результаты оценивались по продолжительности операции, частоте и тяжести послеоперационных осложнений по Clavien–Dindo, частоте конверсий, длительности госпитализации, оценке качества жизни (опросник SF-36) через 30 дней после операции. РЕЗУЛЬТАТЫ: интракорпоральный линейный «overlap» анастомоз сформирован у 10 пациентов (5 женщин и 5 мужчин), средний возраст которых составил 62,0 ± 9,03 лет, а среднее значение ИМТ составило 27,5 ± 7,2 кг/м2. Интраоперационных осложнений не отмечено. У 1 пациента имела место серома послеоперационной раны (Clavien-I). Первое отхождение кала наблюдалось на 1 (0–3) сутки. Среднее послеоперационное пребывание в стационаре составило 5,7 ± 1,89 койко-дней. ЗАКЛЮЧЕНИЕ: первые результаты демонстрируют простоту и безопасность интракорпорального линейного анастомоза по методике «overlap». Требуется проведение дальнейших исследований.
КОНФЛИКТ ИНТЕРЕСОВ: авторы заявляют об отсутствии конфликта интересов.
ДЛЯ ЦИТИРОВАНИЯ: Сажин А.В., Ермаков И.В., Ивахов Г.Б., Лебедев И.С., Далгатов К.Д., Полторацкий М.В., Шихин И.С., Тимошенко Н.А. Интракорпоральный изоперистальтический линейный колоректальный «бок-в-бок» (overlap) анастомоз: концепция создания и первые результаты. Колопроктология. 2024; т. 23, № 3, с. 50–58. https://doi.org/10.33878/2073-7556-2024-23-3-50-58.
Введение
огласно данным Всемирной организации здравоохранения, в мире сохраняется тенденция к росту заболеваемости колоректальным раком (КРР) [1]. Хирургическое лечение является основным методом радикального лечения КРР [2]. Лапароскопический доступ рассматривается как альтернатива открытой операции, имеющий преимущества в виде уменьшения операционной травмы, быстрого восстановления функций желудочно-кишечного тракта, ранней активизации и ранней выписки пациента из стационара со схожими онкологическими результатами [3–5]. Двустеплерная методика (double-stapling technique, DST) является наиболее распространенной при формировании аппаратного циркулярного колоректального анастомоза. Частота несостоятельности и развития стриктуры анастомоза после передней резекции прямой кишки с применением методики DST составляет, по данным литературы, 11,2% и 13%, соответственно [6,7]. Основными причинами развития данных осложнений считаются неадекватное кровоснабжение и натяжение зоны анастомоза [8,9]. Способ формирования анастомоза также влияет на его прочность и сегодня рассматривается как один из факторов риска несостоятельности [7,10– 11]. При формировании циркулярного аппаратного анастомоза в половине случаев несостоятельность анастомоза развивалась по линии циркулярного шва в зоне перекрытия скоб циркулярного и линейного степлеров [10], а также в месте формирования так называемых «собачьих ушей» — «dog-ears» [7]. В основном исследования направлены на поиск новых способов профилактики несостоятельности и дополнительных методов укрепления зоны циркулярного аппаратного шва, позволяющих избежать несостоятельности анастомоза при передней резекции прямой кишки [7,12,13]. На этом фоне поиск новых и альтернативных аппаратному циркулярному анастомозу методов формирования колоректального анастомоза сохраняет свою актуальность. Так, например, техника формирования интракорпорального анастомоза с помощью линейных сшивающих аппаратов (delta-shaped anastomosis) была предложена в 2002 году [14]. Позже, в 2010 году, Inaba K. предложил «overlap» метод формирования эзофагоэнтероанастомоза [15]. Объединив эти два варианта интракорпорального анастомоза, Zhou H.T. в 2017 г. выполнил полностью лапароскопическую резекцию толстой кишки [16].
В проанализированной отечественной и мировой литературе отсутствуют данные о применении линейного «overlap» анастомоза при передних резекциях прямой кишки.
Цель
Цель данной работы описать опыт применения нового интракорпорального линейного колоректального «overlap» анастомоза при лапароскопической передней резекции прямой кишки.
Пациенты и методы
Данное исследование представляет собой анализ серии операций, выполненных в период с октября 2023 г. по февраль 2024 г. в ММКЦ «Коммунарка», являющимся базой кафедры факультетской хирургии №1 РНИМУ им Н.И. Пирогова. Исследование не противоречит действующим рекомендациям по лечению КРР [2]. Критериями включения в исследование являлись возраст 18–80 лет, подписанное информированное добровольное согласие, ASA I-II, ECOG 0-1, клиническая стадия сТ1-Т4, гистологически подтвержденная аденокарцинома дистальной трети сигмовидной кишки, ректосигмоидного отдела ободочной кишки или верхнеампулярного отдела прямой кишки. Пациенты, которым в итоге анастомоз был сформирован с помощью циркулярного сшивающего аппарата, в рамках исследования не рассматривались. Безопасность предложенного нового метода формирования анастомоза оценивалась по частоте и тяжести осложнений в послеоперационном периоде (до 30 дней после операции) с использованием классификации Clavien–Dindo [17] и длительности госпитализации. Сложность формирования анастомоза оценивалась по частоте технических конверсий, продолжительности операции и объему интраоперационной кровопотери. Оценка функциональных результатов проводилась путем анкетирования пациентов через 30 дней после операции с использованием опросника SF-36.
Статистическая обработка выполнена с использованием коммерческого пакета программного обеспечения Jamovi версии 2.3.28 для MacOS. Данные представлены в виде средних значений и стандартных отклонений для количественных нормально распределенных переменных (M ± SD); в виде медианы, максимального и минимального значений — Me (Min–Max) при распределении, отличном от нормального, а также в виде абсолютных значений для категориальных данных. Анализ на нормальное распределение проведен с помощью теста Шапиро–Уилка.
Техника операции. За 30 минут до операции проводится антибиотикопрофилактика. Пациент находится на операционном столе в литотомическом положении. Используется стандартная для лапароскопической передней резекции прямой кишки расстановка троакаров: 10 мм порт в надпупочной области для 30 С0 оптики, 12 мм порт в правой подвздошной области для диссекции, клипирования и заведения сшивающего аппарата, два порта 5 мм в правом верхнем и левом нижнем квадрантах живота, дополнительный 5 мм порт в левой подвздошной области для тракции и манипуляций в тазу. Операционный стол в положении Тренделенбурга с наклоном направо, тонкую кишку и большой сальник отводят краниально. После визуализации всех анатомических ориентиров выполняется тракция сигмовидной кишки за брыжейку в направлении передней брюшной стенки. Медиа-латеральным доступом выделяется нижняя брыжеечная артерия (НБА) и вена (НБВ). Далее выполняется лимфаденэктомия из области основания НБА с высокой перевязкой НБА и НБВ. Придерживаясь принципов CME (complete mesocolic excision) и под визуальным контролем фасции Тольдта и левого мочеточника с сохранением гипогастральных нервов и тазового парасимпатического сплетения, выполняется мобилизация нисходящей, сигмовидной кишки, а затем и верхнеампулярного отдела прямой кишки. Мобилизация селезеночного изгиба ободочной кишки выполняется в случае риска натяжения предполагаемого анастомоза. Предварительно выделяется лимфоваскулярная ножка, проксимальная и дистальная границы резекции. Дистальная граница резекции, согласно клиническим рекомендациям, составляет не менее 10,0 см для рака сигмовидной кишки и не менее 5 см — при локализации рака в ректосигмоидном отделе или в верхнеампулярном отделе прямой кишки [2]. Проксимальная граница резекции намечается с учетом линии демаркации после пересечения краевой артерии и составляет не менее 10,0 см (Рис. 1).
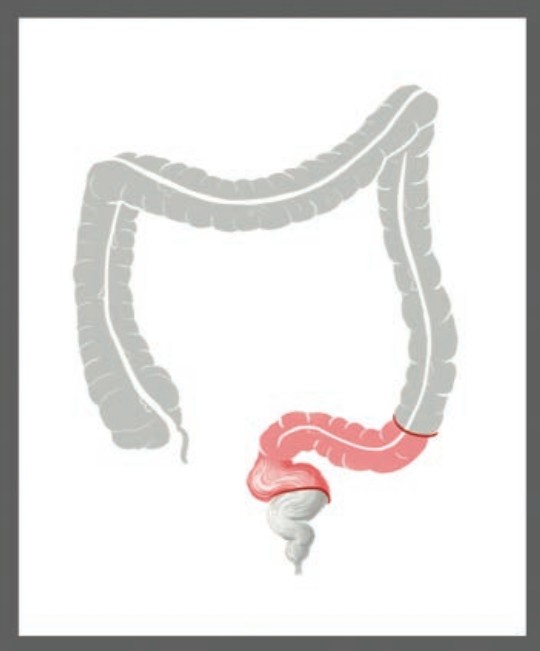 Рисунок 1. Схематичное изображение границ резекции
Рисунок 1. Схематичное изображение границ резекции
После предварительного выделения стенки кишки из клетчатки по границам резекции, кишка пересекается линейным сшивающе-режущим аппаратом (длина кассеты 60 мм с высотой скрепки 3,5 мм) (Рис. 2А). Препарат (кишка с опухолью на лимфоваскулярной ножке) помещается в контейнер. Культя прямой кишки санируется раствором повидон-йода через анус. С помощью ультразвукового скальпеля задняя полуокружность культи прямой кишки освобождается от мезоректальной клетчатки с целью создания площадки для упорной бранши линейного сшивающего аппарата при формировании межкишечного анастомоза. Далее с помощью ультразвукового скальпеля на 5 см проксимальнее линии степлерного шва на противобрыжеечном крае низводимой кишки выполняется колотомия для введения рабочей бранши сшивающего аппарата (Рис. 2В).
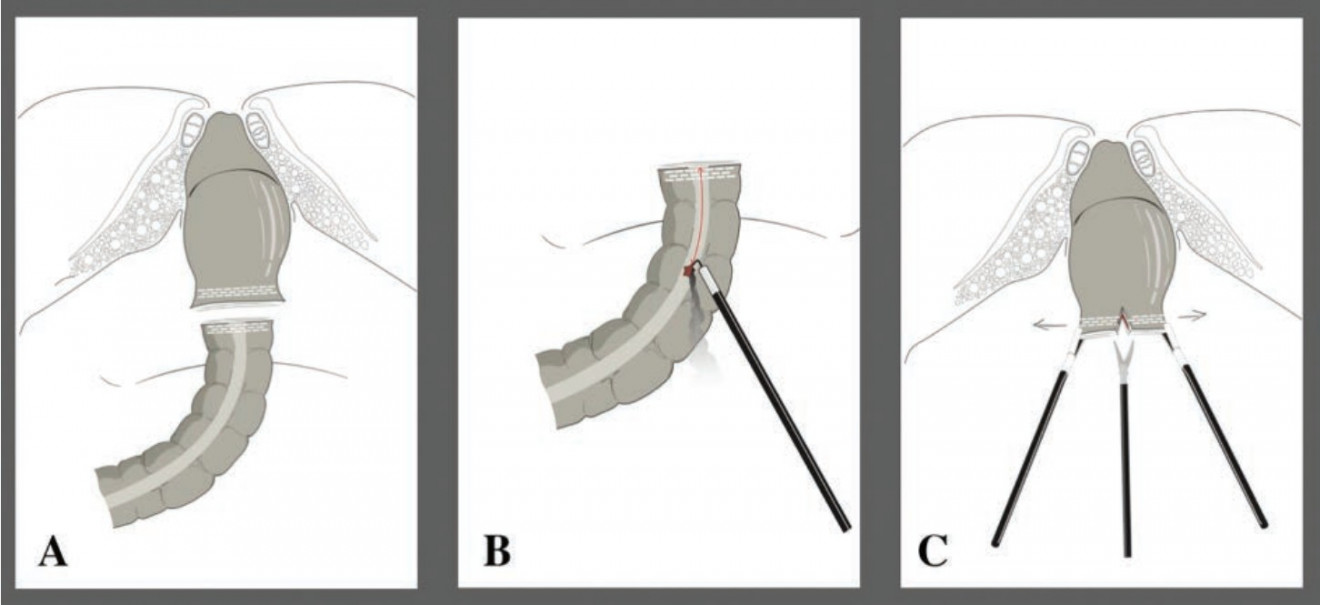 Рисунок 2. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 1.
Рисунок 2. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 1.
В центре линии степлерного шва дистальной культи перпендикулярно последней вскрывается просвет прямой кишки (Рис. 2С) и через сформированные отверстия заводятся бранши эндоскопического линейного степлера (длина кассеты 45 мм с высотой закрытия скрепки 3,5 мм) так, чтобы линия степлерного шва располагалась по задней стенке прямой кишки, упорной браншей аппарата вверх (Рис. 3А–С, Рис. 4В).
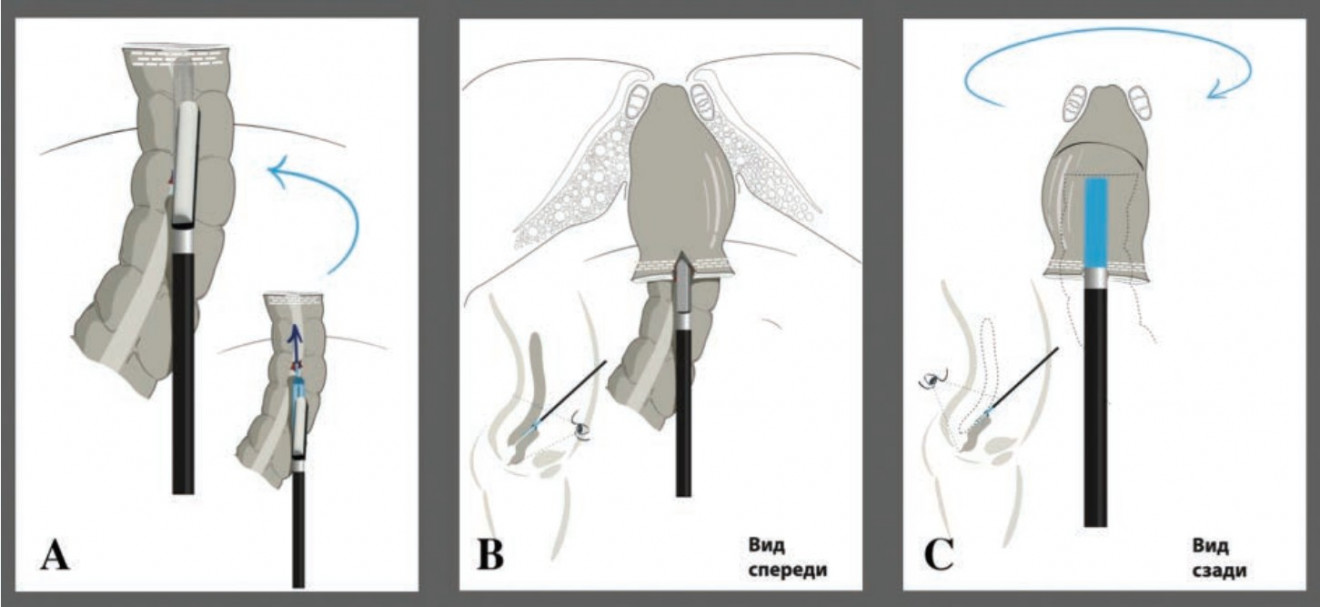 Рисунок 3. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 2.
Рисунок 3. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 2.
После чего формируется интракорпоральный линейный изоперистальтический колоректальный «бок-в-бок» (overlap) анастомоз (Рис. 4А). Технологическое отверстие ушивается в поперечном направлении однорядным непрерывным швом монофиламентной длительно рассасывающейся нитью 3-0 или 4-0 (Рис. 4С).
 Рисунок 4. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 3
Рисунок 4. Схематичное изображение формирования интракорпорального линейного анастомоза по методике «overlap», часть 3
Дополнительное укрепление вторым рядом швов допускается. Обязательно выполняется оценка герметичности сформированного анастомоза с помощью теста с красителем (р-р повидон-йода) или воздухом (bubble-test), выполненного через анус. Препарат удаляется через поперечную минилапаротомию по Пфанненштилю или через поперечный трансректальный доступ. У женщин извлечение препарата возможно через кольпотомию, выполненную с помощью ультразвукового скальпеля с последующим трансвагинальным доступом с обязательным использованием раневого протектора. Дефект задней стенки влагалища восстанавливается однорядным непрерывным швом нитью викрил 2-0. Операция заканчивается дренированием брюшной полости и послойным ушиванием послеоперационных ран. Видеозапись формирования анастомоза можно просмотреть по ссылке https://www.youtube.com/watch?v=mUhAgM7cCzE [18].
Результаты
В период с октября 2023 г. по февраль 2024 г. на базе кафедры факультетской хирургии № 1 в отделении абдоминальной онкологии в ММКЦ «Коммунарка» разработан новый вариант формирования интракорпорального линейного анастомоза по методике «overlap» у 10 пациентов (5 женщин и 5 мужчин). Основные параметры пациентов представлены в таблице 1. Средний возраст пациентов составил 62 ± 9,03 лет, индекс массы тела составил 27,5 ± 7,2 кг/м2. Двое пациентов оперированы после проведения курсов неоадъювантной химиотерапии — сТ4. Во всех случаях анастомоз был сформирован ниже промонториума на уровне с тазовой брюшиной. Герметичность анастомоза оценивалась посредством проведения пробы с повидон-йодом у 4 пациентов, воздушной пробы у 5 пациентов и интраоперационной эндоскопии у 1 пациента. Во всех случаях проба на герметичность оказалась отрицательной. У 8 пациентов препарат удален через минилапаротомный доступ по Пфанненштилю, у 1 пациента через трансректальный доступ и у 1 пациентки через кольпотомию с трансвагинальным извлечением препарата. Интраоперационных осложнений, а также случаев конверсии во время формирования анастомоза не наблюдалось. Средняя продолжительность операции составила 272 ± 73,15 минут. Объем кровопотери, в среднем, составил 15 мл (10–220 мл). Медиана количества удаленных лимфатических узлов составила 12 (12–40). Первый стул наблюдался на 1 (0–3) сутки. Средняя длительность госпитализации после операции составила 5,7 ± 1,89 койко-дней. Период наблюдения за пациентами составил 30 дней. У 1 пациента имела место серома послеоперационный раны (Clavien-I), других послеоперационных осложнений и 30-дневной реадмиссии в анализируемой группе пациентов не отмечено. Признаков прогрессирования заболевания не выявлено. По данным контрольной эндоскопии через 30 дней после операции в анализируемой группе пациентов эндоскоп диаметром 12 мм свободно проходит через зону анастомоза (Рис. 5). Анкетирование пациентов с использованием опросника SF-36 через 30 дней показало, что 9 из 10 пациентов оценивает свой уровень качества жизни, как высокий.
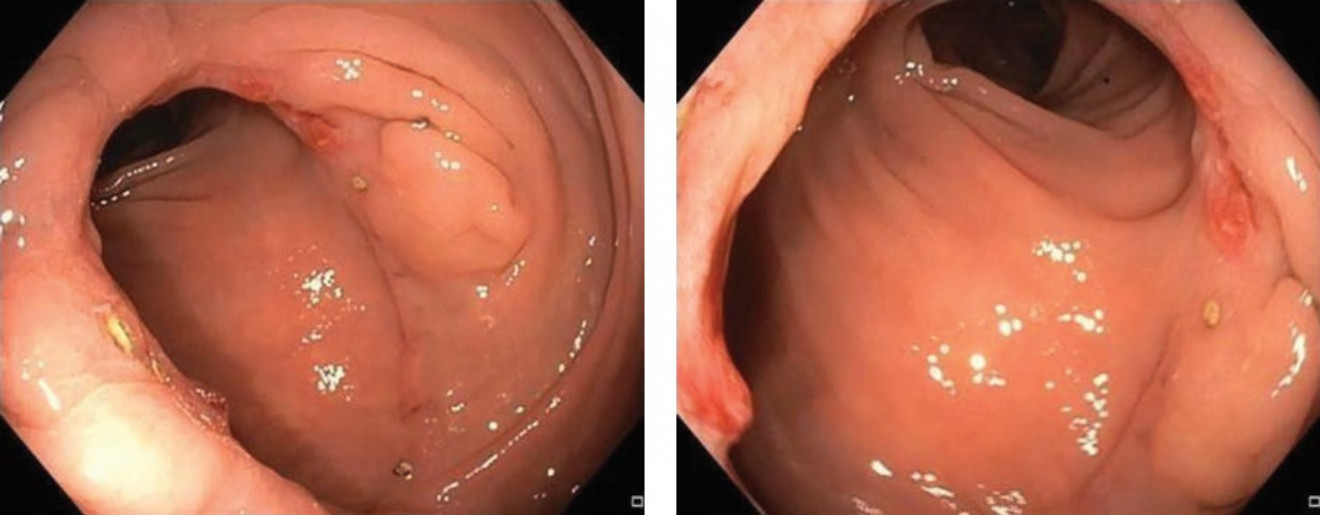 Рисунок 5. Эндоскопическая картина анастомоза при колоноскопии через 30 дней после операции
Рисунок 5. Эндоскопическая картина анастомоза при колоноскопии через 30 дней после операции
Таблица 1. Характеристика пациентов, включенных в исследование
| № | Пол | Возраст | ИМТ | ASA | Время операции | Кровопотеря | Стадия TNM | Стадия pT | Койко-день* |
|---|---|---|---|---|---|---|---|---|---|
| 1 | муж | 59 | 20,2 | II | 295 | 10 | IIA | 3 | 7 |
| 2 | муж | 47 | 27,7 | II | 335 | 50 | I | 1 | 4 |
| 3 | муж | 72 | 22,2 | II | 405 | 220 | IIIB | 3 | 4 |
| 4 | муж | 46 | 27,4 | II | 235 | 10 | IIIB | 3 | 4 |
| 5 | жен | 69 | 32,7 | II | 175 | 10 | IIA | 3 | 9 |
| 6 | жен | 67 | 21,4 | II | 215 | 50 | IIA | 3 | 7 |
| 7 | жен | 64 | 25,3 | II | 250 | 10 | IIIC | 4b | 6 |
| 8 | жен | 61 | 35,7 | II | 245 | 10 | I | 2 | 6 |
| 9 | муж | 69 | 41,7 | II | 355 | 200 | I | 2 | 3 |
| 10 | жен | 66 | 20,2 | II | 210 | 20 | IIIB | 4a | 7 |
Примечание: * — учитывалось количество дней пребывание пациента после операции
Обсуждение
Лапароскопическая передняя резекция прямой кишки сопровождается высокой частотой послеоперационных осложнений, достигающих 26,1% [19]. Применяемая у пациентов при передней резекции прямой кишки техника формировании циркулярного колоректального анастомоза double-stapling technique является наиболее распространенной в мировой практике [7]. Однако данная техника имеет свои недостатки. Во-первых, такой вариант формирования анастомоза в большинстве случаев требует наличие экстракорпорального этапа операции, во время которого происходит выведение участка кишки с опухолью в минилапаротомную рану для резекции участка кишки, а также погружения и фиксации упорной части циркулярного аппарата в просвете низводимой кишки. Вариант формирования циркулярного колоректального анастомоза исключительно интракорпорально при лапароскопической передней резекции прямой кишки сопряжен с техническими особенностями фиксации упорной части циркулярного сшивающего аппарата непосредственно в брюшной полости. В литературе предложены различные авторские методики заведения в брюшную полость и в просвет кишки упорного устройства и варианты его фиксации [20,21]. Последние сложны, требуют необходимого опыта, расходного материала, и поэтому хирурги отдают предпочтение ставшему уже традиционным экстракорпоральному варианту заведения и фиксации упорного устройства. Такой подход уменьшает преимущества лапароскопического доступа, а сам процесс формирования циркулярного анастомоза требует ассистенции оператором циркулярного сшивающего аппарата и создает неэргономичную ситуацию в случае необходимости укрепления аппаратного шва. Применение интракорпорального линейного колоректального «overlap» анастомоза несет в себе все преимущества интракорпорального анастомоза и позволяет выполнить переднюю резекцию прямой кишки полностью лапароскопическим доступом. В нашей серии из 10 случаев не было отмечено ни одного интраоперационного осложнения и технической конверсии лапароскопического доступа, что, по нашему мнению, позволяет считать данный метод формирования анастомоза технически не сложным (простым). У 1 пациентки интракорпоральное формирование анастомоза позволило удалить препарат через кольпотомию, выполненную с помощью ультразвукового скальпеля с последующим трансвагинальным извлечением препарата.
Частота несостоятельности циркулярного аппаратного анастомоза, по данным Yang Y., составляет 11,2% и не имеет тенденции к снижению на протяжении последних лет [7]. В половине случаев несостоятельность анастомоза развивалась по линии циркулярного шва в зоне перекрытия скоб циркулярного и линейного степлеров, а также на месте формирования так называемых «собачьих ушей» — «dog-ears» [7,10]. В то время, когда большинство исследований направлены на поиск дополнительных методов укрепления циркулярного аппаратного шва, позволяющих избежать несостоятельности анастомоза при передней резекции прямой кишки [7,10,11], мы предлагаем подойти к проблеме со стороны самого способа формирования анастомоза. Техника формирования интракорпорального анастомоза с помощью линейных сшивающих аппаратов на левой половине ободочной кишки ниже уровня промонториума в литературе мало изучена.
Интракорпоральный анастомоз с применением линейных степлеров наиболее часто формируется при лапароскопической правосторонней гемиколэктомии. По данным литературы, частота несостоятельности интракорпорального анастомоза при правосторонней гемиколэктомии составляет 1,4% [22]. Частота несостоятельности интракорпорального анастомоза при левосторонней гемиколэктомии немного выше и составляет 2,17% [23]. Снижение частоты несостоятельности объясняется тем, что интракорпоральный анастомоз требует меньшей мобилизации кишки из-за отсутствия экстракорпорального этапа операции. Кроме того, отсутствие экстракорпорального этапа снижает риск травмы брыжейки при ее тракции и, соответственно, снижает риск кровотечения и ишемии стенки. Пересечение кишки выполняется под визуальным контролем с учетом линии демаркации [22,23]. По сравнению с циркулярным аппаратным анастомозом, предложенный «overlap» анастомоз исключает появление зоны перекрытия скоб линейного и циркулярного степлеров, формируется с использованием линейного 3-х рядного степлера, что, по нашему мнению, влияет на прочность данного анастомоза и, возможно, на частоту развития несостоятельности. Интраоперационное рутинное выполнение теста на герметичность анастомоза среди анализируемой группы пациентов положительных тестов не выявило.
В-третьих, частота развития стриктур колоректального анастомоза после применения методики DST составляет, по данным литературы, 13% [6]. Применение интракорпорального линейного аппаратного «overlap» анастомоза можно рассматривать как альтернативу циркулярному аппаратному анастомозу. При измерении диаметра плоскости изоперистальтического анастомоза, сформированного с помощью линейного сшивающего аппарата, сначала в эксперименте, а затем у пациента при КРР было получено увеличение площади анастомоза практически в 3 раза по сравнению с применением циркулярного аппарата (p < 0,001) [24]. На основании этих данных можно рассчитывать на подобную ситуацию и при низком «overlap» анастомозе.
Наблюдение за пациентами в течение 30 дней после операции по данным проведенных эндоскопических исследований стриктур в области анастомоза не выявило.
При оценке функциональных результатов путем анкетирования пациентов с использованием опросника SF-36 через 30 дней после операции 9 из 10 пациентов оценивает свой уровень качества жизни, как высокий.
Таким образом, наша серия клинических случаев показывает, что интракорпоральный линейный «overlap» анастомоз сопровождается низкой частотой послеоперационных осложнений при отсутствии несостоятельности. Функциональные результаты показывают отсутствие у пациентов ограничений, а уровень качества жизни оценивается, как высокий. Данный анастомоз требует выполнения экстракорпорального этапа операции только с целью экстракции препарата и может быть использован в сочетании с технологией NOSE (Natural Orifice Specimen Extraction). Применяя данный вариант формирования колоректального анастомоза, мы выполнили 10 лапароскопических передних резекций прямой кишки. При проведении нами литературного поиска в отечественной и иностранной литературе на сегодняшний день это единственная серия случаев использования линейного сшивающего аппарата при лапароскопической передней резекции прямой кишки. Полученные результаты диктуют необходимость проведения дальнейших исследований, включая РКИ.
Заключение
Предложенный новый интракорпоральный линейный колоректальный «overlap» анастомоз можно рассматривать как технически простой и безопасный метод формирования анастомоза. По нашему мнению, такой анастомоз может обеспечить определённые преимущества перед циркулярным анастомозом в аспекте снижения частоты несостоятельности и стриктур. Требуется проведение дальнейших исследований.
Участие авторов
Концепция и дизайн исследования: Сажин А.В., Ивахов Г.Б., Лебедев И.С., Далгатов К.Д.
Сбор и обработка материала: Ермаков И.В., Шихин И.С., Тимошенко Н.А.
Написание текста: Сажин А.В., Ивахов Г.Б., Ермаков И.В.
Иллюстрации: Полторацкий М.В.