Робот-ассистированные и лапароскопические операции при колоректальном раке
Введение
Современный этап развития хирургии колоректального рака (КРР) характеризуется широким внедрением малоинвазивных технологий. Проведенные в последнее 10-летие исследования по оценке клинической результативности лапароскопической (ЛС) хирургии КРР (COST, COLOR, CLASSICC, JCOG, COLOR-II) показали, что ЛС операции безопасны и не уступают открытым по радикальности 1–6. Одним из перспективных направлений развития малоинвазивной хирургии стало внедрение в практику робот- ассистированных (РА) операций с использованием хирургического комплекса da Vinci (Intuitive Surgical, США). К преимуществам этой системы относят трехмерное стабильное изображение операционного поля с возможностью большого увеличения, возможность работы 3 манипуляторами – «руками», оснащенными инструментами с 7 степенями свободы, отсутствие тремора, возможность масштабирования амплитуды движений, эргономичное положение хирурга за консолью. Со времени первой публикации, посвященной использованию РА операций в колоректальной хирургии 7, доказаны приемлемость и безопасность этой технологии при КРР 8–11. В отечественной научной литературе имеется небольшое число публикаций, посвященных применению РА и ЛС технологий при КРР, что побудило нас проанализировать опыт внедрения малоинвазивной хирургии КРР в условиях регионального онкологического центра.
Цель настоящего исследования – сравнительная оценка периоперационных параметров и непосредственных результатов РА и ЛС вмешательств при КРР, сравнительный анализ кривой обучения (КО) при внедрении малоинвазивных методик в хирургию КРР, а также периоперационных параметров и непосредственных результатов в зависимости от фаз КО при РА и ЛС операциях.
Материалы и методы
В основу работы положен ретроспективный анализ хирургического лечения пациентов с КРР, которым выполнены радикальные РА и ЛС вмешательства. РА операции были проведены в период с января 2015 г. по июнь 2017 г. в ГБУЗ «Клинический онкологический диспансер № 1» г. Краснодара одной бригадой хирургов, обладающей опытом ЛС вмешательств при КРР. ЛС операции выполнены в том же учреждении в период 2011–2016 гг. этим же коллективом специалистов. Показанием к операции во всех случаях была морфологически верифицированная аденокарцинома ободочной кишки и прямой кишки (ПК).
РА операции выполняли с помощью роботической хирургической системы da Vinci Si (Intuitive Surgical, США). При вмешательствах по поводу аденокарциномы ПК применяли методику единого докинга (single docking), во время операции меняли позиции роботических троакаров и рук робота на разных этапах без изменения положения консоли пациента. Применялась стандартизированная для обеих групп оперативная техника, которая описана ранее 12.
Критерии оценки включали общую продолжительность операции, для РА операций – время докинга и консольное время, кровопотерю, срок пребывания пациента в стационаре, частоту и характер осложнений, частоту конверсий. Для оценки онкологической адекватности использовали критерии, полученные при патогистологическом исследовании препарата: циркулярную границу резекции, дистальный клиренс, количество удаленных лимфатических узлов. Для анализа КО применяли метод кумулятивной суммы (CUSUM – cumulative sum) для времени операции, который позволяет выделить и количественно оценить КО. Изначально CUSUM применяли в контроле качества производственного процесса 13, в хирургии же он полезен для выявления устойчивых тенденций изменения индивидуальных показателей в сравнении с общим значением показателя, в нашем случае – времени операции 14. Кумулятивную сумму вычисляли по формуле:
CUSUM = ∑ (X – T),
где Х – продолжительность каждой операции, T – средняя продолжительность операции в целом по группе, ∑ – сумма. Статистическую обработку результатов исследования проводили с использованием программного пакета для статистического анализа Statistica 6.0 (StatSoft, США). Использовали методы описательной статистики с вычислением средних значений, стандартного отклонения и стандартной ошибки среднего. При сравнении групп по количественным признакам использовали t-критерий Стьюдента для независимых групп. Сравнение групп по качественным бинарным признакам проводили с использованием критерия согласия Пирсона (χ2). Уровень статистической значимости считали достоверным при p <0,05.
Результаты
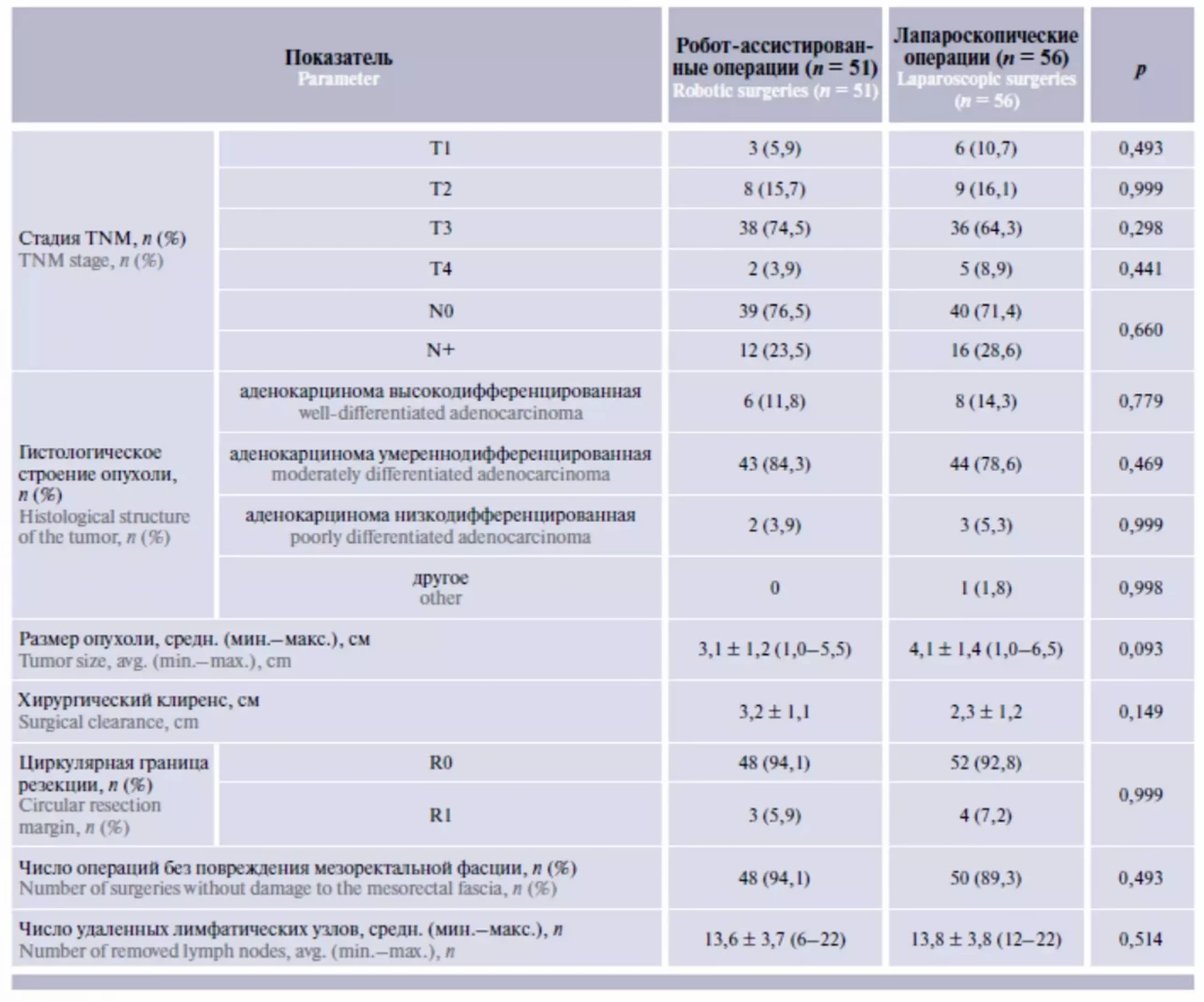
В исследование были включены данные 200 пациентов, из них 77 больным были выполнены РА вмешательства, 123 – ЛС вмешательства. Группы пациентов не имели статистически значимых различий по возрастному и половому составу, частоте сопутствующих патологий (табл. 1). По локализации опухоли группу РА операций характеризовала более высокая доля пациентов с аденокарциномой ПК (58,4 % против 37,4 % в группе ЛС операций, p = 0,005), статистически значимых различий по стадии, гистологическому строению и размерам опухоли между группами не отмечено.
Характер выполненных вмешательств представлен в табл. 1.
Таблица 1. Общая характеристика оперированных пациентов и выполненных вмешательств
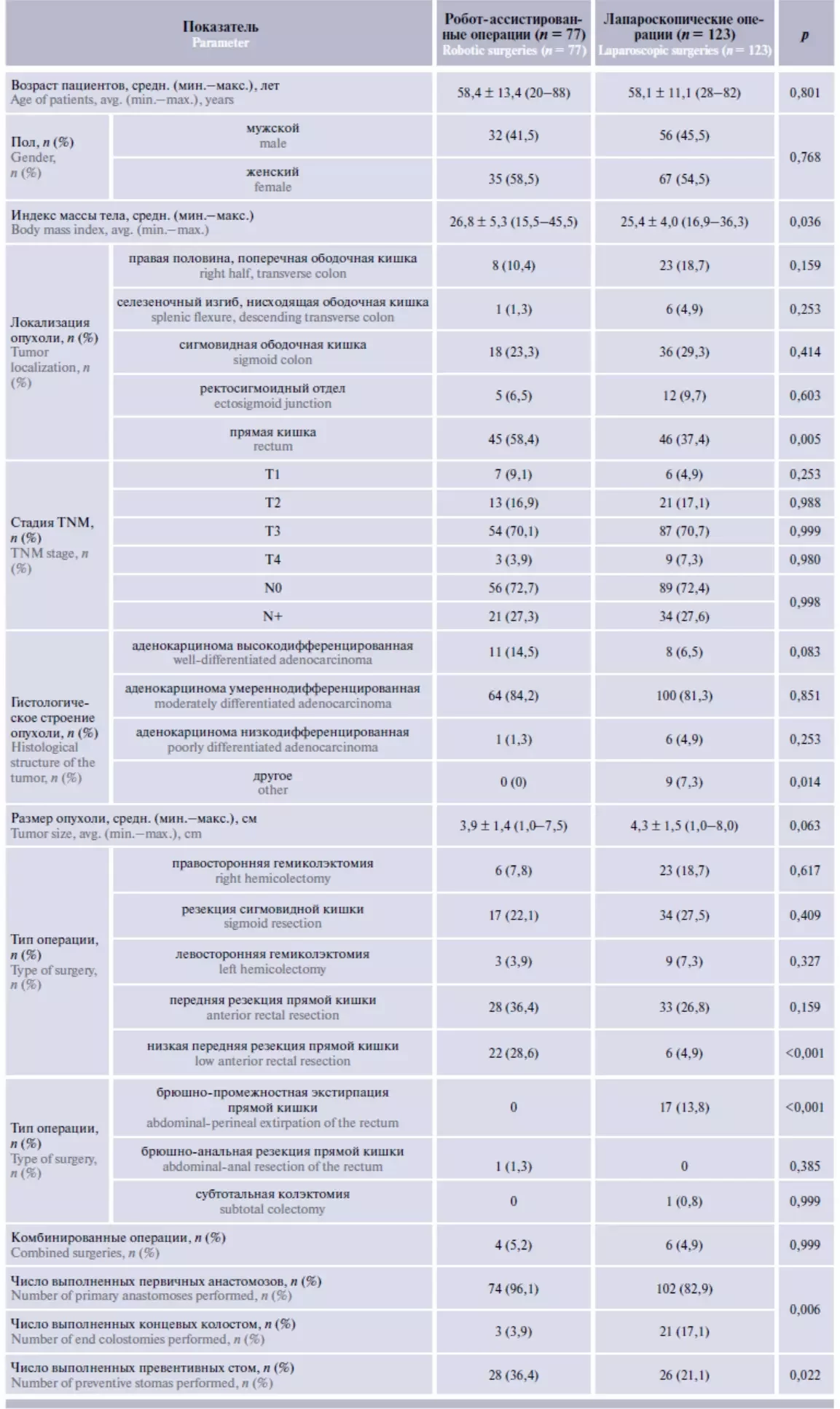
В группе РА операций отмечен более высокий процент низкой передней резекции ПК по сравнению с группой ЛС операций, при этом брюшно-промежностная экстирпация в группе РА операций не выполнялась ни в одном случае. Как следствие, группа РА операций характеризовалась более высоким процентом выполнения первичного колоректального анастомоза (96,1 % по сравнению с 82,9 % в группе ЛС операций, p = 0,006) и, соответственно, меньшей долей операций с созданием концевой колостомы. Превентивная стома (илео- или трансверзостома) была сформирована у 28 (36,4 %) пациентов после РА операций и у 26 (21,1 %) после ЛС операций (p = 0,022), такая разница объясняется более высокой долей выполнения низкой передней резекции в группе РА операций. При анализе субгрупп пациентов, оперированных в объеме передней резекции ПК, различий в частоте выполнения превентивной стомы не отмечено (54,9 и 46,4 % соответственно).
Пик показателя CUSUM для группы РА операций пришелся на 46-й случай (CUSUM 989,1 мин), для группы ЛС операций – на 54-й случай (CUSUM 2086,3 мин), таким образом, 1-я фаза КО для РА операций (46 вмешательств) несколько короче, чем для ЛС (54 вмешательства) (см. рисунок).
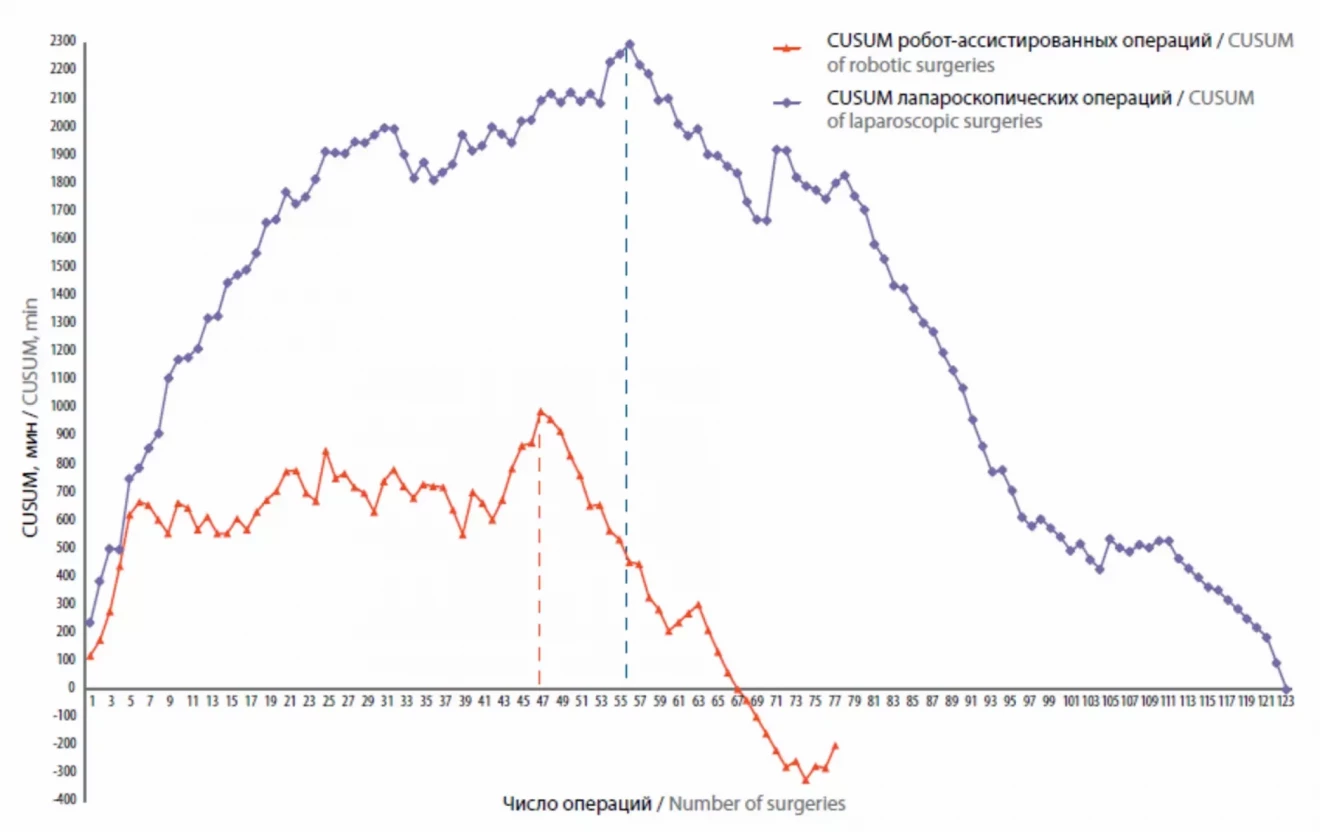 Графики кумулятивной суммы для времени операций. Пунктирными линиями указаны пиковые показатели кумулятивной суммы времени операций
Графики кумулятивной суммы для времени операций. Пунктирными линиями указаны пиковые показатели кумулятивной суммы времени операцийОценка периоперационных параметров в целом по группам (табл. 2) показала, что средняя длительность РА операций больше, чем ЛС операций (237,5 ± 74,9 мин против 213,5 ± 73,1 мин, p = 0,024). Значения интраоперационной кровопотери статистически значимо не различались. Конверсия на лапаротомию произведена у 3 (3,9 %) пациентов в группе РА опера- ций и у 3 (2,9 %) пациентов в группе ЛС. Течение послеоперационного периода в группе РА вмешательств не имело существенных различий с группой ЛС вмешательств.
Таблица 2. Характеристика периоперационных показателей и непосредственных результатов операций в группах робот-ассистированной и лапароскопической хирургии
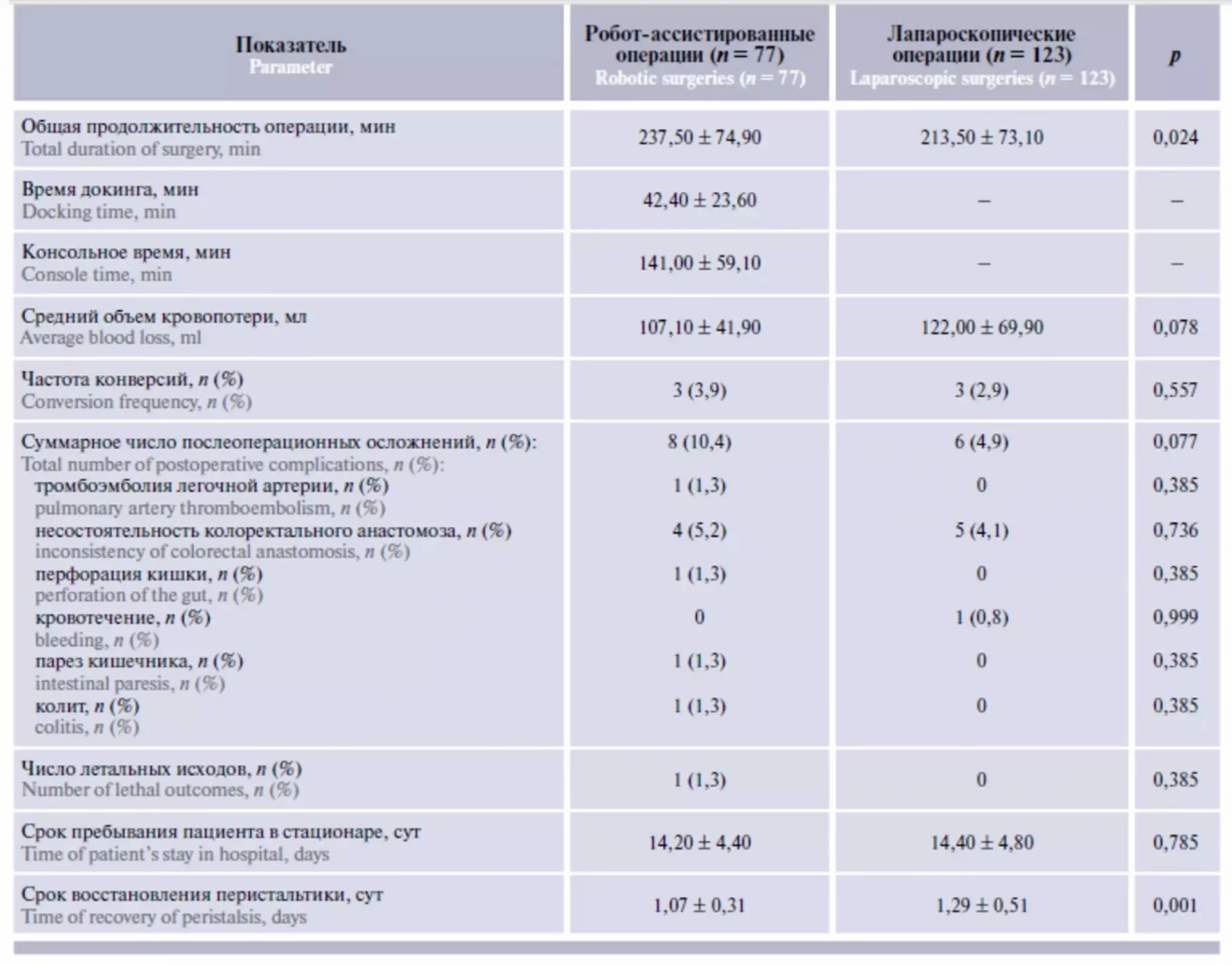
Осложнения в послеоперационном периоде в группе РА операций развились у 8 (10,4 %) пациентов, в группе ЛС – у 6 (4,9 %), частота несостоятельности колоректального анастомоза статистически не различалась между группами. Послеоперационной летальности в группе ЛС операций не наблюдалось, в группе РА операций умер 1 пациент (причина смерти – тромбоэмболия легочной артерии). Срок пребывания пациента в стационаре после РА и ЛС операций не различался. В послеоперационном периоде после РА операций отмечено более быстрое восстановление функции кишечника.
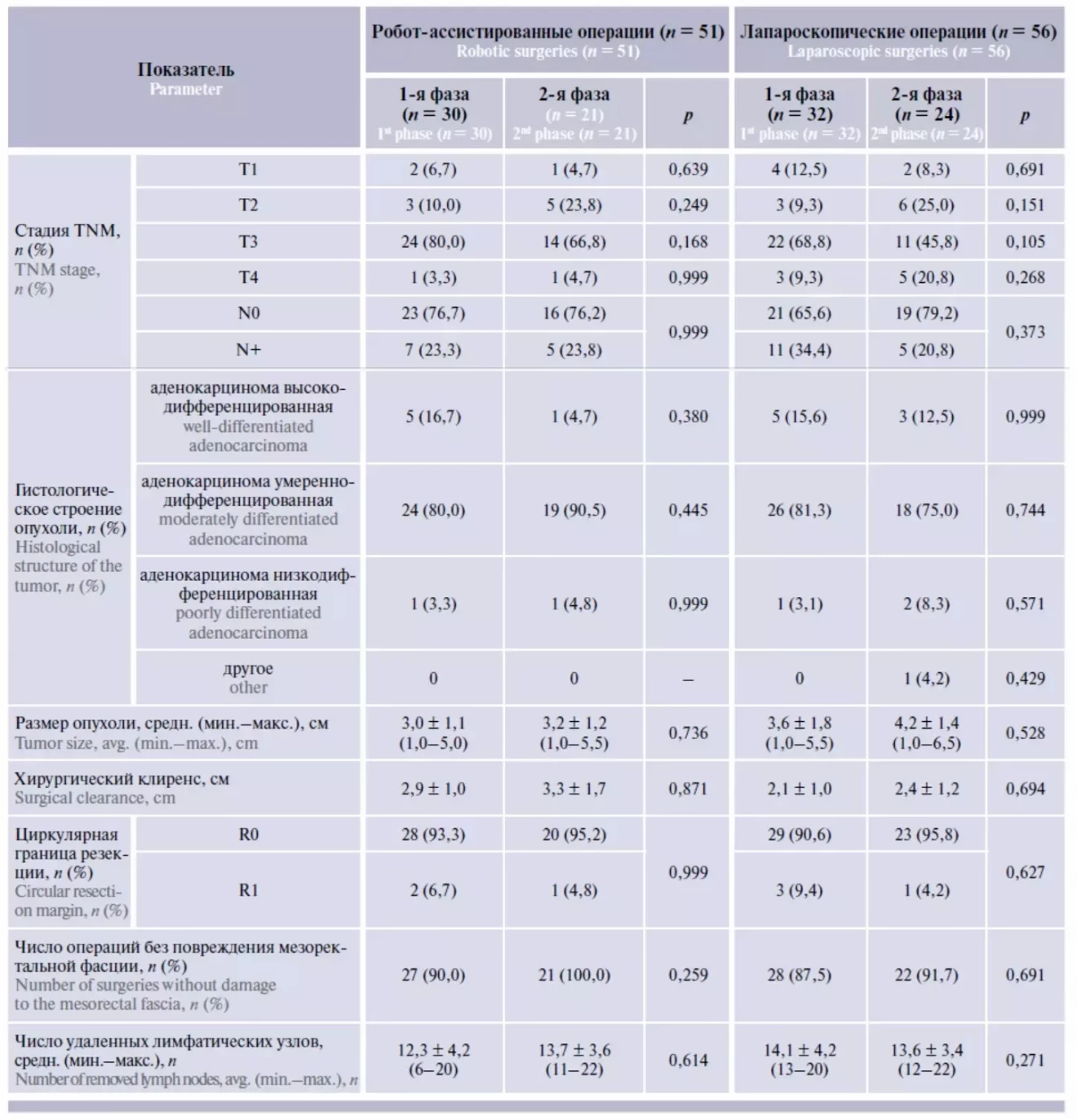
Оценку патоморфологических показателей удаленного препарата провели в подгруппах пациентов, оперированных по поводу аденокарциномы ПК (табл. 3). В обеих подгруппах в большинстве случаев диагностирована аденокарцинома с преобладанием умеренной степени дифференцировки. Размеры опухоли статистически значимо не различались. Опухолевого роста в проксимальном и дистальном краях препарата не обнаружено ни в одном случае. Хирургический клиренс после РА операций составил 3,2 ± 1,1 см, после ЛС операций – 2,3 ± 1,2 см (различие статистически не значимо). Качество мезоректумэктомии после РА операций в 94,1 % случаев оценено как отличное, без повреждения мезоректальной фасции; в 94,1 % случаев микроскопически подтвержден R0 край резекции. В группе ЛС операций показатели качества мезоректумэктомии (92,8 %) и частоты R0-резекции (89,3 %) статистически значимо не различались. Количество исследованных лимфатических узлов не различалось между группами (13,6 ± 3,7 при РА операциях и 13,8 ± 3,8 при ЛС операциях).
Таблица 3. Показатели патоморфологического исследования в подгруппах пациентов, оперированных по поводу рака прямой кишки
Согласно графикам CUSUM (см. рисунок) серии операций были разделены на подгруппы соответственно фазам КО. Для группы РА операций 1-ю фазу КО составили 46 случаев, 2-ю фазу (после прохождения КО) – 31 случай. Для группы ЛС операций в 1-ю фазу включены 54 случая, во 2-ю – 69 случаев, все операции распределены в хронологическом порядке.
Оценены периоперационные параметры и послеоперационный период в зависимости от фазы КО (табл. 4). В группе РА операций в 1-й фазе КО средняя продолжительность вмешательства составила 253,6 ± 80,2 мин, во 2-й фазе – 213,5 ± 59,9 мин (p = 0,020), время докинга и консольное время также были статистически значимо меньше во 2-й фазе КО (47,6 ± 25,2 мин против 34,7 ± 18,8 мин (p =
0,017) и 156,7 ± 62,9 мин против 120,0 ± 45,6 мин (p = 0,007) соответственно). Средняя величина кровопотери статистически не различалась между фазами КО. Конверсия в 2 случаях была зарегистрирована в 1-й фазе КО, в 1 случае – во 2-й фазе КО (p = 0,789). Осложнения развились у 6 (13 %) пациентов, оперированных в 1-й фазе КО и у 2 (6,5 %), оперированных во 2-й фазе КО (p = 0,352), при этом все случаи несостоятельности анастомоза (n = 4 (8,7 %)) развились в 1-й фазе КО. Восстановление перистальтики отмечалось на 1–3-и сутки (1,07 ± 0,3), различия между этими показателями в зависимости от фазы КО не было.
Таблица 4. Характеристика периоперационных показателей и непосредственных результатов операций в зависимости от фазы кривой обучения
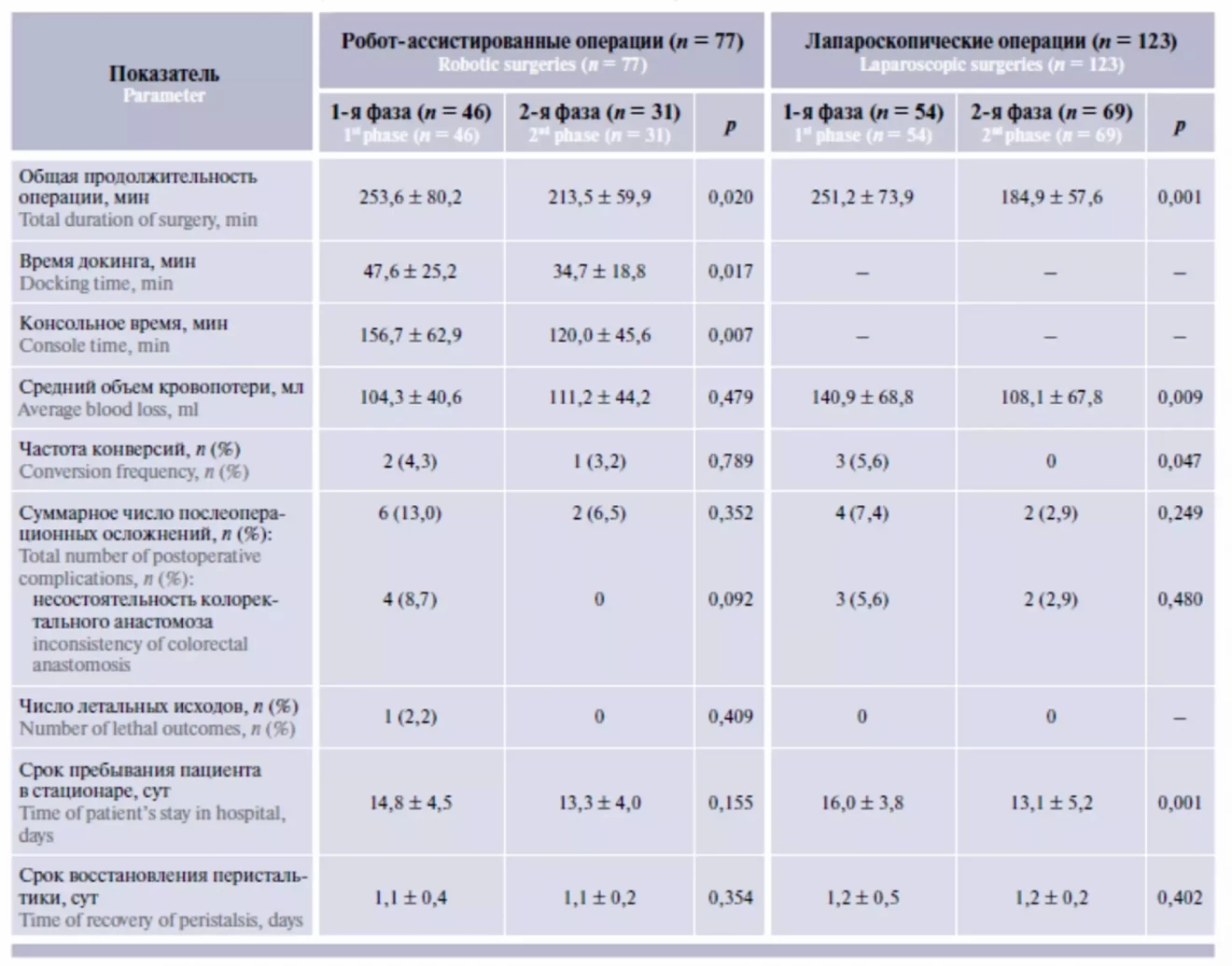
В группе ЛС операций также было отмечено уменьшение времени вмешательства: в 1-й фазе КО оно составило 251,2 ± 73,9 мин, во 2-й фазе – 184,9 ± 57,6 мин (p = 0,001). Отмечено статистически значимое различие в расчетной средней величине кровопотери: 140,9 ± 68,8 мл в 1-й фазе КО против 108,1 ± 67,8 мл во 2-й фазе КО, p = 0,009. Все случаи конверсии в группе ЛС операций отмечались в 1-й фазе КО (p = 0,047). Осложнения развились у 6 (4,9 %) пациентов: в 4 (7,9 %) случаях в 1-й фазе КО и в 2 (2,9 %) случаях во 2-й фазе КО (p = 0,249). Несостоятельность анастомоза развилась в 3 (5,6 %) случаях в 1-й фазе КО и в 2 (2,9 %) случаях во 2-й фазе КО. Восстановление перистальтики отмечалось на 1–3-и сутки (1,1 ± 0,2), различий данного показателя в зависимости от фазы КО не было. Срок пребывания пациента в стационаре снизился с 16,0 ± 3,8 сут в 1-й фазе КО до 12,1 ± 5,2 сут во 2-й фазе КО (p = 0,001).
Статистически значимого различия при анализе патоморфологических показателей в между фазами КО для обеих групп не отмечено (табл. 5).
Таблица 5. Показатели патоморфологического исследования в подгруппах пациентов, оперированных по поводу рака прямой кишки, в зависимости от фазы кривой обучения
Обсуждение
Внедрение радикальных ЛС вмешательств у пациентов с КРР в ГБУЗ «Клинический онкологический диспансер № 1» г. Краснодара началось с 2011 г., а с 2015 г. также появилась возможность выполнения РА вмешательств. РА операции выполнялись бригадой хирургов, имеющих к тому времени опыт ЛС операций при КРР. Безусловным ограничением данного исследования является его нерандомизированный ретроспективный характер. Набор пациентов в группы проводился селективно, с учетом наличия тех или иных противопоказаний к малоинвазивной операции. Анализ выявил, что по локализации опухоли группу РА операций характеризовала более высокая доля пациентов с аденокарциномой ПК, данный факт мы связываем с особенностями отбора больных. Изначально нами было принято, что реализация всех преимуществ роботической системы в большей степени возможна в хирургии рака ПК при выполнении прецизионной нервосберегающей диссекции в узких анатомических пространствах малого таза, что и обусловило отбор пациентов для операций и повлияло на различия групп. Особенности отбора пациентов отразились и на характере выполненных операций: в группе РА отмечен более высокий процент выполнения низкой передней резекции ПК по сравнению с группой ЛС операций, при этом брюшно-промежностная экстирпация выполнялась только лапароскопически. Эти различия повлекли за собой и различия в частоте формирования первичного колоректального анастомоза, концевой колостомы. Частота формирования превентивной стомы (илео- или трансверзостомы) при резекции ПК была одинаковой в обеих группах. В целом при оценке периоперационных параметров в нашем исследовании обе группы малоинвазивных операций оказались сопоставимы по средней величине кровопотери, частоте конверсий, при этом РА операции отличались большей средней продолжительностью. Полученные нами результаты сходны с данными литературы 15–18. В некоторых исследованиях отмечается меньшая кровопотеря при РА операциях по сравнению с ЛС, что относится к одному из преимуществ РА технологии, однако в нашей работе это различие не было статистически значимым. На настоящий момент у нас нет объективных критериев оценки преимуществ диссекции тканей при РА операциях, однако есть субъективное ощущение хирурга о большей «сухости» операционного поля за счет точных движений манипуляторов, трехмерного изображения операционного поля, большого увеличения, прецизионного контроля над кровотечением. Течение послеоперационного периода, частота и характер осложнений, а также патоморфологические показатели после обоих типов малоинвазивных вмешательств в нашем исследовании не имели статистически значимых различий, что в целом соответствует имеющимся данным литературы.
КО, оцененная нами по методу CUSUM, была короче для РА операций (46 случаев), чем для ЛС операций (54 случая). Наши результаты по ЛС операциям в целом соответствуют данным литературы, согласно которым КО в ЛС колоректальной хирургии оценивается в диапазоне от 30 до 70 случаев 19–22. Что касается КО для РА операций, в нашей работе этот показатель оказался относительно выше, чем было продемонстрировано в предыдущих исследованиях, где сообщалось, что КО РА колоректальной хирургии составляет от 15 до 35 случаев 23–25. M.B. Bokhari и соавт. 23 после анализа с помощью CUSUM 50 операций предположили, что КО РА колоректальной хирургии была достигнута в 15–25 случаях с 3 этапами обучения. Согласно R.M. Jimenez-Rodriguez и соавт.25, КО у 43 пациентов с РА ректальной хирургией составила от 21 до 23 случаев. Наши результаты (46 случаев) ближе всего соответствуют данным E.J. Park и соавт. 26, где КО РА хирургии оценена как 44 случая, согласно анализу CUSUM для времени операции. Авторами не получено достоверного различия между КО ЛС и РА операций 26. В целом нам представляется, что КО в РА колоректальной хирургии должна быть практически аналогична КО ЛС хирургии. Тот факт, что этот показатель в нашей работе оказался несколько ниже, мы связываем с тем, что хирурги, выполнявшие РА операции, уже имели опыт ЛС операций. Хотя передовые технологии роботизированной системы могут оказать положительное влияние на сокращение периода обучения, РА операциям свойственны и некоторые недостатки, которые также могут повлиять на КО. В начальный период обучения РА хирургии врач нуждается в большем количестве знаний о роботизированной системе и в более интенсивной практике для манипулирования сложными инструментами по сравнению с обычными ЛС операциями. Отсутствие тактильного ощущения во время вмешательства также может быть препятствием для освоения манипулирования тканями в узкой полости таза в течение начального периода обучения.
При оценке периоперационных параметров в зависимости от фазы КО для РА операций выявлено статистически значимое уменьшение как общей продолжительности операции, так и времени докинга и консольного времени, что является ожидаемым результатом. Средняя величина кровопотери, частота конверсий, частота и характер осложнений, течение послеоперационного периода для РА операций статистически не различались между фазами КО. В группе ЛС операций также отмечено уменьшение продолжительности вмешательства после прохождения 1-й фазы КО, а также статистически значимые уменьшения величин интраоперационной кровопотери и частоты конверсий. Частота и характер осложнений, течение послеоперационного периода для ЛС операций не зависели от фазы КО. Статистически значимых различий при анализе патоморфологических показателей между фазами КО для обоих типов малоинвазивных операций не отмечено. Полученные нами данные в целом соответствуют имеющимся данным литературы 24, 26.
Таким образом, результаты нашего исследования показывают приемлемую и сопоставимую для обоих типов малоинвазивных вмешательств безопасность на этапе обучения и возможность внедрения данных высокотехнологичных хирургических методик в региональном онкологическом учреждении. Отдаленные результаты РА и ЛС операций требуют дальнейшего изучения.
Выводы
При оценке периоперационных параметров и непосредственных результатов РА и ЛС операций обе технологии оказались сопоставимы между собой по большинству показателей. КО для РА операций, по нашим данным, была короче, чем для ЛС. Существенных различий в периоперационных параметрах и послеоперационных результатах между типами операций и между фазами КО не отмечено.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проводилось без спонсорской поддержки.
Контакты: Иван Борисович Уваров uvarovivan@yandex.ru