Непосредственные и отдаленные результаты роботической хирургии рака прямой кишки
Реферат. В последнее время отмечается широкое внедрение в повседневную клиническую практику роботического хирургического комплекса благодаря его преимуществам перед традиционной лапароскопической хирургией.
Цель нашего исследования – провести анализ непосредственных и отдаленных результатов лечения пациентов, подвергшихся хирургическому лечению по поводу рака прямой кишки с использованием роботического хирургического комплекса Da Vinci.
В исследование включены проспективно собранные данные лечения 238 пациентов, страдающих раком прямой кишки, в период с 2010 по 2016 гг.: 24 пациентам выполнена традиционное открытое вмешательство, 101 пациенту выполнены лапароскопически-ассистированные операции и 113 – роботическая резекция прямой кишки.
Сфинктеросохраняющие операции достоверно чаще выполнялись в группе миниинвазивной хирургии (р<0,0001). Кроме того, органосохраняющие операции достоверно чаще выполнялись в роботической группе, чем в лапароскопической. Максимальное сокращение сроков госпитализации достигнуто в группе роботической хирургии – медиана послеоперационного койко-дня составила 7 суток. Это было достоверно меньше по сравнению с группой открытой хирургии (р<0,0001), так и с группой лапароскопической хирургии (р<0,0001). Первое отхождение стула также достоверно быстрее происходило в группах минимально инвазивных операций. Частота проведения резекций в объеме R0 не отличалась в группах лапароскопической и роботической хирургии (р=0,738). Также не было различий по сравнению с группой открытой хирургии (р=0,999). Качество выполнения мезоректумэктомии оценивалось чаще как высокое и удовлетворительное в группе робот-ассистированных вмешательств по сравнению с лапароскопическими, но разница между исследуемыми группами по данному показателю была статистически не значима – ОШ=2,85 (95% ДИ: 0,72-11,27; р=0,2). Тенденция к более низкой частоте рецидивов в группе роботической хирургии не была достоверна по сравнению с группой лапароскопической (р=0,23) хирургии. Тенденция к меньшей частоте метастазирования в группе открытой хирургии не была достоверна ни по отношению к лапароскопической группе (р=0,458), ни к роботической (р=1). Различия между группами минимально инвазивной хирургии также не были достоверны (р=0,165). Различия между группами открытой и малоинвазивной хирургии по выживаемости не были достоверны: между группами открытой и лапароскопической хирургии p=0,944, открытой и роботической р=0,209. Общая выживаемость в группе лапароскопической хирургии была достоверно выше, чем в роботической р=0,043.
Введение
Несмотря на возможности современной медицинской науки, рак прямой кишки (РПК) по-прежнему остается одной из самых актуальных проблем онкологии. Прирост заболеваемости населения Рос- сии раком прямой кишки, ректосигмоидного отдела и анального канала составил 17,9% за десять лет, среднегодовой прирост – 1,63% [1]. В 2014 году в США по данным National Program of Cancer Registries диагностировано 40 тысяч новых случаев заболевания раком прямой кишки [3]. Но, как и прежде, за двухвековую историю изучения РПК, основным методом лечения на сегодняшний день остается хирургический.
Традиционные оперативные вмешательства позволяют добиться хороших непосредственных и отдаленных результатов. Тем не менее, прогрессивное развитие медицинских технологий привело к широкому внедрению в повседневную клиническую практику малоинвазивных лапароскопических и робот-ассистированных методик. Результаты наиболее крупных рандомизированных исследований подтвердили преимущества лапароскопической колэктомии перед традиционной [4-6, 9-12, 15]. И если лапароскопическая хирургия рака ободочной кишки прочно вошла в широкую клиническую практику, целесообразность ее использования при операциях на прямой кишке до сих пор широко обсуждается. Причиной тому большая кривая обучения и техническая сложность подобных вмешательств. Несмотря на преимущества перед традиционными открытыми вмешательствами, лапароскопия имеет и ряд недостатков: двухмерное изображение, ограниченная подвижность инструментов, необходимость длительного обучения, в начале которого наблюдается повышенная частота конверсий.
Уже завершен ряд крупных, в том числе рандомизированных исследований, посвященных сравнению непосредственных результатов открытых и лапароскопических мезоректумэктомий, однако их данные остаются противоречивыми. В исследовании S.S. Ng с соавт., несмотря на отсутствие различий в частоте 30-дневных осложнений, было получено достоверное снижение в частоте поздних осложнений, требующих повторных госпитализаций – с 25,7% до 10,8% (р<0,05) [17]. В другом исследовании S.S. Ng с соавт. было продемонстрировано достоверное снижение частоты осложнений после тотальной мезоректумэктомии (ТМЭ) в варианте миниинвазивных операций [16]. В результатах исследования ACOSOG Z6051 [7] авторы установили, что негативные циркулярный и дистальный края резекции достоверно чаще были достигнуты в группе открытой хирургии (86,9%) по сравнению с лапароскопической (81,7%). При мета-анализе 15 рандомизированных клинических исследований, включающих 4112 пациентов, не было отмечено различий в общей и безрецидивной выживаемости ни в группе всех больных РПК, ни в подгруппе больных, которым была выполнена тотальная мезоректумэктомия. Тем не менее в группе лапароскопической хирургии достоверно чаще отмечалось нарушение целостности мезоректальной фасции, как в общей группе, так и в группе ТМЭ. К тому же, в группе ТМЭ достоверно чаще отмечалось поражение циркулярной границы резекции [21].
Хирургия РПК имеет ряд особенностей, создающих потенциальные предпосылки для преимущества роботической техники. Пространство в малом тазу узкое, некоторые зоны диссекции труднодоступны, что может быть нивелировано при использовании инструментов с высокой степенью свободы. К тому же, стабильная и качественная 3D визуализация является одним из важных условий идентификации и сохранения элементов вегетативной нервной системы.
Преодоление технических трудностей, возникающих при выполнении лапароскопических операций, возможно при использовании роботического хирургического комплекса (РХК) Да Винчи (Da Vinci surgical TM system). Робот-ассистированные операции имеют ряд преимуществ перед традиционной лапароскопической хирургией: компенсация физиологического тремора, стабильное положение камеры, контролируемое самим хирургом, эргономика и высокая степень свободы инструментов [2, 13]. Эргономичное положение хирурга значительно снижает темпы утомляемости и может потенциально снизить риск осложнений [14]. К настоящему времени проведено большое количество различных по дизайну исследований, анализирующих как непосредственные, так и отдаленные результаты применения РХК в хирургии РПК.
В мета-анализе 324 роботических и 268 лапароскопических операций на прямой кишке, проведенном Y. Sun с соавт., отмечено достоверное снижение часто- ты конверсий (ОР=0,08; 95% ДИ=0,02-0.31; р=0,0002), частоты поражения циркулярной границы резекции (ОР=0,5; 95% ДИ=0,25-1,01; р=0,05), а также обще- го числа осложнений (ОШ=0,65; 95% ДИ=0,43-0,99; р=0,04) в группе роботических операций по сравнению с лапароскопией. При этом время операции достоверно не различалось между группами (ОШ=28,4; 95% ДИ=−3,48-60,27; р=0,08) [18]. В мета-анализе отдаленных результатов Wilder F.G. et al. с соавт., включающем данные 317 роботических и 368 лапароскопических операций, не нашли различий ни в 3-летней общей (93,3% и 90,5%, р=0,34), ни в 3-летней безрецидивной выживаемости (86,9% и 84,1% р=0,93), ни в частоте поражения циркулярной границы резекции [19]. Потенциально высокая степень свободы роботических инструментов обеспечивает более прецизионную мобилизацию дистальных отделов мезоректума по сравнению с прямыми лапароскопическими инструментами. T.L. Ghezzi с соавт. при сравнительном анализе отдаленных результатов открытой и роботической ТМЭ отметили достоверное снижение частоты рецидивов в роботической группе (3,4% против 16,1%, р=0,024) [8].
Использование роботической техники имеет больше потенциальных преимуществ для хирургии РПК. Несмотря на это, результаты исследований остаются противоречивыми. В настоящее время РХК активно используется в хирургии РПК в зарубежных странах, но до сих пор не накоплено достаточно опыта, позволяющего судить о возможности включения этого метода в современные стандарты лечения. В нашей стране опыт роботической хирургии РПК ограничивается отдельными наблюдениями либо небольшими сериями клинических наблюдений. Крупных исследований, посвященных роботическим операциям при РПК, в нашей стране не опубликовано.
Цель нашего исследования – провести анализ непосредственных и отдаленных результатов лечения пациентов, подвергшихся хирургическому лечению по поводу РПК с использованием роботического хирургического комплекса Da Vinci.
Материал и методы
Исследование основано на анализе проспективно собранных данных лечения 238 пациентов, которым выполнялись открытые, лапароскопические или роботические операции по поводу рака прямой кишки в период с 2010 по 2016 гг. Пациенты были распределены на три группы. В основную группу включались больные, которым выполнено радикальное хирургическое лечение с выполнением робот-ассистированных операций, включая пациентов, которым предпринималась по- пытка выполнения полностью роботической либо робот-ассистированной операции, конвертированная в лапароскопическую или открытую операции. Также было использовано 2 группы сравнения: в первую группу вошли пациенты, которым выполнялись лапароскопически-ассистированные операции, во вторую группу были включены пациенты, которым были выполнены операции с использованием лапаротомного доступа. Сравнительному анализу подвергались как непосредственные, так и отдаленные результаты про- веденного лечения. Медиана прослеженности для оценки отдаленных результатов лечения в исследуемых группах составила более 2 лет.
Основными анализируемыми параметрами были 30-дневная послеоперационная летальность, число послеоперационных осложнений по классификации Clavien-Dindo (табл. 5) [20], безрецидивная выживаемость. В группах малоинвазивных методов лечения дополнительно проводился сравнительный анализ частоты и причин конверсий, объема интраоперационной кровопотери, продолжительности операции (табл. 4), потребности в наркотических анальгетиках для купирования болевого синдрома в послеоперационном периоде, времени восстановления перистальтики, отхождения первого стула и газов, частоты поражения циркулярной и дистальной границ резекции, общей выживаемости, частоты рецидивов и метастазов. Кроме того оценивалось качество мезоректумэктомии по P. Quirke [22]. Характеристика исследуемых групп представлена в таблице 1.
Таблица 1. Основные характеристики группы больных РПК
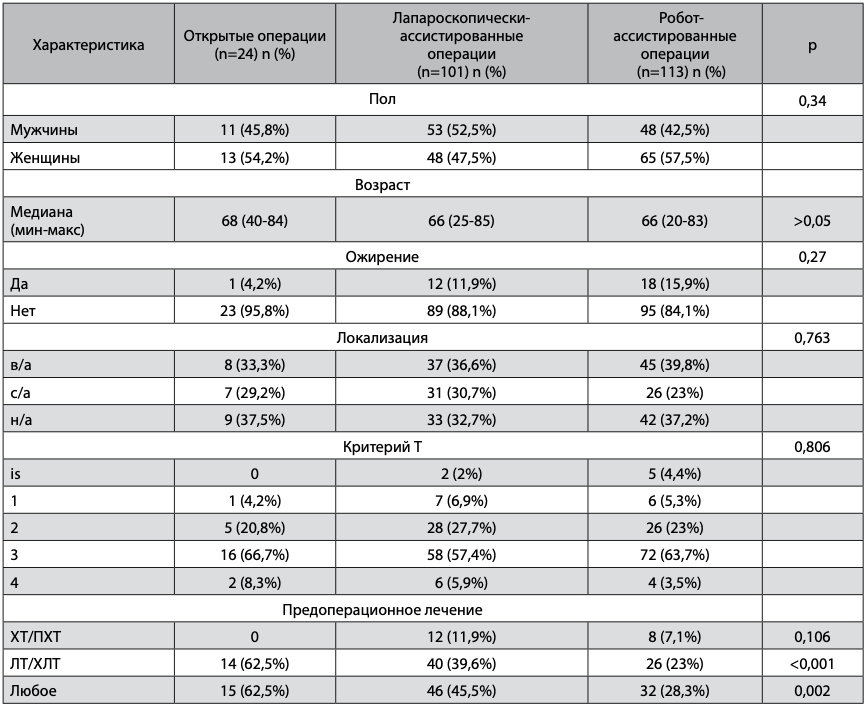
Исследуемые группы были сопоставимы по основным анализируемым параметрам. Большинство пациентов получали пролонгированные курсы предоперационной химиолучевой терапии, при этом в группе открытой хирургии таких больных было достоверно больше как по сравнению с группой лапароскопической (р=0,0066), так и с группой роботической хирургии (р<0,0001). В группе открытой хирургии достоверно чаще выполнялись брюшно-промежностная экстирпация и операция по типу Гартмана (р<0,0001). Были также отличия в частоте формирования превентивных стом. При выполнении передней резекции отмечалась тенденция к более редкому использованию стом в группе роботи- ческойхирургии, недостигшая, однако, статистически достоверных значений. При выполнении низкой передней резекции тенденция была обратной – наиболее часто стомы формировались в группе роботических операций. Различия также не были достоверны.
Ни у одного из больных РПК не было выполнено ручного, в том числе колоанального анастомоза. Доля брюшно-промежностных экстирпаций и обструктивных резекций прямой кишки была достоверно выше среди пациентов, которым выполнялись открытые вмешательства. Комбинированные операции были выполнены 25 (6,7%) пациентам (табл. 3). Группы были сопоставимы по частоте выполнения комбинированных и симультанных операций, а также по ряду других факторов, потенциально усложняющих ход операции – частоте предшествующих операций на брюшной полости и наличию на момент операции кишечной непроходимости. Следует отметить, что кишечная непроходимость была только у пациентов в группе выполнения минимально инвазивных операций. Таким образом, этот фактор не был ограничивающим для использования лапароскопического и роботического доступов.
В группе открытых операций, симультанно выпол- нена правосторонняя гемигепатэктомия (n=1). В группе лапароскопической хирургии комбинированно выполнялись экстирпация матки с придатками (n=2), резекция задней стенки влагалища (n=1), симультанно-атипичная резекция печени (n=1), торакоскопическая атипичная резекция нижней доли левого легкого (n=1), холецистэктомия (n=1). В группе роботической хирургии комбинированно выполнялись резекция левого мочеточника и мочевого пузыря (n=1, у данного пациента была выполнена конверсия и операция завершена через лапаротомный доступ), резекция тонкой кишки (n=1), резекция сигмовидной кишки (n=1).
Таким образом, комбинированные операции по поводу местнораспространенного рака с инвазией соседних органов преимущественно оперировались открыто, хотя в отдельных случаях аналогичные вмешательства удавалось завершить и с использованием минимально инвазивных технологий. Конверсии отмечены только в группе роботической хирургии. Различия с группой лапароскопической хирургии не достигли достоверных значений. Причинами конверсий были местное распространение опухолевого процесса (n=4) и спаечные изменения в брюшной полости (n=1).
Таблица 2. Виды выполненных операций
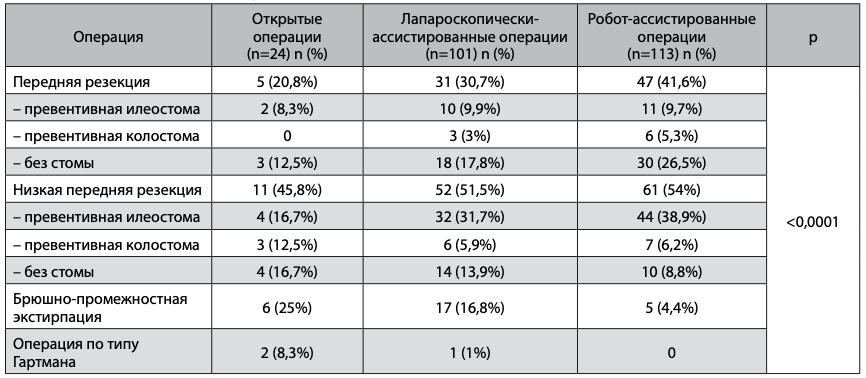
Таблица 3. Характеристики операций
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Робот-ассистированные операции (n=113) n (%) |
p |
| Комбинированные и симультанные операции |
1 (4,2%) |
6 (5,9%) |
3 (2,7%) |
0,489 |
| Операции на брюшной полости в анамнезе |
9 (37,5%) |
19 (18,8%) |
27 (23,9%) |
0,143 |
| Конверсии |
- | 0 | 5 (4,4%) |
0,062 |
| Кишечная непроходимость | 0 | 8 (7,9%) |
4 (3,5%) |
0,732 |
– компенсированная |
0 | 4 (4%) |
1 (0,9%) |
- |
| – субкомпенсированная |
0 | 4 (4%)
|
3 (2,7%) |
- |
| Стентирование просвета кишки до операции |
0 | 0 | 0 | - |
Таблица 4. Интраоперационные параметры
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Робот-ассистированные операции (n=113) n (%) |
| Кровопотеря Медиана (мин-макс) |
200 (50-500) |
100 (30-700) |
100 (20-3800) |
| Продолжительность операции Медиана (мин-макс) |
180 (100-275) |
235 (110-465) |
200 (105-420) |
Таблица 5. Степень послеоперационных осложнений по классификации Clavien – Dindo
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
| 0 |
19 (79,2%) |
89 (88,1%) |
96 (85%) |
| I
|
0 | 1 (1%) |
1 (0,9%)
|
II |
0 | 0 | 1 (0,9%)
|
| IIIА |
2 (8,3%) |
3 (3%)
|
0 |
IIIB |
1 (4,2%) |
7 (6,9%) |
11 (9,7%) |
| IVА |
1 (4,2%)
|
0 | 0 |
IVB |
0 | 0 | 1 (0,9%) |
| V |
1 (4,2%) |
1 (1%) |
3 (2,7%) |
Всего осложнений |
5 (20,8%) |
12 (11,9%) |
17 (15%) |
Использование минимально инвазивных технологий позволяло достоверно снизить интраоперационную кровопотерю. При этом различий между группами лапароскопических и роботических операций не отмечено. Медиана продолжительности операции была закономерно ниже при выполнении открытых операций – на 55 минут по сравнению с лапароскопическими и на 20 минут по сравнению с роботическими. При этом продолжительность роботических операций при использовании разработанного нами метода докинга была достоверно ниже лапароскопических (р=0,021). Проанализированы послеоперационные осложнения в зависимости от использованного хирургического доступа. Общая частота осложнений была невысокой и составляла от 11,9 до 20,8% (табл. 5). Число осложнений 3 степени и выше было мак- симальным в группе открытой хирургии (20,8%). В группе лапароскопической хирургии этот показатель составил 10,9%, роботической – 13,3%. Различия не были достоверны (р=0,677). Тем не менее, послеоперационная летальность была выше в группе роботической хирургии по сравнению с лапароскопической (2,7% и 1% соответственно). Эти различия также не были достоверны (р=0,62).
Несостоятельность швов межкишечного анастомоза развивалась редко. Данное осложнение отсутствовало в группе открытой хирургии, в группе лапароскопической хирургии развилось у 7 (6,9%) пациентов, в группе роботической хирургии – у 6 (5,3%) больных. Различия были статистически недостоверны (р=0,404). Использование минимально инвазивных технологий позволило добиться более быстрой реабилитации пациентов после операции (табл. 6).
Таблица 6. Основные характеристики послеоперационного периода
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Робот-ассистированные операции (n=113) n (%) |
| Сроки госпитализации Медиана (мин-макс) | 11 (6-20) |
8 (4-90) |
7 (1-28) |
| Потребность в наркотических анальгетиках |
21 (87,5%) |
45 (44,6%) |
6 (5,3%) |
| - трамадол |
4 (16,7%) |
5 (5%) |
2 (1,8%) |
| - промедол | 3 (12,5%) |
13(12,9%) |
4 (3,5%) |
- трамадол и промедол |
14 (58,3%) |
27 (26,7%) |
0 |
| Восстановление перистальтики, сутки Медиана (мин-макс) |
1 (1-3) |
1 (1-4) |
1 (1-3) |
| Первое отхождение газов, сутки Медиана (мин-макс) |
2 (1-8) |
2 (1-5) |
1 (1-3) |
| Первое отхождение стула, сутки Медиана (мин-макс) |
4 (1-10) |
2 (1-6) |
2 (1-6) |
Максимальное сокращение сроков госпитализации достигнуто в группе роботической хирургии – медиана послеоперационного койко-дня составила 7 суток. Это было достоверно меньше по сравнению с группой открытой хирургии (р<0,0001), так и с группой лапароскопической хирургии (р<0,0001). Первое отхождение стула также достоверно быстрее происходило в группах минимально инвазивных операций, однако различий у пациентов, которым были выполнены лапароскопические и роботические операции, не отмечено. Проанализированы все ключевые морфологические характеристики удаленных препаратов, включая число удаленных лимфатических узлов, поражение циркулярных границ резекции и качество мезоректумэктомии. Частота проведения резекций в объеме R0 не отличалась в группах лапароскопической и роботической хирургии (р=0,738). Также не было различий по сравнению с группой открытой хирургии (р=0,999). Во время лапароскопических операций удалялось достоверно больше лимфатических узлов по сравнению с открытыми операциями (р=0,001) (табл. 7).
Таблица 7. Морфологические характеристики удаленных препаратов у больных РПК
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Робот-ассистированные операции (n=113) n (%) |
| Количество удаленных лимфатических узлов |
7 (0-16) |
12 (1-43) |
12 (2-22) |
| Количество пораженных лимфатических узлов |
0 (0-11) |
0 (0-26) |
0 (0-10) |
| R0 |
23 (95,8%) |
96 (95%) |
109 (96,5%) |
| R1 |
1 (4,2%) |
5 (5%) |
4 (3,5%) |
Различия по числу удаленных лимфатических узлов между группами роботической и лапароскопической хирургии не были значимы.
Таблица 8. Качество мезоректумэктомии в исследуемых группах
| Характеристика |
Открытые операции (n=24) n (%) |
Лапароскопически- ассистированные операции (n=101) n (%) |
Робот-ассистированные операции (n=113) n (%) |
| Неудовлетворительное |
2 (18,2%) |
8 (12,1%) |
3 (4,6%) |
| Удовлетворительное | 6(54,5%) |
24(36,4%) |
24(36,9%) |
Высокое |
3 (27,3%) |
34 (51,5%) |
38 (58,5%) |
Поражение апикальных лимфатических узлов наблюдалось редко – только у 1 (1%) пациента в группе лапароскопической хирургии и 1 (0,9%) пациента в группе роботической хирурги. Качество мезоректумэктомии было оценено у 142 больных РПК. Результаты оценки качества выполнения мезоректумэктомии представлены в таблице 8. При морфологическом исследовании полученных в ходе операции препаратов было выявлено, что качество выполнения мезоректумэктомии оценивалось чаще как высокое и удовлетворительное в группе робот-ассистированных вмешательств по сравнению с лапароскопическими, но разница между исследуемыми группами по данному показателю была статистически не значима – ОШ=2,85 (95% ДИ: 0,72-11,27; р=0,2).
Отдаленные результаты лечения проанализированы у всех пациентов, у которых отсутствовали отдаленные метастазы на момент операции. Среди больных РПК таких было 20 в группе открытой хирургии, 93 в группе лапароскопической хирургии и 109 в группе роботической хирургии. Медиана наблюдения составила 21,9 месяца (от 7,4 до 79,6 месяцев).
Рецидивы развились у 12 из 222 (5,4%) больных неметастатическим РПК: их не было в группе открытой хирургии, 8 (8,6%) в группе лапароскопической хирургии и 4 (3,7%) в группе роботической хирургии. Различия не были статистически достоверны (р=0,162). Тенденция к более низкой частоте рецидивов в группе роботической хирургии не была достоверна по сравнению с группой лапароскопической (р=0,23) хирургии. Для групп минимально инвазивных и открытых операций ОШ развития рецидивов составило 2,47 (95% ДИ: 0,719-8,458; р=0,23).
Двухлетняя безрецидивная выживаемость в группе открытой хирургии составила 100%, в группе лапароскопической хирургии – 82,5%, в группе роботической хирургии в период освоения методики – 78,8%, в условиях работы опытной бригады – 96,3%. Рецидивы развились у 12 из 222 (5,4%) больных неметастатическим РПК: их не было в группе открытой хирургии, 8 (8,6%) в группе лапароскопической хирургии и 4 (3,7%) в группе роботической хирургии. Различия были статистически не значимы (р=0,162).
Тенденция к более низкой частоте рецидивов в группе роботической хирургии была недостоверна по сравнению с группой лапароскопической (р=0,23) хирургии. Тенденция к меньшей частоте метастазирования в группе открытой хирургии была не значима ни по отношению к лапароскопической группе (р=0,458), ни к роботической (р=1). Различия между группами минимально инвазивной хирургии также были недостоверны (р=0,165).
Обсуждение
Основной сравнительный анализ в нашей работе проводился между группами лапароскопической и роботической хирургии. Это обусловлено как небольшим количеством пациентов, которым операции выполнялись открытым доступом, так и приоритетом изучения эндовидеохирургических технологий в рамках проведенного исследования.
К преимуществам работы можно отнести сопоставимость исследуемых групп по всем основным параметрам: возрасту, полу, наличию ожирения, локализации опухоли и стадии заболевания, наличию в анамнезе операций на брюшной полости. В то же время в группе робот-ассистированной хирургии достоверно реже проводилось предоперационное лечение, в том числе лучевая и химиолучевая терапия. Это может создавать более благоприятные условия во время операции, но также – являться предпосылкой для более низких онкологических результатов лечения.
Несмотря на то, что распределение исследуемых групп по степени распространенности опухолевого процесса было одинаковым, конверсии отмечались только в группе роботической хирургии. При этом у 3 из 4 пациентов, которым потребовался переход к абдоминальному доступу, причиной было именно наличие местнораспространенного РПК. Очевидно, у таких пациентов требуется более широкая мобилизация окружающих тканей. Роботический комплекс имеет преимущество большой степени свободы инструментов, однако, в связи с особенностями докинга, их применение ограничено относительно узким анатомическим пространством. Проведение нестандартных хирургических вмешательств может становиться технически сложным. Ряд интраоперационных ситуаций, при которых во время использования лапароскопического доступа технические сложности можно решить путем установки дополнительных портов, при применении роботического комплекса требуют или значительного изменения докинга (что связано с временными затратами, часто недопустимыми на определенных этапах операции), либо конверсии, что и производилось в рамках этой работы. Таким образом, использование роботического комплекса связано с потенциально большими техническими сложностями при проведении хирургических вмешательств по поводу местнораспространенного РПК по сравнению с лапароскопической техникой.
Несмотря на это, общая продолжительность роботических операций была достоверно меньше, чем лапароскопических (р=0,021). Разница в продолжительности была значительной – 35 минут. Эти наблюдения можно объяснить тем, что проведение стандартных хирургических вмешательств технически удобнее при использовании роботического комплекса за счет большей степени свободы инструментов. Однако нестандартные операции по поводу местнораспространенного рака, выходящего за пределы характерной для заболевания анатомической области, напротив, могут вызывать большие технические сложности и даже требовать конверсии в открытый доступ. Это дополнительно подтверждается тем, что при анализе подгрупп пациентов с ожирением и наличием РПК стадии Т4 преимущество в продолжительности операций отмечалось только у больных без данных негативных факторов. Отмеченные различия в ходе операции не отразились на риске послеоперационных осложнений: он был сопоставимым в группах лапароскопической и роботической хирургии.
Локализация опухоли в прямой кишке, но не вид хирургического доступа, была единственным достоверным фактором риска послеоперационных осложнений: ОШ 2,862 (95% ДИ: 1,069-7,665, р=0,036). Наиболее часто серьезные осложнения развивались у больных с/а РПК – у 20,4% по сравнению с 10% в группе в/а РПК и 10,8% в группе н/а РПК. При этом риск осложнений был наиболее высоким в группе лапароскопической хирургии – среди больных с/а РПК серьезные осложнения развились у 25,8%. В группе роботической хирургии подобные осложнения развились только у 15,4% пациентов. Использование роботической хирургии позволило достоверно снизить медиану продолжительности госпитализации на 1 сутки (р<0,0001), а также значительно снизить потребность пациентов в наркотических анальгетиках (5,3% против 44,6% в группе лапароскопической хирургии, р<0,0001).
Частота достижения свободной циркулярной границы резекции не отличалась в исследуемых группах, однако наиболее высокие показатели были в группе роботической хирургии. Также в этой группе была тенденция к более частому достижению высокого качества мезоректумэктомии. Удовлетворительное или высокое качество мезоректумэктомии также достигнуто у всех пациентов с ожирением, которым выполнялись эндовидеохирургические вмешательства.
Отдаленные результаты лечения в нашем исследовании не зависели от хирургического доступа, что в очередной раз подтверждает безопасность использования эндовидеохирургических технологий у больных РПК. Несмотря на более редкое использование предоперационного лечения в группе роботической хирургии, различий в частоте рецидивов по сравнению с группой лапароскопической хирургии не отмечено.
Одним из важных вопросов для каждой новой технологии является ее безопасность в период освоения. Согласно полученным нами данным, при выполнении первых операций с использованием РХК отмечалась большая кровопотеря и продолжительность вмешательств. Однако абсолютные показатели кровопотери ни в одной группе не достигали клинически значимых значений, а продолжительность операций не привела к статистически достоверному увеличению числа осложнений. Отмеченные тенденции к повышению качества мезоректумэктомии, частоты достижения R0 резекций и снижению числа осложнений в группе роботических операций, выполненных опытной хирургической бригадой – как по сравнению с операциями, выполненными на этапе освоения методики, так и по сравнению с группой лапароскопической хирургии, говорят о потенциальном преимуществе нового метода. Отсутствие достоверных различий можно объяснить тем, что преимущества РХК актуальны не для всех пациентов.
Выводы
Таким образом, на основании нашего опыта, мы можем говорить только о тенденции к улучшению качества хирургических вмешательств, что создает предпосылки для улучшения отдаленных результатов лечения, и снижению числа осложнений. Уточнение статистических характеристик факторов, влияющих на результат, будет возможен при накоплении большего клинического опыта в условиях многоцентрового исследования.