Сравнительная оценка непосредственных результатов робот-ассистированных и лапароскопических операций при колоректальном раке
Радикальная хирургическая операция остается краеугольным камнем лечения пациентов с колоректальным раком (КРР). Современный этап развитияхирургии КРР характеризуется широким внедрением малоинвазивных хирургических технологий. Проведенные в последнее десятилетие сравнительные рандомизированные многоцентровые исследования по оценке клинической результативности лапароскопической (ЛС) хирургии КРР (исследования COST, COLOR, CLASSICC, COLOR-II) показали, что ЛС-операции приводят к аналогичным показателям безопасности, краям резекции и полноте резекции, что и открытые 1–5. При этом кровопотеря и необходимость в гемотрансфузии при ЛС-операциях меньше, частота ранних осложнений (особенно нагноения ран) ниже, а также имеется тенденция к сокращению числа поздних осложнений, особенно послеоперационных грыж и тонкокишечной непроходимости 6. Среди преимуществ малоинвазивных технологий отмечается также быстрое восстановление функции кишечника, ранняя активизация, уменьшение срока пребывания пациента в стационаре, меньший болевой синдром, меньшая потребность в обезболивающих препаратах, более высокое качество жизни, чем при аналогичных «открытых» операциях. По опубликованным в 2015 г. данным исследования COLOR-II с оценкой 3-летних отдаленных результатов, показатели местного рецидивирования, безрецидивной и общей выживаемости в группе ЛС-операций не отличались от аналогичных показателей при открытых операциях 7. Одним из перспективных направлений развития малоинвазивной хирургии стало внедрение в практику робот-ассистированных (Р-А) операций с использованием хирургического комплекса Da Vinci (Intuitive Surgical). Преимущества этой системы включают: трехмерное стабильное изображение операционного поля с возможностью большого увеличения, возможность работы тремя манипуляторами – «руками», оснащенными инструментами с семью степенями свободы, отсутствие тремора, возможность масштабирования амплитуды движений, эргономичное положение хирурга за консолью. Со времени первой публикации, посвященной использованию роботизированных операций в колоректальной хирургии 8, доказаны приемлемость и безопасность Р-А-операций при КРР 9–12. По мнению ряда авторов, в наибольшей степени преимущества роботизированной системы реализуются в хирургии рака прямой кишки, при работе в узких пространствах малого таза. В связи с тем что в отечественной литературе практически отсутствуют исследования, посвященные использованию роботизированной системы Da Vinci в хирургии КРР, целью нашего исследования явились: анализ первого опыта выполнения Р-А-операций у пациентов с КРР, сравнительная оценка периоперационных параметров и непосредственных результатов Р-А- и ЛС-вмешательств при колоректальном раке.
Материал и методы
Исследование носит ретроспективный, нерандомизированный характер. В основу работы положен анализ хирургического лечения 101 пациента с КРР, которым выполнены Р-А- (30 пациентов) и ЛС- (71 пациент) вмешательства. Р-А-операции выполнены в период с января по август 2015 г. в «Клиническом онкологическом диспансере» Краснодара одной бригадой хирургов, обладающей опытом ЛС-хирургии в онкологии. ЛС-операции выполнены в том же учреждении в период 2010–2015 гг. При формировании групп для анализа учтен тот факт, что Р-А-операции выполнялись при локализации опухолевого процесса в прямой кишке и левой половине ободочной кишки. В связи с этим из группы ЛС-операций исключены пациенты с опухолями правой половины ободочной кишки (ЛС- правосторонняя гемиколэктомия) – 10 человек, а также 2 пациента, которым выполнены паллиативные ЛС-операции при наличии отдаленных метастазов. В итоге в группу ЛС-операций для сравнительного анализа включено 59 пациентов. Группы не имели статистически значимых различий по возрастному, половому составу, частоте сопутствующей патологии. Показанием к операции во всех случаях была морфологически верифицированная аденокарцинома ободочной и прямой кишки. Подробная характеристика пациентов приведена в табл. 1.
Таблица 1. Характеристика оперированных пациентов
| Характеристика | 1-я группа (Р-А-операции) (n = 30) | 2-я группа (ЛС-операции) (n = 59) | p |
| Возраст, годы, средний (мин.–макс.) | 62,4 (25–88) | 55,4 (28–75) | 0,270 |
| Пол, n (%): | |||
| мужской | 11 (36,7) | 34 (46,5) | 0,061 |
| женский | 19 (63,3) | 25 (53,5) | |
| ИМТ, средний (мин.–макс.) | 27,5 (20,5–45,5) | 25,0 (17,9–35,7) | 0,015 |
| Сопутствующая патология, n (%) | 23 (76,6) | 36 (61,0) | 0,139 |
| Локализация опухоли, n (%): | |||
| селезеночный изгиб | 0 (0) | 2 (3,4) | |
| сигмовидная кишка | 8 (26,7) | 19 (32,2) | |
| ректосигмоидный отдел | 5 (16,7) | 9 (15,3) | |
| прямая кишка: | 17 (56,6) | 29 (49,1) | |
| верхнеампулярный отдел | 11 | 12 | |
| среднеампулярный отдел | 2 | 7 | |
| нижнеампулярный отдел | 4 | 10 | |
| Стадия TNM, n (%): | |||
| T1 | 3 (10,0) | 5 (8,5) | |
| T2 | 5 (16,7) | 12 (20,3) | |
| T3 | 22 (73,3) | 40 (67,8) | |
| T4 | 0 (0) | 2 (3,4) | |
| N0 | 23 (76,7) | 41 (69,5) | |
| N+ | 7 (23,3) | 18 (30,5) |
Первичные критерии оценки включали: длительность операции, кровопотерю, длительность пребывания в стационаре, осложнения, частоту конверсий. Для оценки онкологической адекватности использовали критерии, полученные при патогистологическом исследовании препарата: циркулярную границу резекции, дистальный клиренс, количество удаленных лимфатических узлов. Статистическая обработка проведена с использованием программного пакета для статистического анализа Statistica 6.0. (компания StatSoft). Применялись методы описательной статистики с вычислением средних значений, стандартного отклонения и стандартной ошибки среднего. При сравнении групп по количественным признакам учитывался t-критерий Стьюдента для независимых групп. Сравнение групп по качественным бинарным признакам проводилось с использованием критерия χ2. Уровень статистической значимости считался достоверным при p < 0,05.
Оперативная техника. Техника выполнения ЛС-операций при КРР достаточно детально описана в статьях и руководствах, в связи с чем считаем целесообразным описать некоторые особенности выполнения только Р-А-вмешательств. Операции выполняли на роботической хирургической системе da Vinci Si (Intuitive Surgical, Inc., Sunnyvale, CA, США). Пациента укладывали на столе в положение Тренделенбурга с поворотом в правую сторону (15o), ноги разведены и слегка согнуты в коленях; для дополнительной фиксации устанавливали подпорки над плечами. В нашей работе использовали следующую схему расстановки портов (см. рисунок, а) при операциях на сигмовидной и прямой кишке (singledocking).
- Порт камеры робота, 12 мм, располагали на 3–4 см вправо и на 3–4 см выше пупка; при этом расстояние до симфиза должно быть 22–24 см.
- Роботический инструментальный порт (R1), 8 мм справа на пересечении линии, соединяющей пупок с передней верхней остью подвздошной кости (SUL), и среднеключичной линии (MCL); расстояние до симфиза 14–16 см.
- Роботический инструментальный порт (R2), 8 мм слева на пересечении линии, соединяющей пупок с передней верхней остью подвздошной кости (SUL), и среднеключичной линии (MCL). Расстояние до симфиза 14–16 см.
- Роботический инструментальный порт (R3), 8 мм слева на 3 см ниже мечевидного отростка и на 2 см медиальнее правой среднеключичной линии (MCL). Минимальное расстояние между портами и камерой 8 см.
- Роботическийинструментальныйпорт (R2–3), 8мм на 7–8 см ниже реберной дуги и слегка медиальнее левой среднеключичной линии (MCL).
Ассистентский порт, 5 мм – располагали на 8–10 см выше R1 и на 4 см латеральнее правой среднеключичной линии (MCL); использовали для аспирации/ирригации, лигирования и ретракции.
Расположение портов при ЛС-операциях (на сигмовидной и прямой кишке) представлен на рисунке, б.
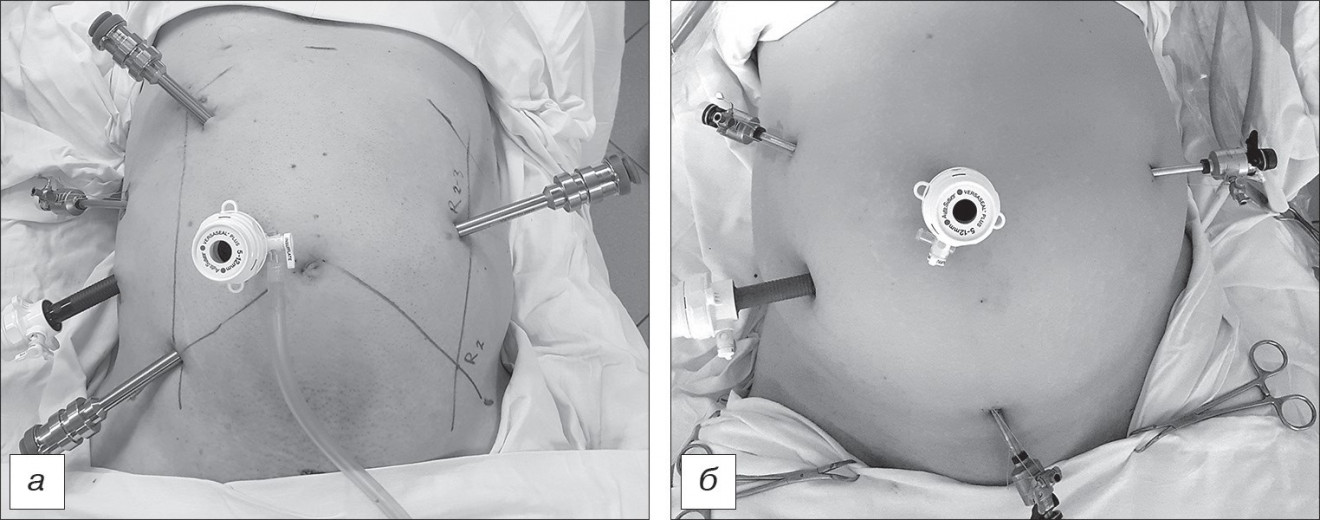 Расположение портов при Р-А (а) и лапароскопической ЛС (б) операциях.
Расположение портов при Р-А (а) и лапароскопической ЛС (б) операциях.Этапы операции роботизированной передней резекции прямой кишки практически идентичны соответствующим этапам ЛС-операции.
- Начальная экспозиция. После наложения пневмоперитонеума проводили ревизию брюшной полости. Большой сальник перемещали вверх, освобождая поперечную ободочную кишку (сальник укладывали между поперечной ободочной кишкой и печенью); петли тонкого кишечника перемещали в правый верхний квадрант брюшной полости, визуализируя v. mesenterica inferior.
- Выделение магистральных сосудов. Медиальную мобилизацию брыжейки сигмовидной кишки начинали с рассечения брюшины ниже a. rectalis superior на уровне общих подвздошных сосудов. Вдоль этого слоя выделяли a. mesenterica inferior, клипировали и пересекали на расстоянии приблизительно 1 см от ее устья. При этом особое внимание уделяли сохранности ветвей гипогастрального нервного сплетения. По медиальной поверхности левой половины ободочной кишки рассекали брюшину, брыжейку сигмовидной и нисходящей кишки до v. mesenterica inferior, которую пересекали у нижнего края поджелудочной железы, примерно на 3–4 см дистальнее устья.
- Медиальная и латеральная мобилизация сигмовидной и нисходящей кишки. В бессосудистом слое производили медиальное и латеральное выделение брыжейки нисходящей и сигмовидной кишки в латеральном и проксимальном направлении между mesocolon и фасцией Герота; выделение производили в бессосудистом эмбриональном клетчаточном слое.
- Мобилизация селезеночного изгиба не является обязательной, однако, если есть риск натяжения ободочной кишки при формировании колоректального анастомоза, это необходимо сделать. В нашей серии роботизированных операций селезеночный изгиб мобилизовался рутинно во всех случаях.
- Выделение и мобилизация прямой кишки. Выполняли тотальную или частичную мезоректумэктомию в зависимости от локализации опухоли. Прямую кишку пересекали линейным степлером на 2,5–3 см дистальнее нижнего края опухоли.
- Удаление препарата и формирование колоректального анастомоза. Через мини-лапаротомный разрез в области пупка препарат извлекали из брюшной полости. Вдоль краевого сосуда иссекали мезосигму, кишку пересекали линейным степлером на 15 см проксимальнее опухоли. Циркулярным степлером формировали интракорпоральный кишечный анастомоз. Производили визуальный осмотр анастомоза и пневматическую пробу.
Результаты
Р-А-операции выполнены 30 пациентам (1-я группа) с КРР, группу сравнения составили 59 пациентов, оперированные лапароскопически по поводу КРР с локализацией опухоли в левой половине ободочной кишки и прямой кишке (2-я группа). Средний возраст пациентов 1-й группы составил 62,4 года, статистически значимых различий по возрастному, половому составу, сопутствующей патологии между группами не отмечалось (табл. 1). Индекс массы тела (ИМТ) в 1-й группе колебался от 20,5 до 45,5 (среднее значение 27,5±5,6), в то время как в ЛС-группе максимальный показатель не превысил 35,7 (разница статистически значима; p = 0,015).
Характер выполненных Р-А- и ЛС-операций в анализируемых группах представлен в табл. 2.
Таблица 2. Характеристика выполненных операций и периоперационные параметры
| Показатель | 1-я группа (Р-А-операции) (n = 30) | 2-я группа (ЛС-операции) (n = 59) | p |
| Характер операции, n (%): | |||
| сигмоидэктомия, резекция сигмовидной кишки | 8 (26,7) | 18 (30,5) | 0,706 |
| левосторонняя гемиколэктомия | 0 (0) | 3 (5,1) | |
| передняя резекция прямой кишки (ПРПК) | 16 (53,3) | 23 (39,0) | |
| низкая передняя резекция ПК (НПРПК) | 6 (20,0) | 6 (10,2) | |
| брюшно-промежностная экстирпация (БПЭ) | 0 (0) | 9 (15,2) | |
| Комбинированные операции, n (%) | 1 (3,3) | 2 (3,4) | 0,989 |
| Первичный анастомоз, n (%) | 28 (93,3) | 45 (76,3) | 0,048 |
| Концевая колостома, n (%) | 2 (6,7) | ||
| Превентивная стома, n (%) | 10 (33,3) | ||
| Длительность операции, мин | 260,9 ± 80,1 (140,0–420,0) | 243,3 ± 72,9 (120,0–465,0) | 0,314 |
| Кровопотеря, мл | 100,0 ± 29,9 | 141,7 ± 76,0 | 0,006 |
| Конверсия, n (%) | 1 (3,3) | 2 (3,4) | 0,989 |
У 28 (93,3%) пациентов 1-й группы операцию завершили формированием первичного колоректального анастомоза циркулярным сшивающим аппаратом; 2 пациентам выполнили обструктивную резекцию с концевой стомой. Превентивная стома сформирована 10 пациентам из 28 с первичным анастомозом (трансверзостома – 5; илеостома – 5).
В группе ЛС-операций, также как и в 1-й группе, преобладали резекция сигмовидной кишки (18) и ПРПК (в том числе НПРПК) – 29 операций. Кроме того, спектр ЛС-операций включал также БПЭ (9) и левостороннюю гемиколэктомию (3). Частота первичного анастомоза и соответственно концевой колостомы различалась между группами за счет более высокого количества концевых стом при БПЭ в группе ЛС-операций (6,7 и 23,7% соответственно; p = 0,048). Превентивную колостому формировали при НПРПК с одинаковой частотой в обеих группах. Длительность Р-А-операций составила от 140 до 420 мин (в среднем 260,9 ± 78,8 мин), статистически значимо не отличаясь от длительности ЛС- вмешательств (120–465 мин; в среднем – 243,3 ± 72,9 мин; p = 0,314). Интраоперационная кровопотеря в Р-А-группе составила в среднем 100 ± 29,4 (50–150) мл в сравнении с 141,7 ± 76 мл в ЛС-группе (разница статистически значима; p = 0,006). Конверсия на лапаротомию при Р-А-вмешательствах произведена у 1 пациента (1/30; 3,3%) в связи со спаечным процессом в брюшной полости и полости малого таза в результате предшествующего хирургического вмешательства. В ЛС- группе конверсия на лапаротомию была в двух случаях (3,4%; p = 0,989).
Течение послеоперационного периода в 1-й группе не имело существенных различий с группой ЛС- вмешательств (табл. 3).
Таблица 3. Характеристика послеоперационного периода и непосредственных результатов операций
| Показатель | 1-я группа (Р-А-операции) (n = 30) | 2-я группа (ЛС-операции) (n = 59) | p |
| Послеоперационные осложнения, n (%): | 1 (3,3) | 2 (3,4) | 0,989 |
| тромбоэмболия легочной артерии (ТЭЛА) | 1 | 0 | |
| несостоятельность колоректального анастомоза | 0 | 1 | |
| некроз ободочной кишки | 0 | 1 | |
| Летальные исходы, n (%) | 1 (3,3) | 0 (0) | 0,159 |
| Послеоперационное нахождение в стационаре, сут | 14,5 ± 4,6 | 16,1 ± 3,7 | 0,082 |
| Восстановление перистальтики, сут | 1,1 ± 0,31 | 1,1 ± 0,41 | 0,660 |
| Стул, функционирование стомы, сут | 2,1 ± 0,41 | 2,0 ± 0,29 | 0,302 |
Осложнения в группе Р-А-операций развились у 1 пациента (1/30; 3,3%) – ТЭЛА с летальным исходом. Летальность соответственно – 1 (1/30; 3,3%). Фатальная ТЭЛА развилась у пациента 88 лет на фоне сопутствующей патологии ишемической болезни сердца, пароксизмальной формы фибрилляции предсердий, экстрасистолии, гипертонической болезни. Необходимо отметить, что осложнений, связанных с анастомозом после Р-А-операций, не было. В группе ЛС-операций отмечены 2 осложнения (3,4%, p = 0,989). В одном случае имела место несостоятельность колоректального анастомоза у больного 61 года после ЛС-НПРПК. Во втором случае у мужчины 67 лет в послеоперационном периоде после ПРПК выявлен некроз анастомозированной нисходящей ободочной кишки вследствие неадекватного кровоснабжения. В обоих случаях потребовалась лапаротомия. Послеоперационной летальности в ЛС-группе не было. Длительность послеоперационного нахождения пациентов в стационаре после Р-А-операций составила от 10 до 21 дня (в среднем 13,9 дня). В послеоперационном периоде восстановление перистальтики отмечалось в 1–3-и сутки (1,1 ± 0,19 сут). Начало функционирования стомы или первый стул – на 2–4-е сутки послеоперационного периода (среднее значение 2,2 ± 0,28 сут). Эти показатели не имели статистически значимых различий с соответствующими показателями для группы ЛС-операций.
Оценку патоморфологических показателей удаленного препарата провели в подгруппах пациентов, оперированных по поводу рака прямой кишки (РПК) – 1a (n = 22) – Р-А-операции при РПК; 2а (n = 40) – ЛС-операции при РПК (табл. 4).
Таблица 4. Показатели патоморфологического исследования удаленного препарата у пациентов с РПК
| Показатель | 1-я группа (Р-А-операции) (n = 30) | 2-я группа (ЛС-операции) (n = 59) | p |
| Гистологическое строение опухоли | |||
| Аденокарцинома: | |||
| высокодифференцированная | 4 | 7 | 0,316 |
| умереннодифференцированная | 14 | 26 | |
| низкодифференцированная | 1 | 4 | |
| Другое | 0 | 3 | |
| Размер опухоли, средний, (мин.–макс.), см | 4,2 ± 2,7 (1,0–8,0) | 3,58 (1,5–7,0) | 0,632 |
| Хирургический клиренс, см | 3,6 ± 1,5 | 2,3 ± 1,2 | 0,086 |
| Циркулярная граница резекции | |||
| R0 | 22 | 36 | 0,125 |
| R1 | 0 | 4 | |
| R2 | 0 | 0 | |
| Целостность мезоректальной фасции | 21 | 36 | 0,450 |
| Количество удаленных лимфатических узлов | 12,3 ± 3,1 | 13,8 ± 3,8 | 0,099 |
При патоморфологическом исследовании удаленных препаратов в обеих подгруппа в большинстве случаев диагностирована аденокарцинома с преобладанием умеренной степени дифференцировки. Размер опухоли в подгруппе Р-А-операций составил от 1 до 8 см (среднее значение 4,2 ± 2,7 см), статистически значимых различий с подгруппой ЛС не выявлено.
Опухолевый рост в проксимальном и дистальном краях препарата не обнаружен ни в одном случае. Хирургический клиренс (расстояние от дистального края опухоли до дистальной линии резекции) в подгруппе 1a составил 3,6 ± 1,5 см, в 2а – 2,3 ± 1,2 см. Качество мезоректумэктомии в подгруппе 1a при ПРПК и НПРПК (суммарно n = 22) в 21 (95,5%) случае оценено как отличное, без повреждения мезоректальной фасции, в 1 препарате отмечены небольшие дефекты фасции. Исследование циркулярной границы резекции в подгруппе 1a подтвердило радикальность операции во всех случаях (R0-резекция в 100% случаев). В каждом удаленном препарате исследовалось в среднем 12,3 ± 3,1 лимфатического узла (12–22). Метастазы в лимфатические узлы выявлены у 5 пациентов. Поражения апикального лимфатического узла не отмечалось ни в одном случае. Патоморфологические показатели качества мезоректумэктомии и лимфодиссекции в группе Р-А-операций не имели статистических отличий от аналогичных показателей в группе ЛС-операций.
Обсуждение
Наш опыт Р-А-операций при КРР включает на сегодняшний день 30 операций у пациентов с опухолями ободочной и прямой кишки, внедрение этих вмешательств начато с февраля 2015 г. В данном исследовании проведена ретроспективная сравнительная оценка Р-А- и ЛС-операций. Рассматривая группы пациентов, следует отметить, что для Р-А-операций проводился отбор по локализации опухоли: во всех случаях это были пациенты со злокачественными новообразованиями (аденокарциномой) прямой кишки, ректосигмоидного перехода и сигмовидной кишки. Именно эти локализации были взяты нами для начального освоения радикальных Р-А-операций при КРР. Спектр ЛС-операций был шире и включал правостороннюю и левостороннюю гемиколэктомии, а также ЛС-ассистированную БПЭ прямой кишки. В связи с этим для корректного сравнения из группы ЛС-операций исключены пациенты с опухолями правой половины ободочной кишки (ЛС-правосторонняя гемиколэктомия) – 10 человек, а также 2 пациента, которым выполнены паллиативные ЛС-операции при наличии отдаленных метастазов. В итоге группу сравнения составили 59 пациентов. Группы не имели статистически значимых различий по возрастному, половому составу, частоте сопутствующей патологии. Показанием к операции во всех случаях была морфологически верифицированная аденокарцинома ободочной и прямой кишки. Следует отметить статистически значимую разницу между группами по ИМТ (p = 0,015). Наш опыт свидетельствует о том, что высокий ИМТ (более 35) не является противопоказанием для Р-А-операций, более того, у таких пациентов могут максимально реализоваться преимущества роботический технологии. У пациентов с низким ИМТ (менее 20), астенического телосложения, напротив, создаются определенные препятствия при выполнении Р-А-операции (конфликт манипуляторов робота), и у данной категории пациентов более адекватной мы считаем ЛС-вмешательства. Малое количество наблюдений не позволяет нам в настоящее время сделать вывод о преимуществах робототехники у пациентов с высоким ИМТ.
Оценивая периоперационные параметры в двух группах, мы не выявили статистически значимых различий длительности операции и частоте конверсий. Причины перехода на открытые вмешательства в нашей серии также были аналогичными для обеих групп. При этом в 1-й группе нами отмечена меньшая кровопотеря, чем в группе ЛС-вмешательств (100 ± 29,9 и 141,7 ± 76 мл соответственно; p = 0,006). Полученные нами результаты сходны с данными литературы 13–16. Меньшая кровопотеря признается одним из преимуществ роботических операций при КРР, что является следствием прецизионной диссекции тканей за счет точных движений манипулятров, трехмерного изображения операционного поля с большим увеличением. Течение послеоперационного периода оказалось сходным для обеих групп пациентов. Чрезвычайно важными параметрами для пациентов с КРР является онкологическая адекватность операции. В нашем исследовании мы использовали критерии, полученные при патогистологическом исследовании препарата для подгрупп пациентов с РПК: циркулярная граница резекции, дистальный клиренс, количество удаленных лимфатических узлов. В 1-й группе получены абсолютно сопоставимые результаты с группой ЛС-операций. Полученные нами данные сходны с результатами, полученными другими авторами 13–16. Оценивая наш первый опыт использования роботизированной системы da Vinci Si в хирургии КРР, можно говорить о том, что возможности роботических манипуляторов и использование трехмерного изображения в сочетании с увеличением позволяют достаточно уверенно работать с сосудистыми и тканевыми структурами в малых анатомических пространствах. В связи с этим считаем, что использование робота наиболее показано в хирургии РПК для выполнения прецизионной нервосберегающей диссекции в малом тазу. Это преимущество роботизированной системы, по нашему мнению, может реализоваться в улучшение отдаленных результатов хирургического лечения РПК, а именно в уменьшение частоты местных рецидивов и улучшение качества жизни.
Таким образом, безопасность и эффективность Р-А-вмешательств при КРР сопоставима с лапароскопическими операциями. Отдаленные результаты Р-А-операций требуют своего дальнейшего изучения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки.
Для цитирования: Казанцева М.В., Мурашко Р.А., Уваров И.Б., Каушанский В.Б. Сравнительная оценка непосредственных результатов робот-ассистированных и лапароскопических операций при колоректальном раке. Российский онкологический журнал. 2016; 21 (1–2): 32–37. DOI: 10.18821/1028-9984-2015-21-1-32-37.
Для корреспонденции: Мурашко Роман Алексеевич, кандидат медицинских наук, заместитель главного врача по хирургии; 350040, г. Краснодар, ул. Димитрова, д. 146, e-mail: ramurashko@rambler.ru.