Первый опыт робот-ассистированной эвисцерации малого таза при местно-распространенном раке шейки матки
Введение
Рак шейки матки (РШМ) занимает второе место по распространенности у женщин в возрасте 15-44 лет [1,2]. Пациенты с РШМ подвергаются хирургическому лечению, лучевой или химиотерапии; стратегия лечения за- висит от клинической стадии и наличия рецидива. Часто- та рецидивов после первичного хирургического лечения или лучевой терапии среди женщин с раком стадии IB1- IIA составляет 10-20% в случаях при отсутствии узлового образования и до 70% при локальном распространении [3-5].
Рецидив и локальное распространение являются поканием к эвисцерации малого таза (ЭМТ) [4], который опредеется как моноблочная резекция мочевого пузыря, внутренних репродуктивных органов, прямой кишки, сигмовидной кишки, тазовой брюшины и регионарных лимфатических узлов в зависимости от степени поражения тазовых органов [7-9]. Минимально инвазивная ЭМТ может представлять собой ценную альтернативу при хирургическом лечении рака шейки матки на поздних стадиях [6]. Первую лапароскопическую тотальную ЭМТ выполнил в 2003 году Pomel et al. [14]; спустя 6 лет, Lim [15] провел первую робот-ассистированную ЭМТ. В данной статье описан наш опыт хирургического лечения пациентки с РШМ в отделении онкологии Клиники ФГБОУ ВО БГМУ Минздрава России, г. Уфа, которой была выполнена роботизированная ЭМТ с формированием илеокондуита методом Бриккера и приводится сравнение периоперационных показателей с нашим опытом открытых операций.
Материалы и методы
Пациентка 44 лет с диагнозом: Местно-распространенный рак шейки матки T4N1M0. Сопутствующий диагноз: Миома матки, анемия средней степени тяжести. Заболевание выявлено на поздней стадии в июне 2017 года. Диагноз подтвержден при биопсии шейки матки, гистологическое заключение: плоскоклеточный умеренно-дифференцированный рак. В июле 2017 года проведены курсы лучевой и химиотерапии в плане радикальной программы, РОД=7 Гр (7 сеансов) и химиотерапия цисплатином в монорежиме по 50 мл в неделю в течение 4 недель. Анамнез жизни: замужем, 5 беременностей, 2 вагинальных родов, 2 медицинских аборта, 1 выкидыш.
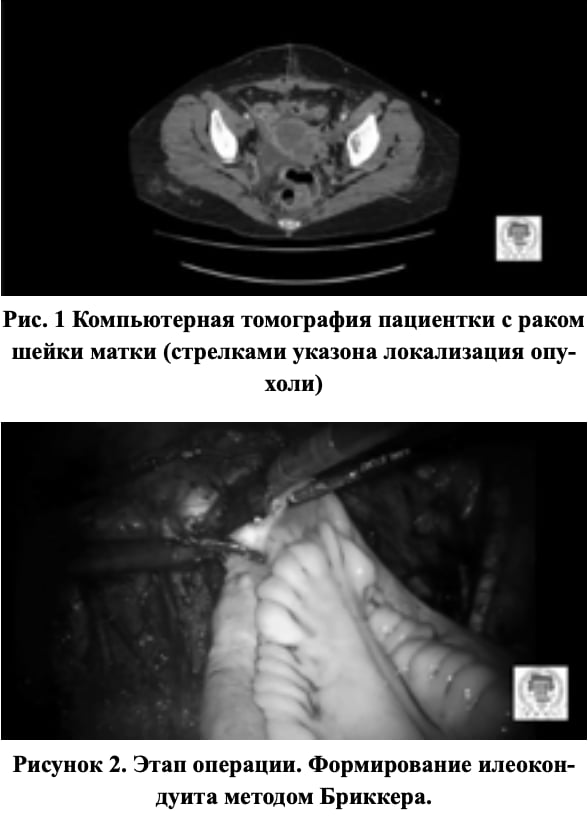
По данным рентген-компьютерной томографии с внутривенным контрастированием в области шейки матки определялось массивное образование размерами 60х62х63мм с нечеткими неровными контурами, полостями распада в толще, образование прорастает в мочевой пузырь, нижние трети обоих мочеточников, тело мат- ки, параректальную клечатку, верхнюю треть влагалища. Лимфатические узлы – нижние промежуточные до 12х6 мм, неправильной формы, слева общие и наружные подвздошные до 24х17 мм, неправильной формы и неоднородной структуры. Прямая кишка без видимых изменений, утолщение стенок и наличие новообразований не выявлено. Заключение: Местно-распространенный РШМ с распадом, метастазирование в лимфатические узлы малого таза (Рис.1).
Вследствие обструкции нижней трети обоих мочеточников у пациентки возникло осложнения опухолевого процесса в виде двустороннего гидронефроза. В декабре 2017 году выполнена двустороняя нефростомия. По данным динамической сцинтиграфии почек на момент операции функция правой почки сохранна, функция левой почки незначительно снижена.
Перед операцией проведена коррекции анемии, профилактическая антибиотикотерапия, выполнена подготовка кишечника.
Робот-ассистированная ЭМТ была выполнена в феврале 2018 года с использованием системы DaVinci SI (Sunnyvale, CA; Intuitive Surgical, Inc.) в конфигурации аналогичной робот-ассистированной цистэктомии с боковой стыковкой. Пациентка находилась в модифицированном положении Ллойда-Дэвиса. После выполнения доступа и установки рабочих трокаров выполнен адгезиолизис, определена степень распространенности опухолевого процесса и объем планируемой резекции– более 6 см. в диаметре. По отношению к крупным магистральным сосудам конгломерат опухолевой ткани характеризовался как резектабельный. Выполнена моноблоковая резекция мочевого пузыря, уретры, влагалища, матки и всех прилегающих тканей вплоть до стенки малого таза, включая ткани запирательных ямок; прямая кишка по данным предоперационного обследования и визуально осталась интактной. После выполнения расширенной тазовой лимфодиссекции выполнена мобилизация органокомплекса. Учитывая тяжелые сопутствующие осложнения со стороны нижних мочевыводящих путей решено завершить реконструктивный этап операции формированием илиокондуита методом Бриккера (Рис.2). Извлеченный трансвагинально на финальном этапе операции органокомплекс представлен на рисунке 3.
Результатам патоморфологического заключения: умеренно-дифференцированный плоскоклеточный рак шейки матки с признаками лечебного метаморфоза с врастанием в стенку мочевого пузыря, тело матки с ме- тастазами в парааортальные лимфоузлы с обеих сторон, запирательные и подвздошные лимфоузлы слева.
Больная консультирована химиотерапевтом: рекомендовано проведение адъювантной полихимиотерапии. При контрольном осмотре данных за рецидив и прогрессирование заболевания не выявлено, опухолевые маркеры в норме. Пациентке рекомендовано продолжение курса полихимиотерапии.
Результаты и обсуждение
Периоперационные характеристики случая робот- ассистированной ЭМТ сравнивались с 48 открытыми ЭМТ пациентам с местно-распространенным раком тазовой локализации. Послеоперационное ведение осуществлялось по протоколу ускоренного восстановления (enhanced recovery after surgery, ERAS): на 1-е сутки больная переведена из ОРИТ, активизирована; энтеральное питание начато на следующие сутки после операции. Газы отошли на 2-е сутки, стул – на 3-и сутки, естественным путем. Уростома функционировала адекватно, На 7-е сутки больная выписана в удовлетворительном состоянии. По сравнению с открытой ЭМТ (n=48), средний объем кровопотери, время пребывания в ОРИТ и продолжительность стационарного лечения при выполнении робот-ассистированной ЭМТ были значительно ниже по сравнению с показателями открытых ЭМТ. Значительное время продолжительности операции связано, несомненно, с затратами на стыковку оборудования и кривой об- учения техники роботических операций.
Полученные данные показывают, что робот-ассистированная лапароскопическая ЭМТ технически возможна. Операция хорошо перенесена пациенткой с низкой кровопотерей и сопоставимыми сроками продолжительности операции. Для подтверждения онкологической эффективности и предполагаемого улучшения хирургической заболеваемости необходимы дальнейшие исследования. [10-13].
Несмотря на то, что процедура ЭМТ была описана зарубежными авторами ранее [15-17], насколько нам известно, мы первыми описываем клинический случай выполнения робот-ассистированной ЭМТ в России.
Наши данные свидетельствуют о том, что пациентам с МРО малого таза могут выполняться аналогичные открытым робот-ассистированные оперативные вмешательства с меньшей кровопотерей, короткими периодами пребывания в ОРИТ, меньшими сроками пребывания в стационаре, хотя для надежных сравнений необходимы более масштабные исследования.
Заключение
Открытый хирургический доступ является стандартом для эвисцерационной хирургии. Применение новых методов, таких как роботизированные технологии, представляет собой прогресс в лечении местно-распространенныхсопухолей малого таза, хотя, как клиническая, так и экономическая эффективность метода еще не определены.
Для оценки преимуществ этой методики, главным образом для пациента с точки зрения частоты возникновения рецидива и канцер-специфической выживаемости следует провести более масштабные исследования. Одним из перспективных научных направлений является изучение качества жизни пациента в послеоперационном периоде.




