Сравнительная оценка робот-ассистированных, лапароскопических и открытых оперативных вмешательств в комбинированном лечении рака желудка
Введение. Рак желудка является пятым по заболеваемости и четвертым по смертности среди всех онкологических заболеваний в мире. Согласно последним клиническим данным, при стадии сТ2N0 и более в лечении рекомендован комбинированный подход с применением различных схем и режимов противоопухолевой лекарственной терапии. Но в настоящее время еще не определены показания к применению малоинвазивных методик в хирургическом лечении местнораспространенного рака желудка.
Цель исследования. Сравнительная оценка непосредственных результатов робот-ассистированных, лапароскопических и открытых оперативных вмешательств при раке желудка различной локализации у пациентов, прошедших неоадъювантную полихимиотерапию.
Материал и методы. Работа представляет собой исследование, основанное на ретроспективном анализе 81 истории болезни пациентов с местнораспространенным раком желудка различной локализации, прооперированных с 2018 по 2022 гг. в отделении абдоминальной онкологии СПб ГБУЗ «Городская больница № 40». Все пациенты прошли циклы предоперационного противоопухолевого лекарственного лечения (№4) в рамках периоперационной полихимиотерапии по схемам: FLOT – 64 (79%) пациента, mFOLFOX6 – 9 (11,1%) пациентов и FLOT+Трастузумаб – 8 (9,9%) пациентов. Выполнялись лапароскопические, традиционные открытые и робот-ассистированные оперативные вмешательства с использованием хирургического комплекса da Vinci.
Результаты. Было выполнено 37 (45,7%) робот-ассистированных оперативных вмешательств (22/27,2% – дистальных субтотальных резекций желудка (РаДСРЖ), 15/18,5% – гастрэктомий (РаГЭ)), 19 (23,5%) – лапароскопических (11/13,6% – ЛДСРЖ, 8/9,9% – ЛГЭ) и 25 (30,9%) операций из лапаротомного доступа (9/11,1% – ДСРЖ, 16/19,7% – ГЭ). Всем пациентам выполнялась лимфаденэктомия в объеме D2 и D2+.
При анализе непосредственных результатов были отмечены статистически значимые различия в группах по таким показателям, как время оперативного вмешательства, интраоперационная кровопотеря и срок пребывания в стационаре. В группе открытых оперативных вмешательств значимо больше оказались объем кровопотери – медиана 275 (90,00; 300) мл (р<0,001) и продолжительность послеоперационного койкодня – медиана 10,00 (9,00–14,00) дней (р=0,017). Время операции по сравнению с минимально инвазивными вмешательствами было значимо меньше – медиана 150,00 (97,50–210,00) минут при выполнении дистальных резекций и 150,00 (96,25–207,50) минут – при ГЭ (р<0,005). Не было получено статистически значимых различий в группах по частоте осложнений (р>0,05) и числу удаленных лимфатических узлов (р=0,334). Однако в процентном соотношении число ранних послеоперационных осложнений, включая летальный исход, было больше в группе открытых вмешательств (n=4/16%) по сравнению с лапароскопическими (n=2/10,5%) и роботассистированными (n=2/5,4%).
Общая частота послеоперационных осложнений IIIA–V классов по классификации Clavien-Dindo составила 9,9%. В 1 (1,2%) случае после выполнения открытой гастрэктомии был зарегистрирован летальный исход.
При гистологическом исследовании у всех больных в краях резекции не было выявлено опухолевого роста (R0). После проведенного комбинированного лечения в одном случае (1,23%) был отмечен полный регресс опухоли желудка (CAP-0). Почти полный ответ на терапию был получен в 13 случаях (16%) (CAP – 1), в 28 случаях (34,6%) был получен частичный ответ (CAP-2) и в 39 случаях (48,1%) ответа на неоадъювантную терапию получено не было (СAP-3).
Выводы. Минимально-инвазивные оперативные вмешательства в комбинированном лечении местнораспространенного рака желудка выполнимы, безопасны и онкологически обоснованы. Робот-ассистированная хирургия по сравнению с открытой и лапароскопической демонстрирует преимущества по таким показателям, как объем интраоперационной кровопотери, число удаленных лимфатических узлов, сроки активизации и госпитализации.
Введение
Согласно данным международного агентства по изучению рака (International Agency for Research on Cancer, IARC), за 2020 г. в мире было диагностировано 1 089 103 случая рака желудка (более 70% из них было зарегистрировано в Азии), что составило 5,6% от всех впервые выявленных злокачественных новообразований. При этом летальных исходов было зарегистрировано 768 793 (7,7%), что делает рак желудка пятым по заболеваемости и четвертым по смертности среди всех онкологических заболеваний в мире.
В соответствии с последними клиническими рекомендациями, комбинированный подход в лечении данного заболевания необходимо применять при клинической стадии сТ2>Nлюбое M0, которая соответствует местнораспространенной форме рака желудка [1]. Возможными вариантами комбинации с оперативным лечением являются периоперационная и адъювантная химиотерапия, а также химиолучевая терапия [2]. Оптимальность того или иного подхода в настоящее время активно обсуждается. Неоадъювантная химиотерапия с последующим оперативным вмешательством (открытым, лапароскопическим, робот-ассистированным) все чаще встречается в клинической практике при лечении местнораспространенного рака желудка. Преимущества такого мультимодального лечения подтверждаются исследованиями MAGIC [3], а также FNCLCC и FFCD [4]. Однако по данным исследования CRITICS [5], такой подход может вести к увеличению риска развития интра- и послеоперационных осложнений.
В течение последних 30 лет с момента первого сообщения об успешно выполненной лапароскопической дистальной резекции желудка, опубликованного S. Kitano и соавторами [6], мы наблюдаем переход от традиционных методик в хирургическом лечении рака желудка к минимально инвазивным. Дальнейшие международные исследования успели подтвердить безопасность лапароскопической дистальной резекции при раке желудка (JLSSG 0901 [7], CLASS-01 [8], KLASS-01 [9]). И данная методика нашла отражение в ряде клинических рекомендаций. (Japanese gastric cancer treatment guidelines 2021 (6th edition), RUSSCO, NCCN, ESMO). Возможность малоинвазинвых (лапароскопических и робот-ассистированных) операций при местнораспространенных формах в данный момент активно исследуется.
Так, группа итальянских и сербских ученых опубликовала статью [10], посвященную изучению безопасности проведения лапароскопической операции после курса неоадъювантной химиотерапии (НаПХТ) по сравнению с первичным оперативным вмешательством. Всем пациентам выполнялась гастроэктомия; в 70% случаев при этом была лапароскопическая операция и в 30% – открытая. Лимфодиссекция выполнялась в объеме D2 и D2+. По данным авторов, значимых различий между группами по времени операции, объему кровопотери и интраоперационным осложнениям не было. Однако в группе пациентов, подвергнутых предоперационному лекарственному лечению, частота конверсий была несколько выше. Кроме того, у пациентов после проведенной неоадъювантной химиотерапии была выше общая частота осложнений, в том числе и III–V степени по классификации Clavien-Dindo, особенно у пациентов старше 60 лет. Статистической разницы в безрецидивной выживаемости в обеих группах выявлено не было.
Ряд авторов провел сравнительный анализ между группами пациентов, перенесших лапароскопические и открытые оперативные вмешательства после проведенной НаПХТ. Так, группа ученых из Пекинского университетского онкологического госпиталя изучила вопрос безопасности малоинвазивных методик в лечении местнораспространенного рака желудка на примере общей группы, в которую вошли 96 пациентов [11]. Все пациенты получали до операции по 3 цикла неоадъювантного лечения по схеме XELOX. Оперативное вмешательство выполнялось не позднее 6 недель после последнего цикла химиотерапии. В результате были получены данные, свидетельствующие о значимо более низком проценте послеоперационных осложнений в группе пациентов, которым выполнялось миниинвазивное вмешательство (20% vs 46%).
Hua-Yang Pang et al в своем крупном метаанализе [12] провели сравнение результатов 18 исследований (2 рандомизированных и 16 когортных), в которых изучались результаты лечения пациентов с раком желудка, получавших НаПХТ с последующей лапароскопической или открытой дистальной резекцией желудка. Был проведен анализ результатов лечения 2096 пациентов. 933 пациентам была проведена лапароскопическая дистальная резекция, 1163 пациентам была выполнена открытая дистальная резекция желудка. В результате у пациентов, перенесших лапароскопическое вмешательство, интраоперационная кровопотеря была меньше, отмечалось более раннее первое отхождение газов и стула, пациенты в более ранние сроки получали энтеральное питание, а также сокращалось время пребывания в стационаре. При этом частота любых осложнений у пациентов в группе лапароскопических вмешательств была ниже, чем у пациентов в группе открытых вмешательств. Не оказалось существенных различий между двумя группами и в частоте R0-резекций, времени удаления назогастрального зонда и дренажной трубки. Количество удаленных лимфатических узлов в обеих группах также было сходным. И только время операций в группе пациентов, перенесших открытые операции, было значимо меньше.
Таким образом, данный метаанализ доказывает как хирургическую, так и онкологическую безопасность проведения минимально инвазивных процедур у пациентов, страдающих раком желудка и перенесших неоадъювантное лечение.
J. Rodriguez с соавторами в своей статье [13] рассматривали результаты применения роботической техники при лечении местнораспространенного рака желудка. Авторы основывались на опыте лечения 87 пациентов, 32 из которых было выполнено роботассистированное оперативное вмешательство, остальным же выполнялась открытая операция, сопровождаемая лимфаденэктомией D2 в обоих случаях. Коллектив авторов делает выводы, что роботическая хирургия (РХ) позволяет выполнять более безопасные вмешательства. По данным авторов, R0-резекция оказалась выполненной в 93% случаев в группе пациентов, подвергшихся роботической гастрэктомии (РГ), против 80% в группе пациентов, которым была сделана открытая гастрэктомия. Количество удаленных лимфатических узлов было выше в группе РГ. Потребность в наркотических анальгетиках и время пребывания в стационаре также были значимо ниже в группе пациентов после РГ. А вот количество тяжелых осложнений в группе пациентов после открытой операции (III–IV по Clavien-Dindo) было выше. Из негативных моментов обращает на себя внимание почти двукратное увеличение времени операции при использовании роботического комплекса. Однако, возможно, это было связано с тем, что в данном исследовании принимали участие хирурги, не до конца освоившие методику РХ.
При анализе работ, оценивающих эффективность и безопасность робот-ассистированных вмешательств при раке желудка, обращает на себя внимание эволюция применения данной методики с постепенным расширением показаний в сторону более распространенной локальной стадии онкопроцесса.
Профессор Hyoung I. Kim с соавторами в своих работах 2017 года сравнивал результаты применения открытых, лапароскопических и роботических методик при лечении пациентов, страдающих раком желудка. [14, 15]. Оценивая хирургическую безопасность данных методик, авторы отмечали более низкую медиану кровопотери, более короткий срок пребывания пациента в стационаре и значительно более низкий процент осложнений у пациентов, подвергнутых роботическим операциям. Однако стоит отметить, что в данных работах роботическая методика в 88% случаев применялась у пациентов с T1-T2 стадиями, тогда как при лечении пациентов с T3-T4 стадиями предпочитались открытые вмешательства. Онкологические же результаты, в том числе и отдаленные, были сходны во всех группах.
В более поздних исследованиях роботическая и лапароскопическая техника использовалась при лечении пациентов с более распространенными формами рака желудка, однако при этом не исследовались результаты в группах пациентов, прошедших циклы неоадъювантной лекарственной терапии [16, 17].
Проведение хирургического лечения после НаПХТ в целом представляет дополнительные сложности, связанные с фиброзированием эмбриональных слоев. Это объясняется инфильтративными и продуктивными воспалительными изменениями в опухолевой ткани на фоне проводимой противоопухолевой лекарственной терапии, а также прямым профибротическим и цитотоксическим воздействием химиотерапевтических препаратов. Ряд авторов высказывает предположение о преимуществах роботической технологии в преодолении патанатомических сложностей у данной категории больных [13].
Цель исследования
Провести сравнительную оценку непосредственных результатов робот-ассистированных, лапароскопических и открытых оперативных вмешательств при раке желудка различной локализации у пациентов, прошедших неоадъювантную полихимиотерапию.
Материалы и методы
Работа представляет собой исследование, основанное на ретроспективном анализе 81 истории болезни пациентов с местнораспространенным раком желудка различной локализации, прооперированных с 2018 по 2022 гг. в отделении абдоминальной онкологии СПб ГБУЗ «Городская больница № 40». Из числа прооперированных пациентов мужчин было 44 (54,2%), женщин 37 (45,8%). Средний возраст пациентов составлял 64,6+/-4,2 года (от 37,5 до 72 лет). Средний индекс массы тела (ИМТ) составил 27,63+/-2,1 кг/м2. 65% пациентов имели избыточную массу тела или ожирение (ИМТ>25кг/м2).
Коморбидный статус и риск операции, согласно шкале ASA (The American Society of Anesthesiologists), были следующими: ASA I – 9 (11,1%) пациентов, ASA II – 52 (64,3%), ASA III – 20 (24,6%) пациентов. Нутритивный статус (NRS 2002) пациентов был следующим: нормальный определялся у 62 (76,5%) пациентов, легкое нарушение нутритивного статуса отмечалось у 13 (16,1%) пациентов, умеренное – у 6 (7,4%) пациентов.
По методу оперативного вмешательства пациенты были разделены на 6 групп:
- пациенты, которым выполнена робот-ассистированная дистальная субтотальная резекция желудка (РаДСРЖ) (n=22/27,2%);
- робот-ассистированная тотальная гастрэктомия (РаГЭ) (n=15/18,5%);
- лапароскопическая дистальная субтотальная резекция (ЛДСРЖ) (n=11/13,6%);
- лапароскопическая гастрэктомия (ЛГЭ) (n=8/9,9%);
- открытая дистальная субтотальная резекция желудка (ДСРЖ) (n=9/11,1%);
- открытая гастрэктомия (ГЭ) (n=16/19,7%).
Общее количество робот-ассистированных оперативных вмешательств составило 37 (45,7%), лапароскопических операций – 19 (23,4%) и открытых вмешательств – 25 (30,9%). Общее количество дистальных субтотальных резекций желудка составило 42 (51,9%), общее количество тотальных гастрэктомий – 39 (48,1%).
Робот-ассистированные операции выполнялись с использованием роботических хирургических комплексов «da Vinci» Si модель IS3000 (da Vinci Surgical System) Intuitive Surgical и роботизированный комплекс «da Vinci» Xi модель PS4000 (da Vinci Surgical System) Intuitive Surgical.
Алгоритм предоперационного обследования и техника робот-ассистированных оперативных вмешательств при раке желудка были подробно описаны нашим коллективом в ранее опубликованной работе [18]. Ключевым моментом являлось формирование анастомозов с использованием сшивающих аппаратов. Гастроэнтеро- и эзофагоэнтероанастомозы формировались интракорпорально. Линия степлерного шва культи ДПК и культи желудка дополнительно ушивались непрерывным швом нитью v-loc 3/0. При открытых операциях гастроэнтероанастомозы также преимущественно формировались с использованием линейных степлеров. В зависимости от анатомических особенностей и длины пищевода эзофагоэнтероанастомоз при открытых вмешательствах формировался как с использованием линейного степлера, так и при помощи циркулярного сшивающего аппарата диаметром 25 мм. При оптимальной длине пищевода предпочтение отдавалось первому способу с формированием функционального или дельта-анастомоза.
Опухоль локализовывалась в кардиальном отделе в 26 (32,1%) случаях, в верхней трети тела желудка – в 9 (11,1%), в средней трети тела желудка – в 6 (7,4%), в нижней трети тел желудка – в 13 (16,1%) случаях, в антральном отделе у 27 (33,3%) пациентов. У 6 (7,4%) пациентов была отмечена инвазия опухоли в соседние органы и ткани (стадия Т4b). В двух случаях опухоль врастала в капсулу поджелудочной железы, что послужило причиной конверсии в одном из случаев; в двух же случаях инфильтрировала левую долю печени, в одном случае была инвазия в брыжейку поперечной ободочной кишки и еще в одном случае у пациента с опухолью в кардиальном отделе желудка было отмечено врастание в ножку диафрагмы, что также потребовало конверсии доступа.
Гистологический тип опухоли: у 71 (87,7%) пациента была верифицирована аденокарцинома, у 10 (12,3%) пациентов – перстневидно-клеточный рак. Предоперационное и послеоперационное распределение по стадиям указано в таблицах 1 и 2.
Таблица 1.
Характеристика пациентов (N=81)
|
|
РаДСРЖ (n=22) |
РАГЭ |
ЛДСРЖ |
ЛГЭ |
ДСРЖ |
ГЭ |
р |
|
|
возраст, медиана (лет): |
56,00 |
55,00 |
55,00 |
59,50 |
63,00 |
66,00 |
p=0,250 (тест |
|
|
Пол, абс. (%): |
p>0,05 (Х2=0,646) |
|||||||
|
– Муж |
13 (59,1%) |
7 (46,7%) |
6 (54,5%) |
4 (50%) |
5 (55,5%) |
9 (56,3%) |
||
|
– Жен |
9 (40,9%) |
8 (53,3%) |
5 (45,5%) |
4 (50%) |
4 (44,5%) |
7 (43,7%) |
||
|
имт, кг/м2 |
26,56 |
29,65 |
27,40 |
28,94 |
27,66 |
28,21 |
p=0,932 (тест Краскала Уоллиса) |
|
|
локализация опухоли, абс. (%) |
p<0,001 (Х2=81,932) |
|||||||
|
– Кардия |
0 |
10 (66,7%) |
0 |
6 (75%) |
0 |
10 (62,5%) |
||
|
– в/3 тела |
0 |
3 (20%) |
0 |
1 (12,5%) |
0 |
5 (31,25%) |
||
|
– с/3 тела |
1 (4,5%) |
2 (13,3%) |
0 |
1 (12,5%) |
1 (11,2%) |
1 (6,225%) |
||
|
– н/3 тела |
6 (27,3%) |
0 |
3 (27,3%) |
0 |
4 (44,4%) |
0 |
||
|
– Антральный отдел |
15 (68,2%) |
0 |
8 (72,7%) |
0 |
4 (44,4%) |
0 |
||
|
стадирование по сТNM, абс.: |
p>0,05 (Х2=12,953) |
|||||||
|
– сТ2 |
4 |
0 |
0 |
0 |
1 |
1 |
||
|
– сТ3 |
14 |
10 |
8 |
6 |
8 |
12 |
||
|
– сТ4а |
2 |
3 |
3 |
1 |
0 |
2 |
||
|
– сТ4b |
2 |
2 |
0 |
1 |
0 |
1 |
||
|
– cNx |
10 |
13 |
6 |
7 |
5 |
12 |
p>0,05 (Х2=10,207) |
|
|
– cN+ |
12 |
2 |
5 |
1 |
4 |
4 |
||
|
– M0 |
21 |
15 |
11 |
8 |
9 |
16 |
p>0,05 (Х2=2,715) |
|
|
M1 |
1 (положительные перитонеальные смывы – 4 цикла FLOT – полный патоморфоз) |
0 |
0 |
0 |
0 |
0 |
||
|
варианты инвазии в соседние органы, абс.: |
p>0,05 (Х2=15,423) |
|||||||
|
– капсула поджелудочной железы |
1 |
1 |
0 |
0 |
0 |
0 |
||
|
– левая доля печени |
0 |
0 |
0 |
1 |
0 |
1 |
||
|
– брыжейка поперечной ободочной кишки |
1 |
0 |
0 |
0 |
0 |
0 |
||
|
– ножка диафрагмы |
0 |
1 |
0 |
0 |
0 |
0 |
||
Все пациенты получали предоперационное противоопухолевое лекарственное лечение в рамках периоперационной полихимиотерапии. В 64 (79%) случаях терапия проводилась по схеме FLOT, в 9 (11,1%) случаях – mFOLFOX6 и в 8 (9,9%) случаях по схеме FLOT в комбинации с Трастузумабом.
Оценку лечебного патоморфоза (регресса опухоли) проводили по шкале AJCC/CAP (American Joint Committee on Cancer/College of American Pathologists).
Группы пациентов были гомогенны по возрасту, полу, ИМТ, стадии онкологического процесса (р>0,05).
Для статистического анализа использовались программы Excel 365 (Microsoft) и SPSS Statistics Version 26 (IBM). Количественные данные для нормально распределенных величин были обобщены и представлены в виде среднего арифметического взвешенного со среднеквадратичной ошибкой, для ненормально распределенных величин в виде квартильных оценок, а также в виде процентов. Для статистического анализа применялись следующие методы: U-критерий Манна-Уитни, критерий Краскала-Уоллиса, оценка общего отношения шансов Мантеля-Хенцеля, критерий Хи-квадрат Пирсона. Статистически значимым считалось значение р<0,05.
Результаты
Всего нами было выполнено 37 (45,7%) роботассистированных оперативных вмешательств (22/27,2% – РаДСРЖ, в том числе у 1 из пациентов по методике Бильрот-I, а у 21 – по Бильрот-II; 15/18,5% – РаГЭ). Лапароскопических вмешательств суммарно было 19 (23,5%); из них 11/13,6% – ЛДСРЖ, 8/9,9% – ЛГЭ. Операций из лапаротомного доступа было выполнено 25 (30,9%), в том числе 9/11,1% – ДСРЖ, 16/19,7% – ГЭ. В 6 (7,4%) случаях выполнялись комбинированные оперативные вмешательства. В 2 (2,5%) случаях при выполнении робот-ассистированной дистальной субтотальной резекции – резекция капсулы поджелудочной железы и резекция брыжейки поперечной ободочной кишки. У 2 (2,5%) пациентов выполнена атипичная резекция S3 сегмента левой доли печени при выполнении гастрэктомии лапароскопическим (n=1) и открытым доступом (n=1). При выполнении робот-ассистированных гастрэктомий было 2 (2,5%) случая конверсии доступа с выполнением в одном случае комбинированного вмешательства с резекцией капсулы поджелудочной железы, в другом – с резекцией правой ножки диафрагмы. При выполнении операций лапароскопическим доступом конверсий не было.
Всем пациентам выполнялась лимфаденэктомия в объеме D2 и D2+.
Медиана интраоперационной кровопотери при выполнении оперативных вмешательств минимально инвазивным способом была статистически значимо меньше по сравнению с открытыми операциями и составила 65,0 (10,00; 170,00) мл при выполнении робот-ассистированных операций и 120 (50,00; 175) мл – при лапароскопических. При открытых вмешательствах этот показатель составил 275,00 (90,00; 300,00), (р<0,001). Проведение гемотрансфузии не потребовалось ни в одном из наблюдений.
Медиана числа удаленных лимфатических узлов в группе робот-ассистрованных вмешательств составила 29,00 (18,00–42,25), в лапароскопической группе – 28,00 (17,00–40,00), в группе операций открытым доступом – 27,00 (15,00–39,00).
Медиана длительности РаДСРЖ составила 210,50 (153,75–249,25) минут, РаГЭ – 285,00 (276,00– 303,00) минут. Общее время включало роботический докинг, который занимал от 35 до 10 мин. Медиана длительности ЛДСРЖ составила 178,50 (131,25–225,75) минут, ЛГЭ – 190,00 (110,00– 250,00) минут. Медиана длительности открытых операций была статистически значимо меньше, чем при робот-ассистированных и лапароскопических операциях, и составила 150,00 (97,50–210,00) минут при выполнении ДСРЖ и 150,00 (96,25–207,50) минут при выполнении ГЭ. При выполнении роботассистированных оперативных вмешательств после полного освоения методики было значимо снижено время докинга и общее среднее время операции, которое стало сопоставимым с лапароскопическими вмешательствами.
Общая частота послеоперационных осложнений IIIA–V классов по классификации Clavien-Dindo составила 9,9% (ранние послеоперационные осложнения развились у 8 пациентов). В одном (1,2%) случае после выполнения открытой гастрэктомии был зарегистрирован летальный исход от массивной тромбоэмболии легочной артерии у пациента 80 лет с тяжелой сопутствующей патологией. В одном (1,2%) случае после выполнения РаГЭ развился острый послеоперационный панкреатит, купированный проведением консервативной терапии. Такое же осложнение в двух (2,47%) случаях возникло после выполнения открытой ДСРЖ. В двух (2,47%) случаях у пациентов после выполнения гастрэктомии развилась несостоятельность эзофагоэнтероанастомоза (в одном случае после лапароскопической гастрэктомии и в одном случае после открытой гастрэктомии). Данные осложнения удалось купировать консервативными мероприятиями – внутрипросветным вакуумным дренированием. В одном случае после выполнения робот-ассистированной резекции желудка развилась несостоятельность культи ДПК, что потребовало более длительного дренирования правого подпеченочного пространства с формированием наружного свища, коррекции лекарственной терапии. В одном (1,2%) случае после выполнения лапароскопической дистальной субтотальной резекции желудка в первые сутки послеоперационного периода развилось внутрибрюшное кровотечение, что потребовало релапароскопии и его остановки.
Медиана длительности госпитализации пациента при выполнении РаДСРЖ составила 7,00 (7,00–10,00) дней, при выполнении РаГЭ – 9,00 (9,00–12,00) дней и лапароскопических вмешательств – 9,00 (7,00–11,00) дней, при выполнении открытых вмешательств медиана составила 10,00 (9,00–14,00) дней.
При гистологическом исследовании у всех больных в краях резекции не было выявлено опухолевого роста (R0). После проведенного комбинированного лечения в одном случае (1,23%) был отмечен полный регресс опухоли желудка (CAP-0) у пациента с высокодифференцированной аденокарциномой, негативным статусом HER2neu, прошедшего 4 цикла неоадъювантной полихимиотерапии по схеме FLOT.
Таблица 2.
Непосредственные хирургические результаты
|
|
Робот-ассистированная резекция желудка (n=22) |
Робот- ассистированная гастрэктомия (n=15) |
Лапароскопическая резекция желудка (n=11) |
Лапароскопическая гастрэктомия (n=8) |
Открытая резекция желудка (n=9) |
Открытая гастрэктомия (n=16) |
р |
|
Конверсии, абс. (%) |
0 |
2 (3,6%)(инвазия в капсулу pancreas, инвазия в ножку диафрагмы) |
0 |
0 |
– |
– |
p=0,129 |
|
R0-резекция, абс. (%) |
22 (100%) |
15 (100%) |
11 (100%) |
8 (100%) |
9 (100%) |
16 (100%) |
p=1,000 |
|
D2 – лимфаденэктомия, абс. (%) |
22 (100%) |
15 (100%) |
11 (100%) |
8 (100%) |
9 (100%) |
16 (100%) |
p=1,000 |
|
Б-1, абс. (%) |
1 (4,5%) |
0 |
0 |
0 |
0 |
0 |
p<0,001 (X2= 109,571) |
|
Б-2, абс. (%) |
21 (95,5%) |
0 |
11 (100%) |
0 |
9 (100%) |
0 |
|
|
По Ру, абс. (%) |
0 |
15 (100%) |
0 |
8 (100%) |
0 |
9 (100%) |
|
|
Время операции (мин.), медиана |
210,50 |
285,00 |
178,50 |
190,00 |
150,00 |
150,00 |
p<0,005 |
|
Интраоперационная кровопотеря, мл, медиана |
65,00 (10,00;170,00), потребовавшая гемотрансфузии – 0 |
120,00 (50,00;175,00), потребовавшая гемотрансфузии – 0 |
275,00 (90,00;300,00) |
p<0,001 (тест |
|||
|
Послеоперационные осложнения, Clavien-Dindo IIIa-V, абс. (%) |
p>0,05 |
||||||
|
–послеоперационный панкреатит |
0 |
1 (1,2%) |
0 |
0 |
2 (2,5%) |
0 |
|
|
– несостоятельность эзофагоэнтероанастомоза |
0 |
0 |
0 |
1 (1,2%) |
0 |
1 (1,2%) |
|
|
– несостоятельность культ ДПК |
1 (1,2%) |
0 |
0 |
0 |
0 |
0 |
|
|
– внутрибрюшное кровотечение |
0 |
0 |
1 (1,2%) |
0 |
0 |
0 |
|
|
Летальность, абс. (%) |
0 |
0 |
0 |
0 |
1 (1,2%) |
0 |
p>0,05 (X2=8,100) |
|
Число удаленных лимфоузлов, шт., медиана |
29,00 (18,00-42,25) |
28,00 (17,00-40,00) |
27,00 (15,00-39,00) |
p=0,334 (тест Краскала Уоллиса) | |||
|
Койко-день, медиана |
7,00 (7,00-10,00) |
9,00 (9,00-12,00) |
9,00 (7,00-11,00) |
10,00 (9,00-14,00) |
p=0,017 (тест Краскала Уоллиса) | ||
Таблица 3.
Результаты послеоперационного патоморфологического исследования
|
|
РаДСРЖ (n=22) |
РаГЭ (n=15) |
ЛДСРЖ (n=11) |
ЛГЭ (n=8) |
ДСРЖ (n=9) |
ГЭ (n=16) |
|
Степень патоморфоза по CAP, абс.: |
||||||
|
0 |
1 |
– |
– |
– |
– |
– |
|
1 |
5 |
4 |
2 |
1 |
1 |
– |
|
2 |
9 |
5 |
6 |
1 |
3 |
4 |
|
3 |
7 |
6 |
3 |
6 |
5 |
12 |
|
Стадирование по ypTNM, абс.: |
||||||
|
ypT0 |
1 |
– |
– |
– |
– |
– |
|
ypT1a |
1 |
– |
– |
– |
– |
– |
|
ypT1b |
4 |
1 |
1 |
1 |
– |
– |
|
ypT2 |
5 |
3 |
4 |
– |
3 |
2 |
|
ypT3 |
5 |
6 |
4 |
4 |
4 |
9 |
|
ypT4a |
4 |
3 |
2 |
2 |
2 |
4 |
|
ypT4b |
2 |
2 |
– |
1 |
– |
1 |
|
ypN0 |
10 |
8 |
4 |
2 |
4 |
4 |
|
ypN1 |
4 |
2 |
3 |
2 |
3 |
5 |
|
ypN2 |
5 |
2 |
2 |
3 |
1 |
3 |
|
ypN3 |
3 |
3 |
2 |
1 |
1 |
4 |
|
M0 |
22 |
15 |
11 |
8 |
9 |
16 |
|
M1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Тип по Lauren, абс.: |
||||||
|
– кишечный |
8 |
4 |
4 |
– |
4 |
6 |
|
– диффузный |
9 |
7 |
5 |
2 |
3 |
5 |
|
– смешанный |
5 |
4 |
2 |
6 |
2 |
5 |
|
Степень дифференцировки, абс.: аденокарцинома |
||||||
|
low grade |
12 |
7 |
5 |
5 |
4 |
8 |
|
high grade |
9 |
6 |
4 |
3 |
3 |
6 |
|
перстневидно клеточный рак |
1 |
2 |
2 |
– |
2 |
2 |
Почти полный ответ на терапию был получен в 13 случаях (16%) (CAP – 1), в 28 случаях (34,6%) был получен частичный ответ (CAP-2) и в 39 случаях (48,1%) ответа не неоадъювантную терапию получено не было (СAP-3).
Ниже представлены иллюстрированные примеры микрофотографий пациентов, на которых отображена патоморфологическая картина лечебного регресса опухоли различной степени на фоне проводимой противоопухолевой лекарственной терапии.
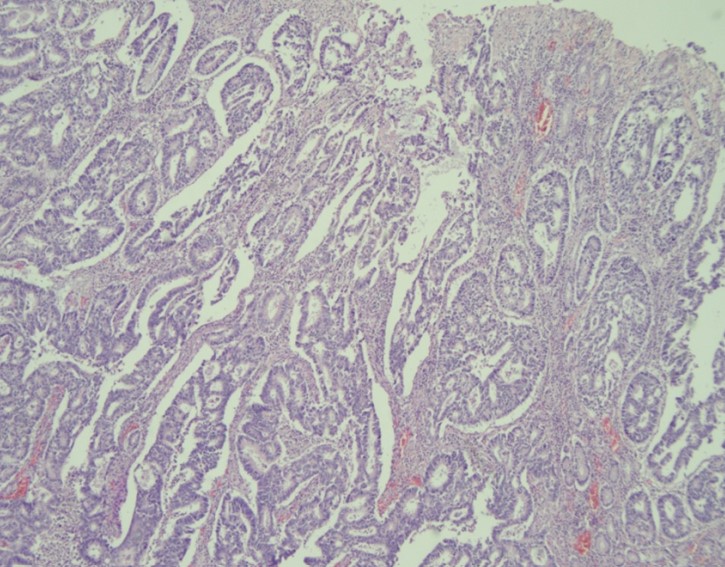 Фото 1. (Пациент К, 69 лет). САР 0 Отсутствие жизнеспособных клеток опухоли (полный ответ)
Фото 1. (Пациент К, 69 лет). САР 0 Отсутствие жизнеспособных клеток опухоли (полный ответ)
Слизистая желудка с признаками интраэпителиальной неоплазии низкой степени (low grade), отмечается выраженный склероз подслизистого слоя за счет пролиферации фибробластов с формированием разнонаправленных коллагеновых волокон, во всех слоях стенки определяются очаговые скопления лимфоцитов, макрофагов и плазматических клеток. Обращает на себя внимание ангиоматоз в подслизистом слое за счет сосудов мелкого калибра. Элементов инвазивной злокачественной опухоли не определяется.
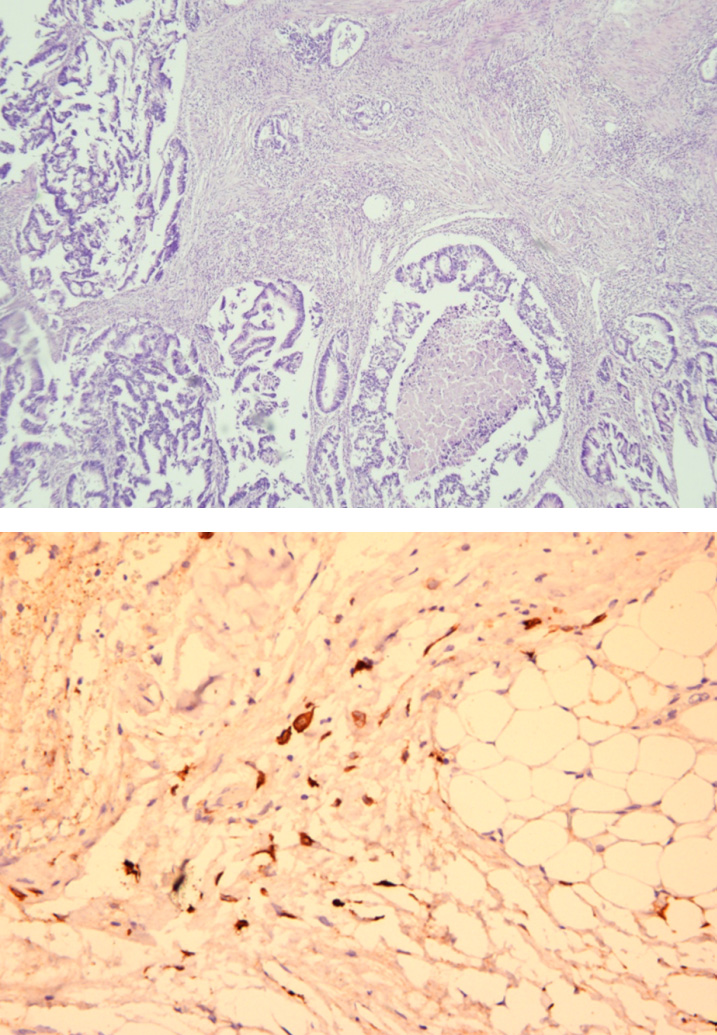 Фото 2а, 2б. (Пациентка К, 73 года). САР 1 Одиночные клетки или редкие небольшие группы раковых клеток (почти полный ответ)
Фото 2а, 2б. (Пациентка К, 73 года). САР 1 Одиночные клетки или редкие небольшие группы раковых клеток (почти полный ответ)
Опухолевое ложе представлено распространенными полями бесклеточной слизи, располагающейся в подслизистой основе, мышечном, субсерозном слоях, парагастральной жировой клетчатке и в одном лимфатическом узле малой кривизны; отмечается выраженная лимфо-гистиоцитарная инфильтрация всех слоев стенки желудка и парагастрального жировой клетчатки. Для уточнения наличия опухолевых клеток проведено ИГХ-исследование с антителом panCK (панцитокератин), при котором выявлено 15 опухолевых клеток в парагастральной жировой клетчатке с выраженными дистрофическими изменениями. Это не позволяет установить гистологический тип карциномы и дифференцировку опухоли.
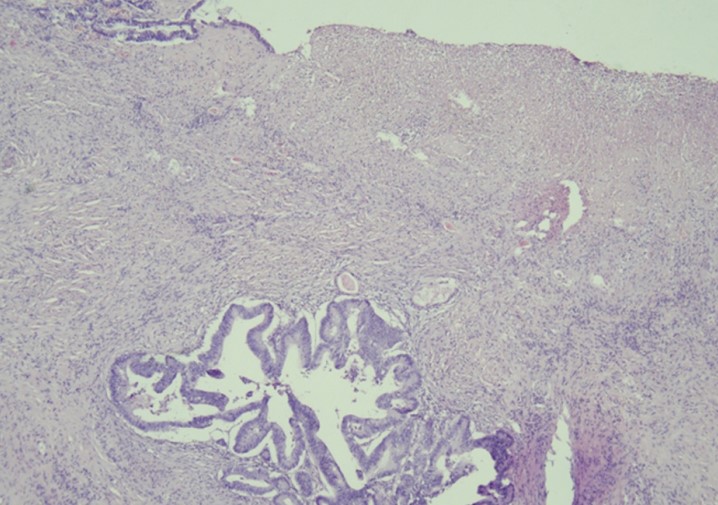 Фото 3. (Пациент Д, 74 года). САР 2 Остаточный рак с явной регрессией опухоли, но больше, чем одиночные клетки или редкие небольшие группы раковых клеток (частичный ответ)
Фото 3. (Пациент Д, 74 года). САР 2 Остаточный рак с явной регрессией опухоли, но больше, чем одиночные клетки или редкие небольшие группы раковых клеток (частичный ответ)
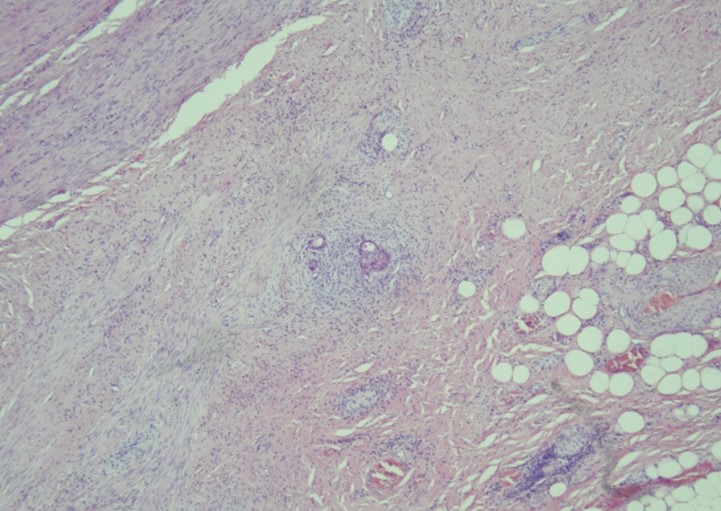 Фото 4. (Пациент В, 64 года). САР 3 Обширный остаточный рак без явной регрессии опухоли (слабый ответ или его отсутствие)
Фото 4. (Пациент В, 64 года). САР 3 Обширный остаточный рак без явной регрессии опухоли (слабый ответ или его отсутствие)
Выраженный регресс опухоли на фоне лечения (морфологический регресс I степени по ТumorRegressionScore – протокол Stomach_4.2.1.0.REL_CAPCP ).
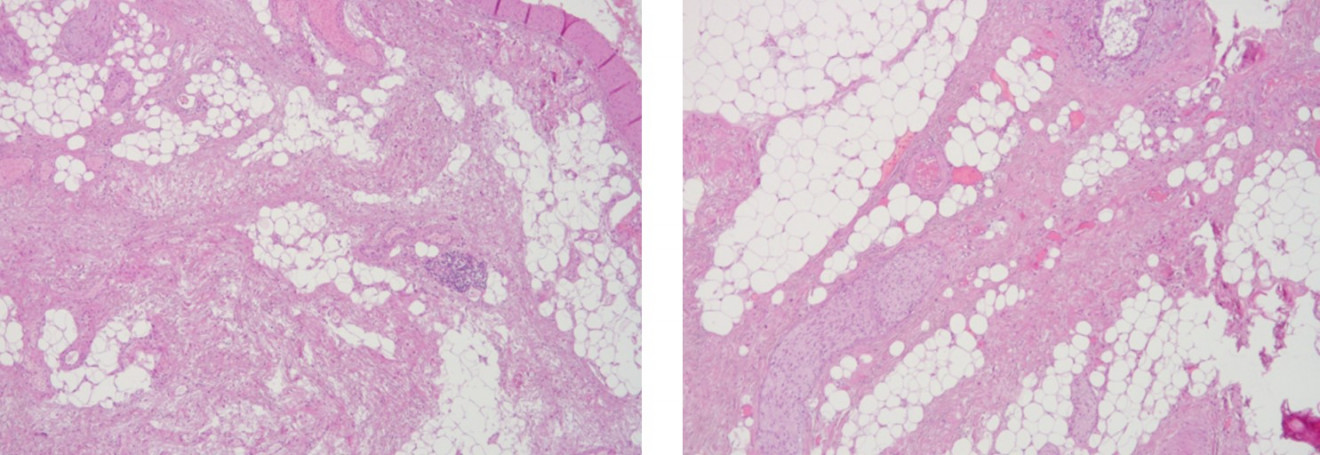 Фото 5а, 5б. (Пациент С, 67 лет). Микроскопическая картина фиброза
Фото 5а, 5б. (Пациент С, 67 лет). Микроскопическая картина фиброза
Также хотелось бы отметить, что в ходе выполнения оперативных вмешательств на фоне периоперационной полихимиотерапии нами было выявлено повышенное перитуморозное воспаление, нарушение дифференцировки тканей и признаки фиброзирования межфасциальных слоев, а также повышенная кровоточивость, что вызывало некоторые технические трудности визуализации сосудистых структур. Мы провели дополнительное морфологическое исследование у данной группы пациентов и получили данные о клеточном составе и перитуморозном микроокружении.
На микрофотографии отмечается соединительная ткань с выраженным фиброзом, окружающим пучки нервных стволов, множественными рассеянными активированными фибробластами. Васкуляризация умеренная за счет фокусов сгруппированных мелкокалиберных тонко- и толстостенных округлых сосудов с типичным эндотелием, неравномерным полнокровием. Визуализируется мультифокальный умеренный лимфоплазмоцитарный воспалительный инфильтрат с примесью эозинофилов, нейтрофилов, гистиоцитов и макрофагов.
Обсуждение
Полный курс периоперационной противоопухолевой лекарственной терапии (4+операция+4) прошли 74 (91,4%) пациента. Это подтверждает преимущество такого подхода в сравнительном аспекте с адъювантным режимом полихимиотерапии (АПХТ), при котором, по данным ряда авторов, от 30 до 40% пациентов не завершают полный курс лечения по причине непереносимости и токсичности [19]. Кроме того, в 51,9% случаев отмечен лечебный регресс опухоли различной степени на фоне проводимой лекарственной терапии, что также подтверждает эффективность комбинированного лечения. Отмечена значимая миграция патоморфологической стадии заболевания по сравнению с исходной клинической.
5 (6,2%) пациентов в нашем исследовании не завершили послеоперационные циклы в связи с развившимися послеоперационными осложнениями (3 – в группе открытых вмешательств, включая 1 летальный исход, 1 – в группе ЛГЭ и 1 пациент – в группе РаДСРЖ). Развившиеся осложнения не были окончательно купированы до срока допустимого начала терапии. У 2 (2,5%) пациентов, получавших лечение по схеме FLOT развилась гематологическая токсичность, что потребовало значительной редукции дозы.
При анализе непосредственных результатов отмечены статистически значимые различия в группах по таким показателям, как время оперативного вмешательства, интраоперационная кровопотеря и срок пребывания в стационаре. В группе открытых оперативных вмешательств объем кровопотери (р<0,001) и продолжительность послеоперационного койка-дня (р=0,017) оказались значимо больше. Время операции по сравнению с минимально инвазивными вмешательствами, напротив, было значимо меньше (р<0,005). Не было получено статистически значимых различий в группах по частоте осложнений (р>0,05) и числу удаленных лимфатических узлов (р=0,334). Однако в процентном соотношении число ранних послеоперационных осложнений, включая летальный исход, было больше в группе открытых вмешательств (n=4/16%) по сравнению с лапароскопическими (n=2/10,5%) и робот-ассистированными (n=2/5,4%). Именно это немаловажное обстоятельство является основой и предпосылкой проведения комбинированного лечения (ПХТ+хирургическое+ПХТ) в полном объеме в группах пациентов, которым выполнялись оперативные вмешательства минимально инвазивным способом. Дополнительным аргументом стал и более короткий восстановительный период после лапароскопических и робот-ассистированных оперативных вмешательств, который позволил начать проведение АПХТ в более ранние сроки.
5 (6,2%) пациентов в нашем исследовании не завершили послеоперационные циклы в связи с развившимися послеоперационными осложнениями (3 – в группе открытых вмешательств, включая 1 летальный исход, 1 – в группе ЛГЭ и 1 пациент – в группе РаДСРЖ). Развившиеся осложнения не были окончательно купированы до срока допустимого начала терапии. У 2 (2,5%) пациентов, получавших лечение по схеме FLOT развилась гематологическая токсичность, что потребовало значительной редукции дозы.
В нашем исследовании применение роботического комплекса da Vinci при хирургическом лечении пациентов, прошедших циклы НаПХТ, показало его высокую эффективность. Всем пациентам выполнена D2-лимфаденэктомия, у ряда пациентов (n=11/29,7%) по показаниям дополненная удалением 8р и 12р групп лимфатических узлов. Во всех случаях удалось выполнить вмешательства в объеме R0, что показывает лучшие результаты в сравнении с европейскими исследованиями, где робот-ассистированные R0-вмешательства выполнялись в 93% случаев.
Такие технические преимущества данного комплекса, как 3D-визуализация более высокой четкости с эффектом погружения (InSide), артикуляция роботических инструментов и электрохирургическое оборудование высокого качества с адаптивными настройками, показали свои преимущества во время оперативного вмешательства у пациентов, прошедших циклы ПХТ. Это подтверждается полученными нами данными о меньшем объеме кровопотери и более высоком качестве лимфаденэктомии по сравнению с лапароскопическими и открытыми вмешательствами, несмотря на встречаемость больных в группе робот-ассистированной хирургии со стадией рТ3–Т4b в 59,5% случаев. В европейских и азиатских исследованиях этот показатель составлял 10–30%. В группе робот-ассистированных гастрэктомий в нашей работе было отмечено 2 случая конверсии доступа, связанного с инвазией опухоли в окружающие органы и ткани, что, к сожалению, говорит о недооценке данных предоперационного стадирования.
Мы планируем провести анализ отдаленных онкологических результатов у данной группы пациентов.
Заключение
Недавно разработанные подходы к лечению такой сложной онкопатологии, как рак желудка, в комбинации с хирургическим лечением и противоопухолевой лекарственной терапией создали новые, более технологичные условия выполнения оперативного вмешательства. При доказанной эффективности и хорошей переносимости неоадъювантной химиотерапии демонстрируется и возможность безопасного – с хирургической точки зрения, – выполнения минимально инвазивных оперативных вмешательств в рамках комбинированного лечения с минимальным числом осложнений. На сегодняшний день роботассистированная хирургия – самая современная методика в области резекционных и реконструктивных оперативных вмешательств. Использование данной технологии при хирургическом лечении местнораспространенного рака желудка возможно, безопасно и онкологически адекватно при условии индивидуального отбора пациентов и может быть рекомендовано к применению в высокоспециализированных онкологических центрах.
Выводы
Минимально-инвазивные оперативные вмешательства в комбинированном лечении местнораспространенного рака желудка выполнимы, безопасны и онкологически обоснованы. Робот-ассистированная хирургия по сравнению с открытой и лапароскопической демонстрирует преимущества по таким показателям, как объем интраоперационной кровопотери, число удаленных лимфатических узлов, а также ранние сроки активизации и более короткий послеоперационный койко-день. Совокупность этих факторов позволяет завершать комбинированное лечение в полном объеме и в установленные сроки – в соответствии с самыми современными стандартами оказания онкологической помощи. Мы надеемся, что все это скажется на общем уровне качества лечения и позволит улучшить его отдаленные результаты.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует.