Робот-ассистированная повторная резекция рецидивных опухолей почки
Введение
В настоящее время рак почки остается распространенным злокачественным новообразованием мочеполовой системы. Активное развитие и внедрение современных методов визуализации привели к ранней диагностике опухолей почки и увеличению количества выявляемых небольших ренальных образований. Поэтому тактика оперативного лечения пациентов с данной патологией постепенно стала смещаться от радикальной нефрэктомии к органосохраняющим операциям [1, 2]. Среди последних чаще выполняют парциальную нефрэктомию (ПН), а при противопоказаниях к ней и выраженной морбидности пациента урологи прибегают к различным методам локальной аблации опухоли. Наряду с улучшением диагностики рака почки на ранних стадиях постепенно происходила эволюция хирургического доступа при проведении радикальной нефрэктомии или ПН. За последние десятилетия эти операции стали активно выполняться вначале лапароскопическим и далее роботассистированным доступами.
Увеличение количества небольших ренальных опухолей привело к росту выполнения органосохраняющих вмешательств, что, несомненно, может ассоциироваться с высоким риском местных рецидивов в оперированной почке. Частые рецидивы также могут быть связаны с расширением показаний к ПН при опухолях стадии ≥Т1b и резекции более сложных образований [2–6]. В литературе встречаются различные показатели частоты развития рецидивов рака почки после органосохраняющих операций – от 2,9 до 11 % [7–10]. В исследовании P.H. Shah и соавт. у 5,6 % пациентов после первичной ПН по поводу клинически локализованного рака почки был обнаружен рецидив заболевания [4]. M.W. Salkini и соавт. низкую частоту рецидива (2,9 %) объясняют тем, что были проанализированы результаты ПН, выполненных только одним хирургом [8]. В отличие от них, урологи из Кливлендской клиники сообщили о частоте рецидивов 11 % после роботизированной, лапароскопической и открытой ПН [7].
Резекция почки может быть сложным вариантом хирургического лечения для тех пациентов, у которых ранее выполнялась ПН и у кого развилась рецидивная опухоль в ипсилатеральной почке. В подобных случаях различные урологические сообщества считают целесообразным выполнение радикальной нефрэктомии. Однако у определенной группы больных целесообразно провести повторную ПН, позволяющую максимально сохранить функцию почки. В небольшом количестве публикаций показано, что повторная ПН ассоциируется с хорошими функциональными и онкологическими результатами [11–14]. Однако при данной операции возможны технические проблемы изза паранефральных рубцовых изменений и связанный с ними высокий риск осложнений. Значительные сложности возникают в тех случаях, когда планируется лапароскопическая ПН после открытого или малоинвазивного удаления ренального образования.В настоящее время при резекции опухоли почки, особенно рецидивной, привлекательным является роботассистированный доступ. Использование роботизированной системы Da Vinci, по сравнению с открытой и лапароскопической хирургией рака почки, позволяет безопасно и с меньшим процентом осложнений удалить опухоль почки, особенно сложные и неудобно локализованные ренальные новообразования [1, 2, 14–16].
В англоязычной литературе публикаций о результатах роботассистированных ПН (РАПН) при рецидивных опухолях почек мало, нередко в разные годы представлены результаты только одной клиники, а в отечественной литературе подобные работы отсутствуют.
Цель исследования – продемонстрировать возможность и безопасность повторной РАПН у пациентов с рецидивом опухоли почки после предыдущей ее резекции.
Материалы и методы
В центре урологии Мариинской больницы (Санкт-Петербург) с 2018 по 2022 г. РАПН была выполнена 86 больным (46 (59,5 %) мужчинам и 40 (40,5 %) женщинам) с опухолью почки стадий Т1а (n = 72) и Т1b (n = 14). Средний возраст пациентов составил 58,0 ± 8,5 года, размер опухоли колебался от 1,2 до 5,2 см.
Всем больным перед операцией выполняли компьютерную томографию с ангиографией и трехмерной реконструкцией для определения локализации и размера опухоли, анатомии почечной артерии и ее ветвей. Для оценки новообразования применяли нефрометрическую шкалу R.E.N.A.L. Средний балл по нефрометрической шкале R.E.N.A.L. составил 5,8. Осложнения оценивали по классификации Clavien.
У 7 больных, у которых был диагностирован рецидив опухоли рака почки после предыдущей ПН, выполнялась повторная резекция почки. У 5 пациентов диагностировано одно, у 2 – два рецидивных образования, которые во всех случаях располагались вне зоны первичной резекции. Время между 1й и 2й операциями составило в среднем 24 (12–46) мес. При патоморфологическом исследовании изначально у 4 больных был выявлен почечноклеточный, у 2 – папиллярный, у 1 – хромофобный рак. Данные пациентов с рецидивными опухолями почек представлены в табл. 1.
Всем пациентам выполнена повторная РАПН трансперитонеальным доступом. Пережатие почечной артерии проводилось у 2, ее ветви – у 3, безышемическая резекция – у 2 пациентов. Выполняли оценку среднего времени операции, объема кровопотери, времени тепловой ишемии (ВТИ), пред и послеоперационной функции почек.
| Показатель | Значение |
| 1 | 2 |
| Пол, n: | |
| мужской | 4 |
| женский | 3 |
| Средний возраст больных (диапазон), лет | 46,5 (35–72) |
| Средний индекс массы тела (диапазон), кг/м2 | 28,5 (24,0–35,0) |
| Средний размер опухоли (диапазон), см | 2,4 ± 0,8 (1,2–3,5) |
| Сторона локализации, n: | |
| слева | 3 |
| справа | 4 |
| Средний балл по нефрометрической шкале R.E.N.A.L. (диапазон) | 5,8 (5–8) |
| Время после первой операции, мес | 24 (14–46) |
| Предыдущая операция, n: | |
| открытая резекция почки | 2 |
| лапароскопическая резекция почки | 5 |
| Локализация опухоли (n = 9), n: | |
| передняя | 5 |
| по наружному краю почки | 2 |
| задняя | 2 |
Таблица 1. Данные больных с рецидивными опухолями почки после парциальной нефрэктомии (n = 7)
Хирургическая техника. О технике РАПН в нашей клинике мы сообщали ранее [16]. Все операции выполняли с помощью роботизированной хирургической системы Da Vinci Si и трансперитонеальным доступом. В положении больного на боку при РАПН слева устанавливали 5 портов, справа при необходимости для ретракции печени использовали дополнительный 5-миллиметровый порт. Технические сложности, относящиеся к этой группе пациентов, в основном связаны с наличием рубцов в брюшной полости и паранефральном пространстве.
Во время доступа и мобилизации почки следует свести к минимуму риск непреднамеренных внутрибрюшных травм. Необходимо аккуратное рассечение спаек, что позволяет избежать повреждения соседних органов и значительного кровотечения. При спайках, вовлекающих кишечник и его брыжейку, нужно минимально использовать электрокоагуляцию, чтобы исключить термотравму кишечника. Почечную артерию полностью пережимали у 2 больных с опухолями почечного синуса. В дальнейшем применяли только селективную ишемию, а во время последних 2 операций – безышемическую методику. Необходимо отметить, что внутрибрюшные спайки у больных после открытой ПН, оперированных люмботомическим доступом, были менее выражены, чем после лапароскопической ПН (рис. 1).
Следующим ответственным этапом операции является мобилизация почки и ее сосудов из рубцовых тканей. Необходимо соблюдать особую осторожность при выделении почечной артерии и вены, травма которых может привести к интенсивному кровотечению вплоть до нефрэктомии. Вопрос о пережатии почечной артерии решается индивидуально в зависимости от локализации и размера опухоли, а также от возможности выделения сосудов и их пережатия. Кроме этого, скелетирование артерии и вены по отдельности может быть слишком рискованным и нецелесообразным. Поэтому при необходимости для пережатия почечных сосудов можно использовать лапароскопический зажим Сатинского.
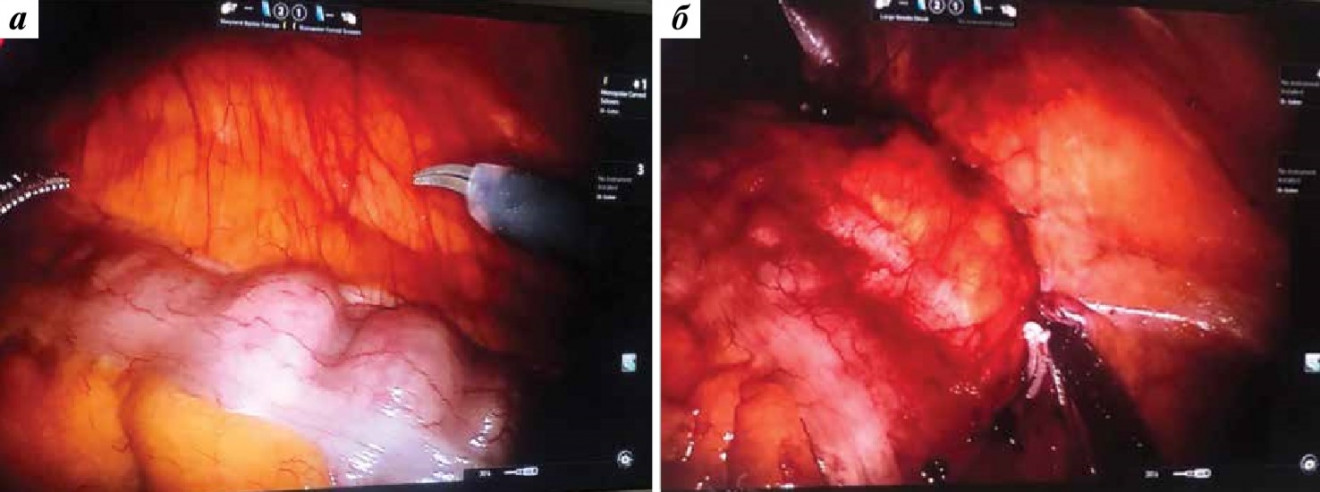
Рис. 1. Робот-ассистированная резекция рецидивной опухоли левой почки: а – рубцовые изменения в брюшной полости после предыдущей открытой резекции почки отсутствуют; б – перитонизация раны после удаления рецидивной опухоли
Результаты
Повторная РАПН при рецидивной опухоли почки была успешной у всех больных. Среднее время операции составило 180 (130–210) мин. ВТИ при пережатии почечной артерии составило 16 и 20 мин, при селективной ишемии – 14, 18 и 24 мин. Средний объем кровопотери – 220 (80–650) мл. Интраоперационных осложнений при повторной РАПН не зафиксировано.
Послеоперационные осложнения I–II степеней по классификации Clavien наблюдались у 2 пациентов: у 1 больного выявлен илеус, разрешившийся спонтанно, у 2го – кровотечение, потребовавшее переливания крови. Результаты повторной РАПН приведены в табл. 2. У 2 больных были удалены 2 образования (рис. 2). У 1 из них при контрольном обследовании рецидива опухоли не выявлено, функция почек удовлетворительная (рис. 3).
При патоморфологическом исследовании 9 резецированных опухолей в 5 случаях диагностирован почечноклеточный рак, в 3 – папиллярный, в 1 – хромофобный рак, что совпало с результатами первичных гистологических исследований. У всех больных была установлена стадия заболевания рТ1а. Скорость клубочковой фильтрации (СКФ) снизилась в среднем на 8 % (с 62 до 54 мл/мин/1,73 м2). За период наблюдения 16 мес рецидива опухоли не выявлено.
| Показатель | Значение |
| Среднее время операции (диапазон), мин | 180 (130–210) |
| Средний объем кровопотери (диапазон), мл | 220 (80–650) |
| Ишемия почки, n (время ишемии, мин): | |
| стандартная | 2 (16, 20) |
| селективная | 3 (14, 18, 24) |
| безышемическая методика | 2 |
| Среднее время госпитализации (диапазон), дни | 3,5 (2–7) |
| Патогистологическая стадия рТ1a, n | 7 |
| Гистологический тип опухоли (n = 9), n: | |
| почечноклеточный рак | 5 |
| папиллярный рак | 3 |
| хромофобный рак | 1 |
| Интраоперационные осложнения | – |
| Послеоперационные осложнения (по классификации Clavien), n: | |
| I | 1 |
| II | 1 |
| ≥III | – |
| Средний период наблюдения (диапазон), мес | 16,0 (8,0–24,0) |
Таблица 2. Хирургические результаты повторной робот-ассистированной резекции почки (n = 7)
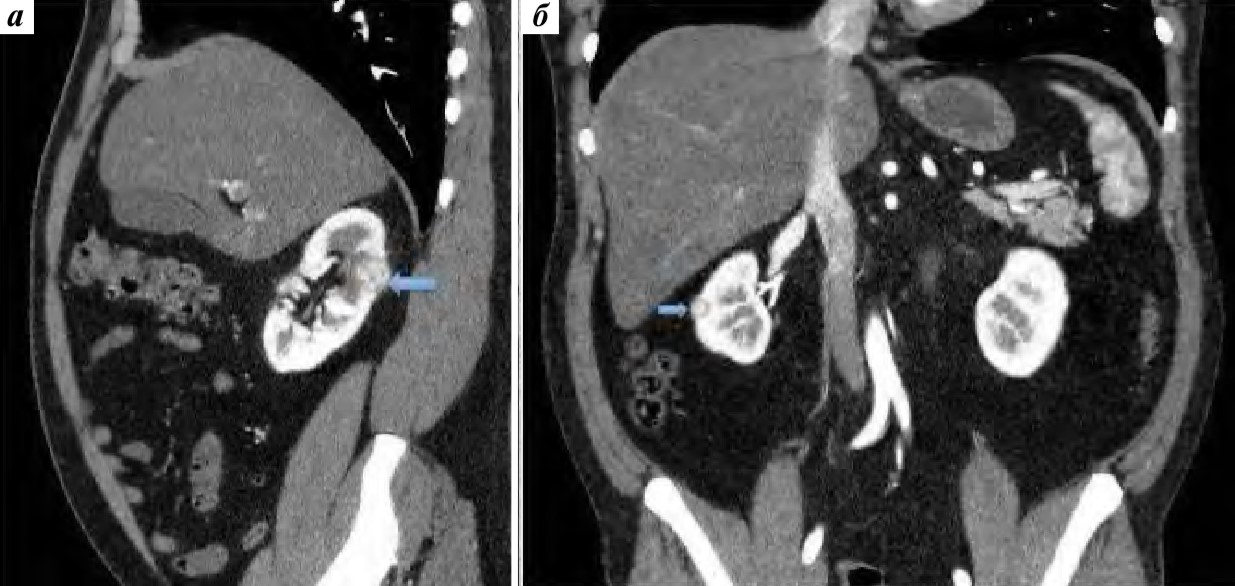
Рис. 2. Рецидив опухоли правой почки после лапароскопической парциальной нефрэктомии: а – рецидивное образование правой почки размером 2,4 см (стрелка); б – рецидивная опухоль правой почки размером 1,2 см (стрелка)
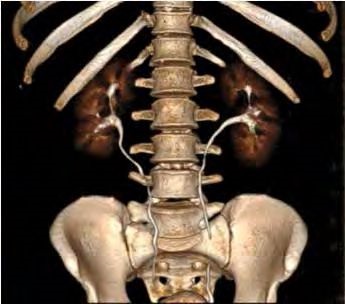
Рис. 3. Компьютерно-томографическая урография после робот-ассистированной резекции рецидивных опухолей правой почки. Функция обеих почек удовлетворительная
Обсуждение
Органосохраняющие вмешательства стали основным методом лечения больных с небольшими опухолями почек и обеспечивают удовлетворительные функциональные и онкологические результаты. Однако после этих операций наблюдаются местные рецидивы, которые, по данным литературы, встречаются в 2,9 – 11 % случаев и чаще развиваются у больных с мультифокальными и наследственными формами рака почки [6–10, 12]. Подобным пациентам также требуется оперативное лечение, что представляет серьезную проблему, в том числе для урологов, в связи с высоким риском различных осложнений. Лечение рецидивных опухолей почки включает радикальную нефрэктомию, аблацию и повторную ПН. Среди них удаление почки необходимо рассматривать как крайний вариант, так как оно приводит к нарушению функции почек и нарастанию хронической болезни почек. Аблационные методы, несмотря на их малоинвазивность и эффективность, не всегда выполнимы изза локализации опухоли или отсутствия необходимого оборудования.
В литературе повторные ПН описаны в нескольких работах, которые в основном касались результатов хирургического лечения пациентов с болезнью фон Гиппеля– Линдау [12, 13, 17–20]. Данные вмешательства, несомненно, позволяли сохранить функцию почки, избежать хронического диализа или отсрочить его, увеличить общую выживаемость. Однако после этих операций наблюдалась высокая частота интра и послеоперационных осложнений [11]. Из-за выраженного паранефрального рубцового процесса выполнение повторной ПН может быть сложным и длительным по времени даже в опытных руках [13]. Рубцовый процесс в паранефральном пространстве может затруднить выделение почки и ее сосудов при повторной ПН. В этих случаях риск повреждения соседних с зоной операции органов увеличивается, возможны травмы кишечника, плевральной полости, паренхиматозных органов. В работе N.W. Liu и соавт. сообщили о серьезных повреждениях кровеносных сосудов у 25 % пациентов, а мочевые свищи наблюдались в 3 раза чаще, чем при первичных ПН [13]. В связи с этим применение роботизированной системы может предоставить хирургу эффективный инструмент для решения существующих проблем.
Одним из ключевых моментов ПН является ВТИ, влияющее на конечную функцию оперированной почки. Среднее ВТИ при открытой повторной ПН было сравнительно длительным, особенно у пациентов с болезнью фон Гиппеля–Линдау, когда приходилось резецировать несколько опухолей. У больных при РАПН по поводу рецидивных опухолей почки среднее ВТИ было небольшим. По данным R. Autorino и соавт., оно составило 17,5 мин [21], в работе S. Jain и соавт. – 14,6 мин [22]. Для минимизации степени ишемии ПН нередко стали выполнять без пережатия почечной артерии, что может быть причиной выраженной интраоперационной кровопотери. Данная методика в открытой серии ПН применялась в 25–64 % случаев [12, 13, 17, 19]. Установлено, что предполагаемая кровопотеря при этих операциях была в 5 раз выше, чем у пациентов, перенесших первичную открытую ПН [12, 13].
В литературе встречается малое количество работо результатах повторной РАПН [14, 21–23]. R. Autorino и соавт. 9 больным с рецидивными опухолями почек выполняли повторную РАПН. Средняя продолжительность РАПН составила 153 мин, ВТИ – 17,5 мин, объем интраоперационной кровопотери – 150 (75–275) мл. Интраоперационных осложнений не отмечено, в послеоперационном периоде наблюдались кишечная непроходимость (n = 1) и временное повышение уровня креатинина в крови (n = 1), которое не требовало проведения диализа. Все пациенты были живы на момент последнего наблюдения. После операции зафиксировано среднее снижение СКФ на 7 % без существенной разницы между средними значениями данного показателя до и после операции (70,5 мл/мин/1,73 м2 против 63,5 мл/мин/1,73 м2; p>0,05). Ограниченный период наблюдения не позволяет достоверно оценить онкологические исходы. Тем не менее отрицательный хирургический край резекции у всех пациентов представляет обнадеживающие отдаленные результаты [21].
S. Jain и соавт. выполнили повторную РАПН 5 мужчинам со средним возрастом 64,2 года, ранее перенесшим открытую (n = 4) или лапароскопическую (n = 1) ПН по поводу почечноклеточного (n = 2) и папиллярного (n = 2) рака почки. Время между 1й и 2й операциями составило 27 (9–60) мес. У 1 пациента после лапароскопической ПН результаты патоморфологического исследования удаленного препарата показали нормальную почечную паренхиму. СКФ после двух операций снизилась в среднем на 10 %. У всех 5 пациентов установлена стадия заболевания pT1a, гистологически выявлен почечноклеточный (n = 3) и папиллярный (n = 2) рак. При среднем сроке наблюдения 15,6 (8–21) мес данных о наличии рецидива не получено [22].
M. Watson и соавт. 124 пациентам выполнили РАПН, 26 (21 %) из них – повторную ПН. У 22 из 26 больных выполнена вторичная ПН, у 2 – третичная. В этой когорте 16 (62 %) пациентов имели в анамнезе преды дущие открытые ипсилатеральные операции, остальные 10 больных ранее перенесли минимально инвазивные вмешательства, 4 из них выполнена термоаблация. В серии из 26 роботизированных резекций почки к конверсии авторы прибегли в 4 (15,4 %) случаях. Среднее число резецированных опухолей при повторной РАПН составило 3 (1–29), в то время как в группе первичной РАПН – 1,5 (1–52) (р = 0,44). Объем кровопотери был значительно выше (р = 0,01) в группе повторной РАПН по сравнению с первичной (900 мл против 500 мл). Высокий объем кровопотери может быть связан со сложностью операций изза рубцовых изменений и использования безышемической резекции. Выраженность рубцовых тканей после предыдущих операций сильно отличается. В некоторых случаях спайки могут быть минимальными, в то время как у других больных наблюдается выраженный рубцовый процесс. Пережатие почечной артерии проводилось в 44,4 % случаев со средним ВТИ 28 мин. У 46 (46,9) из 98 больных с первичной РАПН диагностировано наследственное заболевание, которое выявлено у 19 (73,1 %) из 26 пациентов, подвергнутых повторной РАПН (р = 0,07). Авторы также отметили хорошее сохранение функции почек при 3-месячном наблюдении после повторной РАПН, снижение СКФ составило 5,2 % (от 39,50 до 24,66 %). Случаев потери почки не зафиксировано, поэтому диализ не выполнялся [14].
A. Martini и соавт. выполнили спасительную роботассистированную операцию на почке 67 пациентам, которым ранее выполнялись ПН (n = 32) и локальная аблация опухоли (n = 35). После первичной ПН 2 больным выполнена РАПН, 10 больным – роботассистированная радикальная нефрэктомия (РАРН) в связи с метахронным рецидивом в той же почке. Интра и послеоперационных осложнений не было. В связи с локальным рецидивом в зоне предыдущей резекции 6 пациентов были подвергнуты РАПН и 14 – РАРН. В группе РАПН интраоперационные осложнения наблюдались в 33 % случаев, послеоперационных осложнений не зафиксировано. В группе РАРН интраоперационных осложнений не отмечено, послеоперационные наблюдались в 7 % случаев. За 3 года наблюдения после РАПН и РАРН локальный рецидив отсутствовал у 64 и 82 % больных соответственно. После этих операций 3летняя выживаемость составила 80 и 79 %, СКФ – 57 и 45 мл/мин/1,73 м2 соответственно. После аблации все 35 больных были подвергнуты РАПН, интраоперационных осложнений не отмечено, послеоперационные наблюдались в 20 % случаев. Местных рецидивов не выявлено, выживаемость без метастазов составила 90 %, СКФ – 38 мл/мин/1,73 м2 [23].
S. Gurram и соавт. выполнили повторную ПН 192 пациентам. Из них 113 больных были подвергнуты открытой ПН после предварительной открытой (n = 103) и мало инвазивной (n = 10) резекции почки. Повторная РАПН S. Gurram и соавт. выполнили повторную ПН 192 пациентам. Из них 113 больных были подвергнуты открытой ПН после предварительной открытой (n = 103) и мало инвазивной (n = 10) резекции почки. Повторная РАПН выполнена 79 больным после открытой (n = 47) и малоинвазивной (n = 32) ПН. Частота общих и серьезных (≥III степени) осложнений составила 65 и 19 % соответственно. Частота гемотрансфузий, общих и серьезных осложнений была статистически значимо меньше при РАПН, чем при открытой ПН. Мультивариантный анализ показал, что роботический доступ был протективным фактором развития серьезных осложнений(р = 0,02), в том числе выраженной кровопотери (р = 0,004) [24]. По данным литературы, S. Gurram
и соавт. [24] имеют наибольший опыт повторной ПН при рецидивных опухолях почки, в том числе с использованием роботического доступа.
Ограничением как проведенного нами исследования, так и работ R. Autorino и соавт. [21] и S. Jain и соавт. [22], является небольшое число оперированных больных с рецидивными опухолями почек. Это не позволяет провести сравнительный анализ с результатами других методов лечения данной группы пациентов. Кроме того, непродолжительные сроки наблюдения представляет собой еще одно существенное ограничение настоящего исследования. Основная цель нашей работы состояла в том, чтобы установить эффективность и безопасность повторной РАПН у больных с рецидивными опухолями почек. Необходимы дальнейшие межклинические исследования с более длительным периодом наблюдения для оценки отдаленных функциональных и онкологических результатов повторной резекции рецидивных опухолей почки.
Заключение
Повторная РАПН может быть методом выбора у больных с местным рецидивом опухоли после ранее выполненной резекции почки. Несмотря на определенные сложности проведения операций изза рубцовых изменений, роботический доступ позволяет безопасно и эффективно выполнить повторную ПН у этой категории пациентов.