Робот-ассистированные и лапароскопические антирефлюксные операции при кардиофундальных и субтотальных грыжах пищеводного отверстия диафрагмы: непосредственные результаты
Резюме
Цель исследования. Сравнение непосредственных результатов лапароскопических (ЛФ) и робот-ассистированных (РАФ) фундопликаций у пациентов с кардиофундальными и субтотальными грыжами пищеводного отверстия диафрагмы (ГПОД).
Материал и методы. В исследование включены 64 пациента, оперированных по поводу ГПОД и рефлюкс-эзофагита (РЭ) в клинике Факультетской хирургии им. Н.Н. Бурденко Сеченовского университета в период с января 2015 г. по февраль 2021 г. В основную группу были включены 32 пациента, которым выполнена РАФ. Среди них кардиофундальные ГПОД диагностированы у 21 (66%) пациента, субтотальные — у 11 (34%). В группу сравнения были включены 32 пациента, которым была выполнена ЛФ, из них кардиофундальные ГПОД выявлены у 20 (62%), субтотальные — у 12 (38%). Обе группы были сопоставимы по возрасту, гендерному составу, сопутствующим заболеваниям. Всем пациентам была выполнена фундопликация по А.Ф. Черноусову.
Результаты. Средняя продолжительность операции была меньше в группе РАФ (125±6,6 мин против 153,2±8 мин; p=0,009). Средняя кровопотеря статистически значимо не различалась в обеих группах (РАФ — 19±2 мл, ЛФ — 23±3,2 мл; p=0,264). Послеоперационные осложнения отмечены у 3 (9%) пациентов в группе РАФ и у 5 (15%) — ЛФ (p=0,450). Длительность пребывания больных в стационаре была меньше в группе РАФ (7,8±0,38 сут против 9,7±0,49 сут; p=0,003).
Заключение. РАФ и ЛФ в модификации А.Ф. Черноусова одинаково безопасны в лечении РЭ на фоне ГПОД. Использование роботизированного хирургического комплекса при кардиофундальных и субтотальных ГПОД позволяет сократить продолжительность операции и время пребывания в стационаре. Необходимо изучение отдаленных результатов РАФ и проведение рандомизированных исследований.
Введение
Грыжи пищеводного отверстия диафрагмы (ГПОД) выявляют у 30—40% взрослого населения США и стран Западной Европы [1]. По данным ряда авто- ров, распространенность ГПОД среди трудоспособного населения России находится на уровне 5—40% и 50—80% у пациентов пожилого возраста [2]. ГПОД играет одну из ключевых ролей в патогенезе рефлюксэзофагита (РЭ), являясь по сути анатомическим субстратом этого заболевания. При этом более чем у 50% людей с ГПОД могут отсутствовать клинические проявления РЭ [3]. Особую значимость проблема ГПОД приобретает в связи с повсеместным ростом распространенности РЭ. По данным современных эпидемиологических исследований (МЭГРЕ, АРИАДНА), распространенность РЭ в крупных городах Российской Федерации составляет 23,6%, причем основным фактором риска является именно ГПОД [4]. Согласно современным рекомендациям, лечение РЭ начинают с изменения образа жизни и медикаментозной терапии [4]. Рефрактерное течение, характеризующееся неэффективностью консервативной терапии в течение 8 нед, констатируют у 40% больных РЭ [3, 5]. У 8—20% пациентов с длительно текущим РЭ на фоне ГПОД могут развиться такие осложнения, как оккультное кровотечение из эрозий пищевода, стриктура пищевода, пищевод Барретта [5]. В этих случаях неэффективность консервативной терапии или развитие осложнений служат показанием к хирургическому лечению. За почти 100-летнюю историю хирургии ГПОД и РЭ было предложено множество хирургических методик [6]. Однако и в настоящее время нет единого мнения о «золотом стандарте» в антирефлюксной хирургии. Тем не менее отечественное и зарубежное хирургические сообщества признают, что большинство антирефлюксных операций должно выполняться при помощи эндовидеохирургических технологий. Лапароскопический метод доказал свою безопасность и эффективность, позволил снизить уровень послеоперационных осложнений и ускорить восстановление пациентов [7]. С момента выполнения первой робот-ассистированной фундопликации (РАФ) по Ниссену в 2001 г. в хирургии ГПОД и РЭ стал активно применяться роботизированный хирургический комплекс (РХК) daVin- ci («Intuitive Surgical Inc.», Саннивейл, Калифорния). Однако вопрос о целесообразности применения РХК в антирефлюксной хирургии остается открытым. По данным публикаций последних лет, технические преимущества РХК могут быть наиболее полезны у пациентов с большими и/или рецидивными ГПОД.
Цель исследования — сравнение непосредствен-ных результатов лапароскопических (ЛФ) и РАФ у пациентов с кардиофундальными и субтотальными ГПОД.
Материал и методы
Пациентов, оперированных при помощи малоинвазивных технологий по поводу кардиофундальных и субтотальных ГПОД и РЭ в клинике Факультетской хирургии им. Н.Н. Бурденко Сеченовского Университета в период с марта 2015 г. по июнь 2021 г., разделили на 2 группы и провели ретроспективный анализ. Основные характеристики, анамнестические данные и клинические симптомы оценивали по данным электронной базы стационарных карт больных. Критерием включения пациентов в исследование было наличие первичной кардио- фундальной или субтотальной ГПОД и отсутствие заболеваний, требующих симультанных хирургических вмешательств. В основную группу больных, которым выполнили РАФ, были включены 32 пациента, среди них кардиофундальные ГПОД были диагностированы у 21 (66%), субтотальные ГПОД — у 11 (34%), при этом в 5 (16%) наблюдениях содержимым грыжевого мешка были не только желудок, но и большой сальник и/или поперечная ободочная кишка. Группу сравнения составили 32 пациента, оперированных в тот же период лапароскопическим доступом. Среди них было 20 (62%) пациентов с кар- диофундальными и 12 (38%) — с субтотальными ГПОД. При статистическом анализе значимых различий по возрасту, гендерным и клиническим характеристикам между пациентами обеих групп выявлено не было (табл. 1).
Таблица 1. Основные клинические характеристики пациентов (n=64)/ Table 1. Major clinical characteristics of the patients (n=64)
| Показатель | РАФ (n=32) | ЛФ (n=32) |
|---|---|---|
| Возраст, годы | 57,2±1,9 | 59,6±1,8 |
| Мужчины/женщины, абс. (%) | 13 (41)/19 (59) | 10 (31)/22 (69) |
| ИМТ, кг/м2 | 29,9±0,71 | 30,5±0,76 |
| Классификация ASA, абс. (%) I II III |
14 (44) 15 (47) 3 (9) |
15 (47) 15 (47) 2 (6) |
| Сопутствующие заболевания, абс. (%) сердечно-сосудистые бронхолегочные желудочно-кишечные эндокринные |
23 (72) 9 (28) 20 (63) 6 (19) |
25 (78) 10 (31) 16 (50) 8 (25) |
| Симптомы, абс. (%) изжога отрыжка воздухом дискомфорт и боль за грудиной срыгивание дисфагия |
20 (63) 16 (50) 17 (53) 19 (59) 8 (25) |
23 (72) 16 (50) 15 (47) 17 (53) 6 (19) |
| Виды ГПОД*, абс. (%) кардиофундальная субтотальная |
21 (66) 11 (34) |
20 (62) 12 (38) |
Примечание. РАФ — робот-ассистированная фундопликация; ЛФ — лапароскопическая фундопликация; ГПОД — грыжа пищеводного отверстия диафрагмы. * — по классификации ГПОД Б.В. Петровского и Н.Н. Каншина (1962).
Техника выполнения хирургического вмешательства в обеих группах принципиально не различалась. После расстановки троакаров (рис. 1) выполняли ревизию органов брюшной полости.
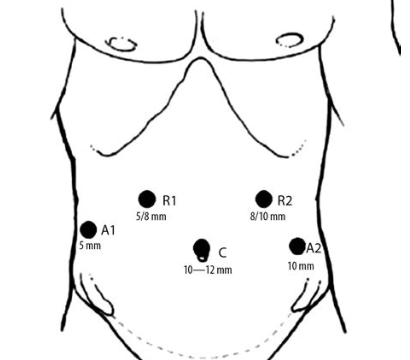 Рис. 1. Схема расстановки троакаров. A1, A2 — ассистентские порты; C — оптический порт; R1, R2 — рабочие порты хирурга/«рук» РХК./ Fig. 1. Trocars positions (scheme). A1, A2 — assistant’s ports; C — camera port; R1, R2 — surgeon ports/«hand’s» ports RSS.
Рис. 1. Схема расстановки троакаров. A1, A2 — ассистентские порты; C — оптический порт; R1, R2 — рабочие порты хирурга/«рук» РХК./ Fig. 1. Trocars positions (scheme). A1, A2 — assistant’s ports; C — camera port; R1, R2 — surgeon ports/«hand’s» ports RSS.
В группе РАФ после ревизии осуществляли докинг консоли пациента РХК. Печень отводили в сторону петлевым ретрактором (5 мм) или рукой No3 РХК. Затем желудок и/или другие органы, находящиеся в грыже- вом мешке, низводили в брюшную полость. После этого при помощи ультразвукового диссектора в заднем средостении выделяли и полностью иссекали грыжевой мешок. Выполняли мобилизацию кардии и дна желудка, начиная с малой кривизны с лигированием двух коротких и задней артерий желудка, при этом стволы блуждающих нервов визуализировали и отводили в сторону. Всем пациентам выполнили фундопликацию в модификации А.Ф. Черноусова: формировали полную (360°) симметричную антирефлюксную манжетку, протяженностью примерно 4 см, на толстом желудочном зонде (55—56 Fr) с обязательной фиксацией ее верхней части к пищеводу в четырех точках. При формировании манжетки использовали отдельные узловые швы (нерассасывающийся плетеный шовный материал 3/0). Заднюю крурорафию выполняли отдельными узловыми швами или непрерывным швом (нерассасывающаяся плетеная или анкерная нить 2/0) до сопоставления ножек диафрагмы, при диаметре пищеводного отверстия диафрагмы (ПОД) >5 см. При диаметре ПОД >10 см заднюю крурорафию дополняли передней, калибруя размер ПОД по диаметру пищевода с запасом в 5 мм. Принципиальной позицией клиники является отказ от установки сетчатых имплантатов в зоне ПОД вне зависимости от типа и размера хиатальной грыжи. Операцию завершали дренированием зоны формирования манжетки и/или трансабдоминальным дренированием заднего средостения. Использовали две рабочие руки РХК, так как применение третьей не давало выраженных технических преимуществ, при этом являясь экономически невыгодным.
Результаты
Операции в обеих группах больных выполняли хирурги, обладающие опытом >50 традиционных и лапароскопических антирефлюксных вмешательств. Ни в одном из наблюдений не было конверсии доступа и/или летального исхода. Заднюю крурорафию выполнили 30 (94%) пациентам в группе РАФ, 10 (31%) из них произвели переднюю крурорафию. При ЛФ заднюю крурорафию провели 29 (91%) больным, дополнили передней — 8 (25%). При анализе непосредственных результатов лечения в обеих группах оценивали продолжительность операции, кровопотерю, интра- и послеоперационные осложнения (Clavien—Dindo), продолжительность пребывания больных в стационаре (табл. 2).
Таблица 2. Непосредственные результаты операций (n=64)/ Table 2. Surgical short-term outcomes (n=64)
| Показатель | РАФ (n=32) | ЛФ (n=32) | p |
|---|---|---|---|
| Время операции, мин | 125±6,6 | 153,2±8 | 0,009 |
| Кровопотеря, мл | 19±2 | 23±3,2 | 0,264 |
| Интраоперационные осложнения, абс. (%) | 3 (9) | 2 (6) | 0,642 |
| Послеоперационные осложнения (Clavien—Dindo), абс. (%) | 1 (3) | 5 (15) | 0,450 |
| I | 0 | 0 | |
| II | 2 (6) | 3 (9) |
|
| IIIa | 1 (3) | 1 (3) | |
| IIIb | - | 1 (3) | |
| Средняя оценка по визуальной аналоговой шкале боли, балл | 4,93±0,1 | 5,01±0,2 | 0,668 |
| Продолжительность пребывания в стационаре, дни | 7,8±0,38 | 9,7±0,49 | 0,003 |
| Повторные операции в течение 30 дней, абс. (%) | 0 | 1 (3) | 0,314 |
Примечание. РАФ — робот-ассистированная фундопликация; ЛФ — лапароскопическая фундопликация.
Средняя продолжительность операции в группе РАФ составила 125±6,6 мин, что было статистически значимо меньше (p=0,009), чем в группе ЛФ — 153,2±8 мин. Стоит отметить, что в группе РАФ не считали время докинга консоли пациента, которое не превышало 10 мин ни в одном из наблюдений. Средний объем кровопотери, который был проанализирован на основании анестезиологических карт, статистически значимо не различался в обеих группах и составил при РАФ 19±2 мл, при ЛФ 23±3,2 мл (p=0,264). В обеих группах отмечены интраоперационные осложнения, однако это не привело к конверсии доступа ни в одном из наблюдений. В ходе РАФ у 1 пациента ретрактором была повреждена капсула печени, у 1 — наблюдалось кровотечение (<50 мл) из короткой желудочной артерии, и еще у 1 — по- вреждение медиастинальной плевры слева. Кровотечения из паренхимы печени и короткой артерии желудка были остановлены при помощи электрокоагуляции и гармонического диссектора; дефект плевры был ушит с последующим дренированием левой плевральной полости. При лапароскопических операциях у 1 больного вследствие электротравмы образовался серозно-мышечный дефект передней стенки желудка, который ушили отдельными узловыми швами; у 1 — отмечено кровотечение из троакарной раны, которое было остановлено при помощи электрокоагуляции. При анализе осложнений в послеоперационном периоде применяли шкалу Clavien—Dindo. В группе РАФ у 1 пациента наблюдали явления умерен- ной дисфагии, еще у 1 — по данным рентгеноскопии был выявлен гастростаз, с которым удалось справиться консервативно в течение одной госпитализации. Кроме того, в группе РАФ у 1 (3%) пациента на 1-е сутки был диагностирован пневмоторакс, потребовавший дренирования плевральной полости. На 3-и сутки после полного расправления легкого и рентгенологического контроля дренаж был удален.
В группе ЛФ у 2 (6%) пациентов наблюдали умеренную дисфагию, у 1 (3%) — в течение 4 сут после операции сохранялся парез кишечника. На фоне консервативных мероприятий, инфузионной и спазмолитической терапии был достигнут положительный эффект. В группе ЛФ у 1 (3%) пациента был также диагностирован пневмоторакс, который потребовал дренирования плевральной полости. Один пациент на 3-и сутки был оперирован повторно в связи с миграцией желудка в заднее средостение и его ущемлением ушитыми ножками диафрагмы (рис. 2, а). В ходе релапароскопии были сняты швы с медиальных ножек диафрагмы позади и кпереди от антирефлюксной манжетки, желудок был низведен в брюшную полость, повторно выполнена задняя и передняя крурорафия (рис. 2, б). Последующий операционный период протекал без особенностей, пациент был выписан домой на 5-е сутки после повторной операции.
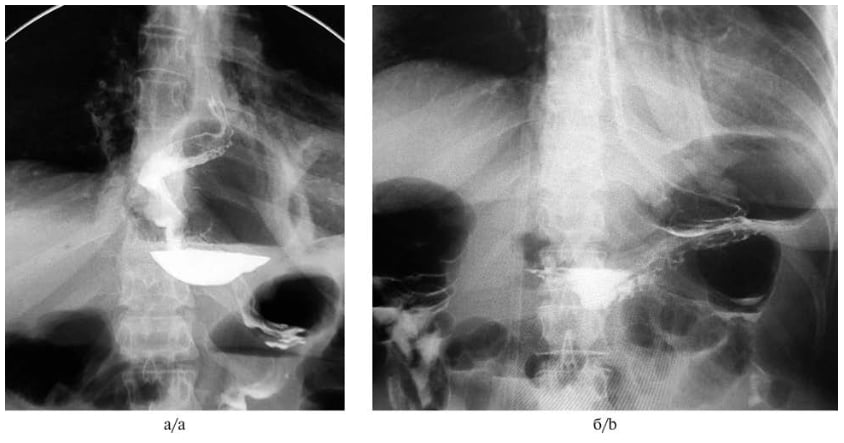 Рис. 2. Рентгенография пищевода и желудка. а — 3-е сутки послеоперационного периода; б — 2-е сутки после повторного хирургического вмешательства. Fig. 2. X-ray examination of esophagus and stomach. a — post-operative day 3; b — post-operative day 2 after relaparoscopy.
Рис. 2. Рентгенография пищевода и желудка. а — 3-е сутки послеоперационного периода; б — 2-е сутки после повторного хирургического вмешательства. Fig. 2. X-ray examination of esophagus and stomach. a — post-operative day 3; b — post-operative day 2 after relaparoscopy.
Таким образом частота развития послеоперационных осложнений, которые потребовали хирургической коррекции (Clavien—Dindo 3a, 3b), статистически значимо не различалась (p=0,555) и составила в группе РАФ 3% (n=1), в группе ЛФ 6% (n=2). Кроме количества и структуры осложнений, в послеоперационном периоде оценивали выраженность боли по визуальной аналоговой шкале (ВАШ). Средняя оценка по ВАШ статистически значимо не различалась (p=0,668) и составила в группе РАФ 4,93±0,1 балла, в группе ЛФ 5,01±0,2 балла. Средняя длительность пребывания больных в стационаре была статистически значимо меньше (p=0,003) в группе РАФ и составила 7,8±0,38 сут, в группе ЛФ — 9,7±0,49 сут.
Обсуждение
При анализе мировой литературы нам удалось найти <20 публикаций, посвященных сравнению результатов робот-ассистированной и лапароскопических операций при ГПОД и РЭ. В большинстве работ при сравнении обеих методик не найдено статистически значимых различий в частоте развития интра- и послеоперационных осложнений, конверсий, длительности пребывания больных в стационаре, часто- те рецидивов. Проанализировав опыт наших коллег, мы исключили из исследования пациентов с кардиальными ГПОД. В одной из первых работ, посвященных сравнению ЛФ и РАФ, W. Melvin и соавт. [8] отмечали безопасность и эффективность РАФ. В сравниваемых группах не было статистически значимых различий по частоте развития периоперационных осложнений, длительности пребывания больных в стационаре, количеству рецидивов, однако продолжительность РАФ была в среднем на 45 мин больше, чем ЛФ. В нашем исследовании средняя длительность РАФ оказалась значительно меньше (p=0,009). Одной из причин этого может быть использование нами РХК более нового поколения, а также ускорение этапов иссечения грыжевого мешка и формирования фундопликационной манжетки. В 2010 г. коллективом авторов во главе с S. Markar [9] был проведен метаанализ, который включил 6 исследований и суммарно 226 пациентов, которым была выполнена как ЛФ, так и РАФ по Ниссену. Статистически значимой разницы по частоте развития интраоперационных осложнений (p=0,202), а также длительности пребывания больных в стационаре (p=0,327) для двух групп выявлено не было. Мы также не выявили статистически значимой разницы по частоте развития интраоперационных осложнений (p=0,450). При этом продолжительность пребывания в стационаре у пациентов именно с кардиофундальными и субтотальными ГПОД оказалась статистически значимо меньше в группе РАФ (p=0,003). Как и в нашей работе, авторы не выявили статистически значимой разницы по частоте развития послеоперационных осложнений (p=0,450 и p=0,902 соответственно).
Стоит отметить, что работы первого десятилетия применения РХК в антирефлюксной хирургии характеризуются небольшим количеством наблюдений — не более 60. Кроме того, авторы включали в исследование пациентов с преимущественно кардиальными ГПОД. В некоторых работах за последние 10 лет сообщается о возможном преимуществе РХК у пациентов с большими и/или рецидивными ГПОД [10, 11]. B. Soliman и соавт. [10] ретроспективно сравнили непосредственные результаты лечения 293 пациентов, при этом у 70% были ГПОД III или IV типа в соответствии с международной классификацией. Авторы выявили снижение частоты развития послеоперационных осложнений при использовании РХК — 6,3% против 19,2% при лапароскопическом доступе (p=0,001) и, как следствие, уменьшение длительности пребывания больных в стационаре (p=0,003). В нашем исследовании продолжительность пребывания пациентов в стационаре также оказалось меньше в группе РАФ (p=0,003). Эти данные подтверждают скорейшее восстановление пациентов после робот-ассистированных операций за счет уменьшения интраоперационной травмы вследствие более прецизионной хирургической тех- ники, которую обеспечивает РХК (трехмерная визуализация операционного поля высокой четкости с десятикратным увеличением и 7 степеней свободы роботических инструментов).
S. O’Connor и соавт. [11] ретроспективно сравнили 2 группы пациентов, сопоставимых по возрасту, индексу массы тела, периоперационному риску и сопутствующим заболеваниям. В одну из них вошли 114 пациентов, которые были оперированы по поводу параэзофагеальной ГПОД (II тип) с применением РХК, при этом у 24,5% пациентов эта операция была повторной. В группу традиционной лапароскопии были включены 278 пациентов, и только 12,9% из них были оперированы ранее. Исследователи не нашли достоверных различий по длительности операции (p=0,681) и частоте развития периоперационных осложнений (p=0,86). Однако при наблюдении в течение 1 года и более частота рентгенологических рецидивов в группе РАФ была достоверно ниже (13,3% против 32,8%; p=0,008). Таким образом, авторы приходят к выводу, что применение роботических технологий у пациентов с параэзофагеальными ГПОД дает технические преимущества по сравнению с традиционной лапароскопией. Улучшенная визуализация, точность движений и прецизионность диссекции, характерные для робот-ассистированных операций, по мнению авторов, играют важную роль при повторных операциях по поводу ГПОД, что отражается в снижении частоты рецидивов. Несмотря на то что в нашу работу не вошли пациенты с рецидивными ГПОД, считаем перспективным применение РХК при повторных операциях, однако необходимы собственные наблюдения и исследования.
И.В. Семенякин и соавт. [12] провели исследование, в которое вошли 363 пациента с различной степенью выраженности РЭ на фоне ГПОД. Всем пациентам выполняли фундопликацию по Ниссену. В 291 случае был выбран лапароскопический доступ, 72 пациента были оперированы с помощью РХК daVinci. По результатам исследования не выявлено преимуществ того или иного доступа. Однако авторы пришли к выводу о целесообразности применения РХК при повторных вмешательствах, с выраженным спаечным процессом, так как четкость и точность работы в 3D-изображении, нивелирование тремора рук хирурга обеспечивают презиционность хирургической техники и минимизируют риск развития интраоперационных осложнений. Некоторые коллеги также отмечают более высокую стоимость робот-ассистированных операций по сравнению с лапароскопическими [8, 9]. В своей работе мы не проводили анализ экономической эффективности РАФ, однако робот-ассистированные операции очевидно дороже лапароскопических, хотя бы исходя из стоимости используемых инструментов. Исследования С.В. Берилавичуса и соавт. [13] на примере робот-ассистированных операций на поджелудочной железе подтверждают наши предположения. Кроме того, мы отказались от стандартного использования третьей руки РХК в пользу петлевого ретрактора для отведения печени, в том числе из экономических соображений, о чем сообщали в предыдущих публикациях [14].
Несмотря на отсутствие статистически значимой разницы по частоте развития послеоперационных осложнений (p=0,450), в группе ЛФ потребовалось больше времени для их коррекции, в том числе для повторной операции. Указанные причины получили отражение в разнице по количеству дней, проведенных в стационаре, между группами. Меньшая продолжительность операции в группе РАФ (p=0,009), вероятнее всего, обусловлена более быстрым выполнением этапа мобилизации грыжевого мешка в группе РАФ за счет преимуществ РХК при работе в ограниченном анатомическом пространстве.
Заключение
Полученные результаты демонстрируют сопоставимую безопасность и эффективность лапароскопических и робот-ассистированных антирефлюксных операций. Роботизированный хирургический комплекс обеспечивает высокую прецизионность манипуляций за счет десятикратно увеличенного 3D-изображения операционного поля, удобство формирования интракорпорального шва, мобилизации желудка и грыжевого мешка в заднем средостении за счет технологии EndoWrist и эргономический комфорт хирурга. Эти преимущества РХК позволяют уменьшить продолжительность операции, а также длительность пребывания в стационаре у пациентов с кардиофундальными и субтотальными грыжами пищеводного отверстия диафрагмы по сравнению с лапароскопическими вмешательствами. Считаем целесообразным проведение сравнительного анализа отдаленных результатов ЛФ и РАФ, в том числе качества жизни больных. Перспективным представляется изучение робот-ассистированных операций у пациентов с рецидивными грыжами пищеводного отверстия диафрагмы.
Участие авторов:
- Концепция и дизайн исследования — Р.Н. Комаров, С.В. Осминин;
- Сбор и обработка материала — Ф.П. Ветшев, С.В. Осминин, И.Р. Билялов;
- Статистическая обработка — С.В. Осминин, И.Р. Билялов;
- Написание текста — С.В. Осминин, И.Р. Билялов;
- Редактирование — Ф.П. Ветшев, А.В. Егоров.
Авторы заявляют об отсутствии конфликта интересов.