Робот-ассистированная пластика лоханочно-мочеточникового сегмента мочеточника у ребенка. Первый опыт
Введение
Использование хирургических роботических систем, несмотря на их высокую стоимость, продолжает набирать популярность в различных хирургических специальностях. В настоящее время разработано и адаптировано для роботизированной хирургии большое количество оперативных вмешательств на органах грудной клетки, брюшной полости и забрюшинного пространства [1]. Широкие возможности роботических инструментов, особенно раскрывающиеся при реконструктивных операциях в условиях малых пространств, предопределяют целесообразность внедрения данной технологии в детскую хирургию. С момента первого сообщения о применении робот-ассистированной хирургической системы у ребенка в 2001 г. [2] большинство оперативных вмешательств, выполняемых лапароскопическим доступом, адаптировано для хирургического робота. Однако роботизированные технологии ввиду высокой стоимости оборудования по-прежнему очень ограниченно используются в педиатрических стационарах [3]. В то же время появление новых хирургических платформ, их постоянное совершенствование и относительное снижение рыночной стоимости, а также описанные успешные результаты роботических операций позволяют утверждать, что это будущее хирургии. В статье описан наш первый опыт выполнения робот-ассистированной пиелоуретеропластики у ребенка с гидронефрозом.
Клинический случай
В отделение детской хирургии Центральной клинической больницы с поликлиникой Управления делами Президента РФ госпитализирован пациент Д. 16 лет с жалобами на учащенные болезненные мочеиспускания, ноющую боль в левой поясничной области. При изучении анамнеза: вышеперечисленные жалобы наблюдались периодически в течение двух лет. При диспансерных обследованиях в раннем детстве урологическая патология не выявлена – общие анализы крови и мочи были в пределах нормы. При проведении ультразвукового исследования (УЗИ) почек выявлено расширение чашечно-лоханочной системы (ЧЛС) левой почки. Для установления причины гидронефроза и определения тактики лечения проведена мультиспиральная компьютерная томография (МСКТ) с болюсным контрастированием: выявлены в артериальную и венозную фазы нижнеполюсные аберрантные сосуды (рис. 1), обнаружено значительное сужение левого мочеточника от уровня лоханочно-мочеточникового сегмента и расширение ЧЛС (в нативную фазу до 25 мм, в отсроченную – до 31 мм, чашечки 7–8 мм). Через 3 часа после введения контраста сохранялось контрастирование расширенной до 38 мм лоханки, мочеточник не визуализировался (рис. 2). Результаты обследования определили необходимость проведения пластики лоханочно-мочеточникового сегмента. С учетом уже имеющегося опыта в роботизированной хирургии у детей (шесть операций фенестрации кист селезенки и удаление кисты диафрагмы) принято решение выполнить это вмешательство с использованием хирургического робота da Vinci SiHD.
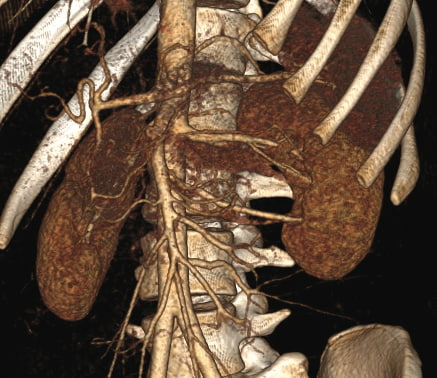 Рис. 1. МСКТ с болюсным контрастированием, артериальная фаза. 3D-реконструкция. Определяется нижнеполюсной аберрантный сосуд
Рис. 1. МСКТ с болюсным контрастированием, артериальная фаза. 3D-реконструкция. Определяется нижнеполюсной аберрантный сосуд
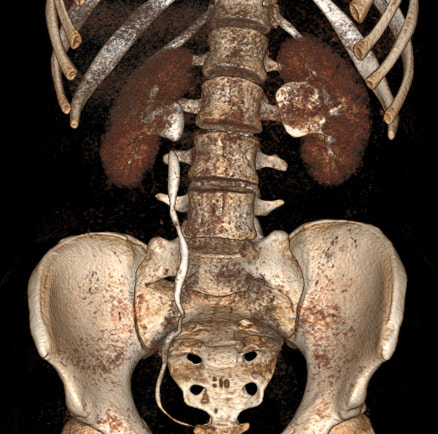 Рис. 2. МСКТ с болюсным контрастированием, через 3 часа после введения контраста. 3D-реконструкция. Расширенная лоханка левой почки, левый мочеточник не визуализируется
Рис. 2. МСКТ с болюсным контрастированием, через 3 часа после введения контраста. 3D-реконструкция. Расширенная лоханка левой почки, левый мочеточник не визуализируется
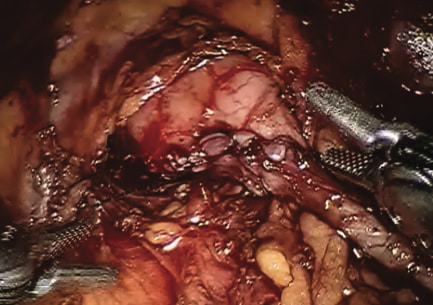 Рис. 3. Окончательный вид пиелоуретерального анастомоза
Рис. 3. Окончательный вид пиелоуретерального анастомоза
Протокол операции: под комбинированным эндотрахеальным наркозом в положении ребенка под углом 45° на правом боку установлен оптический троакар (12 мм) над пупком открытым способом по Хассону. После наложения карбоксиперитонеума с параметрами 14 мм рт. ст. с потоком 19 л/мин установлены рабочие троакары (8 мм) в эпигастральную и левую мезогастральную область. По средней линии на 4 см ниже пупка введен ассистентский порт (5 мм), который использовали для подачи в брюшную полость шовного материала и аспирации. Использовали 30-градусную оптику. Общее время постановки троакаров и стыковки хирургического робота составило 35 минут. Набор роботических инструментов включал в себя диссекторы с моно- и биполярной коагуляцией, ножницы, иглодержатель. После вскрытия париетальной брю- шины и мобилизации ободочной кишки выполнено выделение лоханки и пиелоуретерального сегмента. Лоханка шаровидная до 4 см, в пиелоуретеральном сегменте мочеточник пересекают аберрантные сосуды (артерия и вена) до 4 мм в диаметре. После мобилизации мочеточника проведена резекция (2 см) мочеточника, после чего антевазально наложен пиелоуретеральный анастомоз обвивным швом нитью Монокрил 4/0 (рис. 3). Антеградно, после формирования задней губы анастомоза в лоханку заведен высокий мочеточниковый стент 5 Ch. Кровопотеря не превысила 5 мл. Время роботического этапа операции – 60 минут, общее время анестезиологического пособия – 95 минут.
Послеоперационный период – гладкий. Ребенок выписан на шестые сутки. Гистологическое исследование резецированного мочеточника: мышечная оболочка неравномерной толщины с участками склероза стромы и участками гипертрофии клеток циркулярного слоя. Стент мочеточника удален через месяц при цистоскопии. При контрольных обследованиях через один и через два года – пиелоуретеральный анастомоз проходим, функция обеих почек своевременная, нарушения пассажа мочи нет (рис. 4).
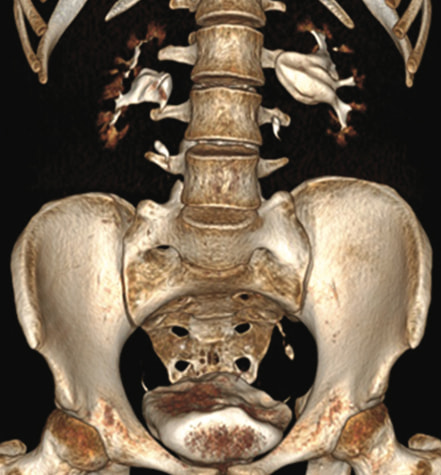 Рис. 4. МСКТ с болюсным контрастированием, через 1 час после введения контраста. 3D-реконструкция. Лоханка левой почки до 25 мм, левый мочеточник до 7 мм в средней трети
Рис. 4. МСКТ с болюсным контрастированием, через 1 час после введения контраста. 3D-реконструкция. Лоханка левой почки до 25 мм, левый мочеточник до 7 мм в средней трети
Обсуждение
В основе нарушения транзита мочи в пиелоуретеральном сегменте лежит структурное и/или функциональное препятствие врожденной или приобретенной этиологии [4]. В педиатрической практике в подавляющем большинстве случаев встречаются врожденные аномалии, заключающиеся в гипоплазии сегмента мочеточника и/или пересечении абер- рантного сосуда и др. [5]. Врожденный гидронефроз диагностируют с частотой 1 : 1500–2000 живорожденных с преобладанием мальчиков. Отсутствие своевременного лечения приводит к стойкому повышению давления в собирательной системе, гидронефрозу и прогрессирующему ухудшению функции почки [6]. Как правило, у новорожденных и младенцев с гидронефрозом обструкция вызвана аперистальтическим сегментом проксимального отдела мочеточника, что приводит к функциональной непроходимости. Гистологическое исследование указывает на гипоплазию циркулярных мышечных волокон мочеточника [6, 7]. Причиной гидронефроза у детей старшего возраста, как и в данном клиническом случае, обычно является внешняя компрессия пересекающим добавочным сосудом нижнего полюса почки, что приводит к механической обструкции мочеточника [5–7].
Исторически сложилось, что классическими проявлениями гидронефроза у детей раннего возраста являлись пальпируемое образование и фебрильная лихорадка, вызванная инфицированием застоявшейся мочи. В настоящее время широкое использование антенатального скринингового УЗИ позволило в большинстве случаев выявить заболевание внутриутробно и определить показания для оперативного лечения до развития инфекционных осложнений. Диагностика гидронефроза у детей старшего возраста и подростков более сложна в связи с отсутствием яркой клиники, патогномоничных симптомов и медленным прогрессированием. Среди настораживающих симптомов необходимо выделить периодические приступы ноющей боли в поясничной области, рецидивирующие мочевые инфекции, гематурию. В некоторых случаях застой мочи способствует образованию конкрементов. В запущенных случаях гипертензия и хроническое воспаление приводят к необратимым изменениям почечной паренхимы, проявляющимся повышением уровня креатинина и артериальной гипертензией [7].
Инструментальная диагностика включает в себя УЗИ, в том числе с диуретической пробой, внутривенную урографию, иногда – микционную урографию для исключения рефлюкса. У детей грудного возраста вышеперечисленных рутинных исследований достаточно для определения показаний к операции. В некоторых случаях выполняют МРТ и сцинтиграфию. Для подтверждения уретеровазального конфликта наиболее информативно проведение МСКТ с внутривенным контрастированием [4, 6]. «Золотым стандартом» лечения гидронефроза является расщепляющая пиелопластика по Хайнсу – Андерсену, эффективность которой доказана многочисленными исследованиями и составляет более 90% [4, 6]. С момента первой лапароскопической пластики пиелоуретерального сегмента у ребенка в 1995 г. [8] открытые операции уступили место лапароскопическим, однако они все еще продолжают применяться в некоторых стационарах [3, 9]. Примерно в это же время появляются первые хирургические роботические системы AESOP. Позже эволюция этих устройств привела к созданию систем Zeus и Da Vinci, а благодаря постоянному повышению их точности и эффективности [1, 7, 8] стало возможным внедрить робототехнику в педиатрическую практику [3, 10]. В 2002 г. была проведена первая роботизированная пиелопластика у ребенка [9], а высокая частота встречаемости гидронефрозов в сочетании с предыдущим опытом лапароскопии в дальнейшем привела к тому, что роботическая пиелопластика стала не только пионером робототехники в педиатрии, но и самой частой выполняемой роботической операцией в детской урологии [3, 8, 10, 11]. К 2015 г. в США на долю роботических пиелопластик уже приходилось около 40% от всех операций по поводу гидронефроза [11, 12].
В настоящее время в ведущих педиатрических хирургических стационарах мира накоплен большой опыт робот-ассистированной пиелопластики, что позволяет сделать начальные выводы об эффективности и безопасности этих операций для пациентов, удобства и кривой обучения для хирурга и экономической эффективности для медицинского учреждения. Так, в метаанализах, проведенных C. Esposito и соавт. в 2017 г. и L. Masieri в 2020 г., сделан однозначный вывод о высокой эффективности этой методики [10, 12]. Точное наложение швов, обеспечиваемое роботизированной платформой благодаря семи степеням свободы, позволяет значительно сократить кривую обучения для хирургов в сравнении с лапароскопическими операциями [1, 7, 8, 10, 12]. Спорным моментом является время операции. Сама роботическая пиелопластика занимает меньше времени в сравнении с лапароскопической, однако подключение робота может значительно увеличивать общее время анестезии. В связи с этим авторы считают, что накопление опыта всей операционной бригады позволяет значительно сократить затраченное на стыковку робота время [10]. Еще один повод для обсуждения – возраст и физические размеры ребенка. В последние годы появились сообщения о применении роботизированной хирургии детям раннего возраста и младенцам [13, 14], однако в большинстве рассмотренных нами публикаций роботизированную хирургию использовали у детей старше 18 месяцев [10]. Несмотря на многие преимущества роботических хирургических систем, распространение их в педиатрической хирургической практике происходит намного медленнее, чем у взрослых. Большинство детских больниц в США к 2015 г. не имели своих хирургических роботов и «одалживали» их во взрослых операционных [3]. Подобная ситуация сейчас наблюдается и в России, где периодически появляются сообщения о роботических операциях детям, однако все они проведены в клиниках, имеющих как взрослые, так и детские стационары [15]. Роботизированная хирургия продолжает совершенствоваться, и в ближайшем будущем мы надеемся увидеть распространение и популярность роботов в детской хирургии, анестезиологии и реаниматологии в России.