Робот-ассистированная дуоденопанкреатэктомия при множественных нейроэндокринных опухолях
Синдром множественной эндокринной неоплазии I типа (МЭН I) является наследственным заболеванием, наследуемым по аутосомно-доминантному типу. Органами-мишенями опухолевого поражения при синдроме МЭН I являются околощитовидные железы, гипофиз, поджелудочная железа (ПЖ), реже – надпочечники, щитовидная железа, двенадцатиперстная кишка (ДПК), яичники, бронхи, вилочковая железа [1]. Выраженность клинических проявлений болезни определяется степенью гормональной активности опухолей. Наиболее часто у больных МЭН I развивается синдром органического гиперинсулинизма, обусловленный инсулиномой ПЖ, или синдром Золлингера–Эллисона при наличии гастриномы ДПК или ПЖ. Синхронная гормональная активность опухолей развивается редко, а сочетанное появление указанных синдромов является казуистикой. Приводим клиническое наблюдение.
Пациентка 42 лет госпитализирована в ФГБУ “Институт хирургии им. А.В. Вишневского” 22.11.2016 с жалобами на слабость, эпизоды потери сознания и головокружения, судорожные припадки, ухудшение памяти и внимания. Считает себя больной с 2007 г., когда отметила эпизоды потери сознания, затрудненного перехода от сна к бодрствованию в утренние часы. Не обследовалась. В это же время была диагностирована язвенная болезнь ДПК. Во время госпитализации в 2014 г. по поводу обострения язвенной болезни выявлена гипогликемия 2,8 ммоль/л, но попыток установить причину гипогликемического состояния предпринято не было.15.01.2016 перенесла удаление нижней доли левого легкого по поводу карциноида (T1N0M0). В апреле 2016 г. госпитализирована в ЦРБ по месту жительства в состоянии гипогликемической комы с уровнем глюкозы плазмы крови 1,4 ммоль/л. После введения раствора глюкозы состояние улучшилось, пациентка была выписана домой. Постоянно принимала блокаторы протонной помпы, без чего следовало обострение язвенной болезни ДПК. При рецидиве комы в июне 2016 г. была госпитализирована в эндокринологическое отделение по месту жительства. При МРТ обнаружена микроаденома гипофиза, а при УЗИ – аденомы паращитовидных желез и опухоль головки ПЖ. Проба с голоданием положительная. Заподозрен синдром МЭН I, органический гиперинсулинизм. Направлена в ФГБУ “Эндокринологический научный центр”, где находи- лась на обследовании с 02.11.2016 по 10.11.2016. Установлено, что уровень инсулина и С-пептида крови был в пределах нормальных значений, уровень гастрина превышал нормальные показатели более чем в 15 раз. При КТ подтверждена опухоль в головке и хвосте ПЖ, выявлены аденомы в левом надпочечнике, по результатам лабораторного обследования – гормонально неактивные. При МРТ головного мозга – эндоселлярная аденома гипофиза 7 мм, по результатам лабораторной диагностики – гормонально неактивная. Зафиксировано повышение уровня па- ратгормона, гиперкальциемия, при сцинтиграфии – аденомы нижней правой и левой верхней паращитовидных желез. Диагностирован синдром МЭН I, органический гиперинсулинизм. За время нахождения в ФГБУ ЭНЦ в связи с перманентной гипогликемией больная нуждалась в постоянном внутривенном введении раствора глюкозы. Направлена в Институт хирургии им. А.В. Вишневского для оперативного лечения. При госпитализации 14.11.2016 состояние было тяжелым, требовалось постоянное внутривенное введение растворов глюкозы в ночное время, без чего больная самостоятельно не просыпалась. Вне гипогликемического состояния сознание ясное. Кожный покров бледно-розовый. Органы дыхания, кровообращения без отклонений от нормы. При ЭГДС отмечена гипертрофия складок слизистой оболочки желудка и рубцовая деформация луковицы ДПК. Выполнена КТ, обнаружены множественные гиперваскулярные опухоли в головке, теле и хвосте ПЖ, стенке ДПК, а также увеличенные, накапливающие контрастное вещество лимфатические узлы задней поджелудочно-двенадцатиперстной группы и вдоль селезеночной артерии (рис. 1, 2). Кроме того, обнаружено увеличение высоты и усиление васкуляризации складок слизистой оболочки тела и дна желудка (косвенные проявления синдрома Золлингера– Эллисона), аденома левого надпочечника. При артериально-стимулированном заборе крови 16.11.2016 подтверждено выделение инсулина и С-пептида в ответ на введение хлористого кальция в бассейн печеночной артерии. Клинический диагноз: “Синд- ром МЭН I; множественные нейроэндокринные опухоли ПЖ; органический гиперинсулинизм; множественные нейроэндокринные опухоли ДПК, синдром Золлингера–Эллисона. Метастазы нейроэндокринных опухолей в лимфатических узлах бассейна чревного ствола; гиперпаратиреоз, аденомы правой нижней и левой верхней паращитовидных желез; гормонально неактивная эндоселлярная аденома гипофиза; гормонально неактивная аденома левого надпочечника. Карциноид левого легкого, состояние после нижней лобэктомии слева 15.01.2016”. Объем поражения требовал выполнения тотальной дуоденопанкреатэктомии, резекции дистального отдела желудка, спленэктомии, лимфаденэктомии в объеме D2. Больная оперирована 23.11.2016 робот-ассистированным способом. При лапароскопии метастатического поражения брюшины не выявлено. Выполнена холецистэктомия. Выделены элементы печеночно-двенадцатиперстной связки, ветви чревного ствола, удалены лимфатические узлы печеночно-двенадцатиперстной связки и вдоль общей печеночной артерии. Клипированы и пересечены желудочно-двенадцатиперстная артерия и общий печеночный проток, диаметр его 3 мм. Создан тоннель под перешейком ПЖ до ее нижнего края. Пересечены желудочно-ободочная и желудочно-селезеночная связки с мобилизацией большой кривизны и фундального отдела желудка, верхнего полюса селезенки. Рассечена париетальная брюшина по верхнему краю ПЖ, частично выделена и превентивно клипирована селезеночная артерия на уровне ее проксимальной трети. Опухоли в ПЖ не видны. Выполнено лапароскопическое УЗИ, при котором подтверждены опухоли в головке и хвосте ПЖ. Рассечена брюшина по нижнему краю железы, завершена тоннелизация под перешейком ПЖ. Мобилизован антральный отдел желудка и частично луковица ДПК. Жировая клетчатка с над- и подпривратниковыми лимфатическими узлами смещена в сторону удаляемого комплекса. Желудок на уровне угла пересечен аппаратом EndoGIA. Верхняя брыжеечная вена циркулярно выделена из клетчатки; клипирован и пересечен ствол Генле. Обнажена верхняя брыжеечная артерия, по ее правому контуру пересечена связка крючковидного отростка с удалением лимфатических узлов вдоль проксимального отдела верхней брыжеечной артерии и клипированием нижней поджелудочно-двенадцатиперстной артерии.
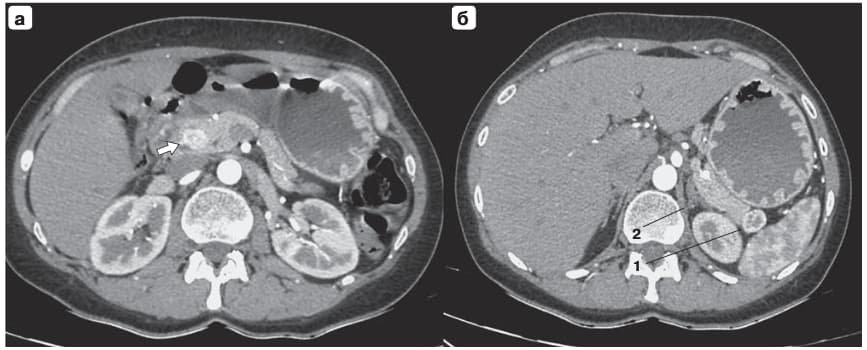 Рис. 1. Компьютерная томограмма. Новообразования ПЖ, артериальная фаза исследования: а – в головке ПЖ округлая гиперваскулярная опухоль 18 × 15 мм (стрелка), прилежащая к общему желчному протоку; б – в хвосте ПЖ округлая гетерогенная опухоль 22 × 18 мм, с выраженным гиперконтрастным контуром (1); на этом же срезе левый надпочечник с резко утолщенными ножками (2).
Рис. 1. Компьютерная томограмма. Новообразования ПЖ, артериальная фаза исследования: а – в головке ПЖ округлая гиперваскулярная опухоль 18 × 15 мм (стрелка), прилежащая к общему желчному протоку; б – в хвосте ПЖ округлая гетерогенная опухоль 22 × 18 мм, с выраженным гиперконтрастным контуром (1); на этом же срезе левый надпочечник с резко утолщенными ножками (2).
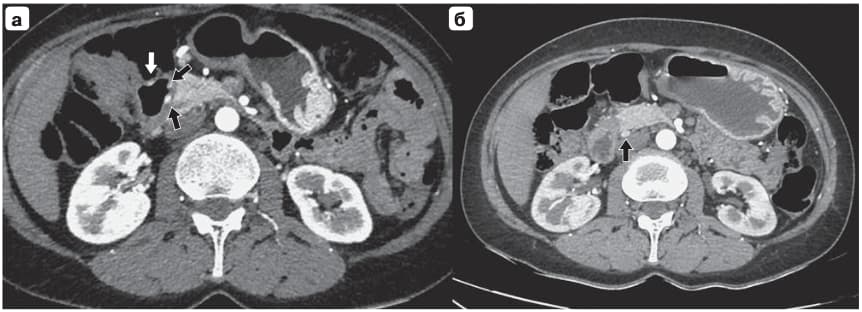 Рис. 2. Компьютерная томограмма. Новообразования ДПК, артериальная фаза: а – гиперваскулярные опухоли в стенке ДПК (стрелки); б – метастаз нейроэндокринной опухоли в лимфатическом узле задней поджелудочно-двенадцатиперстной группы (стрелка).
Рис. 2. Компьютерная томограмма. Новообразования ДПК, артериальная фаза: а – гиперваскулярные опухоли в стенке ДПК (стрелки); б – метастаз нейроэндокринной опухоли в лимфатическом узле задней поджелудочно-двенадцатиперстной группы (стрелка).ДПК и головка ПЖ мобилизованы по Кохеру с удалением фасции Героты и обнажением нижней полой и устья левой почечной вены. Тощая кишка переведена слева направо через сформированное окно под верхними брыжеечными сосудами, пересечена на уровне первой сосудистой аркады аппаратом EndoGIA. ПЖ на уровне перешейка смещена вверх и кпереди, завершено выделение чревного ствола, удаление лимфатических узлов вокруг чревного ствола и обнажение зоны отхождения селезеночной артерии. Последняя дважды клипирована и пересечена, затем выделена селезеночная вена на протяжении 1 см от устья и также пересечена. Тело и хвост ПЖ после пересечения селезеночно-ободочной связки мобилизованы в комплексе с парапанкреатической клетчаткой, лимфатическими узлами вдоль селезеночной артерии и ворот селезенки, фасцией Героты и селезенкой. Комплекс мобилизованных и удаленных органов перемещен под диафрагму влево. Последовательно сформировали интракорпоральный гепатикоеюно-анастомоз обвивным швом нитью 5/0 и гастроеюноанастомоз с использованием аппаратного шва (EndoGIA). Комплекс органов удален из брюшной полости через разрез 7 см, выполненный через зону установки роботического порта (рис. 3). Подпеченочное пространство и ложе селезенки дренированы. Продолжительность операции составила 420 мин, объем кровопотери – 300 мл. К моменту завершения операции сахар плазмы крови составлял 5,8 ммоль/л без введения глюкозы. На протяжении 2 сут после операции больная находилась в отделении интенсивной терапии, поскольку требовалось мониторирование и коррекция уровня глюкозы крови. Затем переведена в хирургическое отделение, определен пищевой рацион и дозировка инсулина с учетом развившегося специфического сахарного диабета. Послеоперационный период протекал без осложнений. Дренажи из брюшной полости удалены на 1-е и 3-и сутки после операции, кожные швы сняты на 7-й день, центральный венозный катетер удален на 8-й день после операции. При контрольной КТ лимфатических узлов с метастатическим поражением не выявлено, исчезла патологическая гипертрофия слизистой желудка (рис. 4). Выписана под наблюдение эндокринолога, онколога и диетолога по месту жительства на 13-е сутки после операции. Рекомендовано генетическое исследование для подтверждения синдрома Вермера, а также наблюдение в ФГБУ ЭНЦ. Проведено гистологическое исследование.
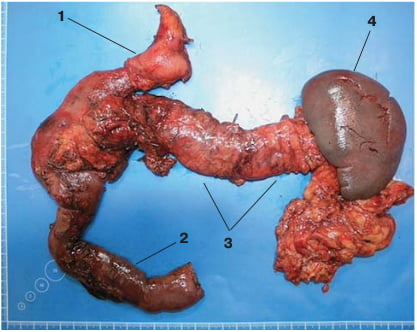 Рис. 3. Макрофото. Удаленный комплекс органов. 1 – культя желудка, 2 – тощая кишка, 3 – ПЖ, 4 – селезенка с селезеночно-ободочной связкой.
Рис. 3. Макрофото. Удаленный комплекс органов. 1 – культя желудка, 2 – тощая кишка, 3 – ПЖ, 4 – селезенка с селезеночно-ободочной связкой.
Желчный пузырь с признаками хронического холецистита в виде склероза и лимфогистиоцитарной инфильтрацией всех слоев стенки. Лимфатические узлы 12-й группы с признаками термического воздействия, без элементов опухоли. В 12 мм от края резекции общего печеночного протока микрофокус билиарной интраэпителиальной неоплазии низкой степени (BilIn-1). В стенке ДПК, в собственной пластинке слизистой и в подслизистом слое 5 опухолей от 2 до 7 мм из мономорфных клеток с округлыми, относительно мономорфными ядрами, со слабо эозинофильной и светлой цитоплазмой, формирующих ацинарные, трабекулярные и розеткоподобные структуры с умеренной лимфоцитарной инфильтрацией и очаговыми кровоизлияниями, разделенные тонки- ми фиброваскулярными тяжами. Количество митозов в 4 опухолях до 1 на 10 РПЗ при увеличении ×400 в каждой; в 1 опухоли, размером 2 мм, митозов не обyаружено. В головке, крючковидном отростке и теле ПЖ 3 опухоли 17, 7 и 2 мм, состоящие из клеток с гиперхромными ядрами, формирующими ацинарные и трабекулярные структуры, местами разделенные между собой широкими прослойками фиброзной, частично гиалинизированной стромы. Опухоль большего размера с множественными участками аутолиза. Рост опухолей в пределах ткани ПЖ. Число митозов в опухолях 17 мм и 7 мм – до 1 на 10 РПЗ при увеличении ×400; в опухоли 2 мм митозов не обнаружено. В области хвоста ПЖ 4 опухоли 17, 7, 2 и 1 мм, по морфологической картине аналогичные образованиям, обнаруженным в ДПК. Число митозов – 1 на 10 РПЗ при увеличении ×400 – обнаружены в 1 опухоли большего размера, в других опухолях митозов не выявлено. Опухоли не прорастают в пара- панкреатическую клетчатку. В 9 из 33 исследованных лимфатических узлов обнаружены метастазы опухоли аналогичного строения с опухолями в стенке ДПК. Ткань селезенки с гиперплазией красной пульпы, опухолевого роста не обнаружено.
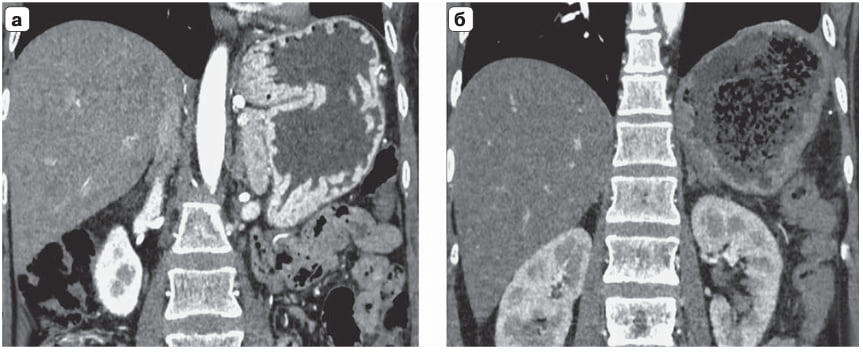 Рис. 4. Компьютерная томограмма. Желудок, артериальная фаза: а – гипертрофированные складки слизистой желудка до операции; б – нормальная складчатость на 9-е сутки после операции.
Рис. 4. Компьютерная томограмма. Желудок, артериальная фаза: а – гипертрофированные складки слизистой желудка до операции; б – нормальная складчатость на 9-е сутки после операции.
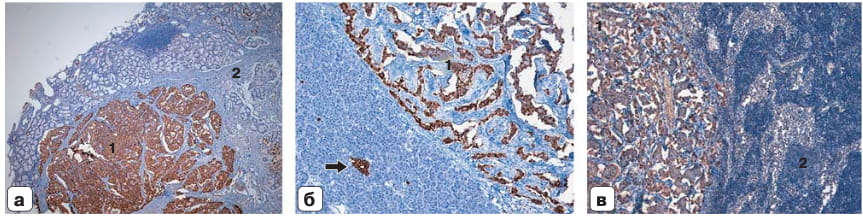 Рис. 5. Микрофото. Иммуногистохимическое исследование: а – гастринома, экспрессия гастрина в клетках нейроэндокринной опухоли (1) подслизистого слоя стенки ДПК (2); ×50; б – инсулинома, экспрессия инсулина в клетках нейроэндокринной опухоли (1) и в островке Лангерганса ткани ПЖ (стрелка); ×100; в – лимфатический узел с метастазом гастриномы, экспрессия гастрина (1) в клетках метастаза нейроэндокринной опухоли, лимфоидная ткань (2); ×100.
Рис. 5. Микрофото. Иммуногистохимическое исследование: а – гастринома, экспрессия гастрина в клетках нейроэндокринной опухоли (1) подслизистого слоя стенки ДПК (2); ×50; б – инсулинома, экспрессия инсулина в клетках нейроэндокринной опухоли (1) и в островке Лангерганса ткани ПЖ (стрелка); ×100; в – лимфатический узел с метастазом гастриномы, экспрессия гастрина (1) в клетках метастаза нейроэндокринной опухоли, лимфоидная ткань (2); ×100.
 Рис. 6. Электронное микрофото: а – опухолевая клетка со специфическими нейросекреторными гастринпродуцирующими гранулами (стрелки); б – опухолевая инсулинсодержащая клетка со специфическими нейросекреторными гранулами; ×14000.
Рис. 6. Электронное микрофото: а – опухолевая клетка со специфическими нейросекреторными гастринпродуцирующими гранулами (стрелки); б – опухолевая инсулинсодержащая клетка со специфическими нейросекреторными гранулами; ×14000.
При иммуногисто-химическом исследовании (рис. 5) 3 из 5 опухолей ДПК являлись высокодифференцированными, 2 – умеренно дифференцированными, при этом 4 опухоли были гастринпродуцирующими, 1 опухоль – нефункционирующая. В ПЖ было 7 высокодифференцированных опухолей, из них 5 нефункционирующих, 2 – инсулинпродуцирующие. В 9 лимфатических узлах подтверждены метастазы гастриномы (2 лимфоузла) и метастазы нефункционирующих опухолей (7 лимфоузлов). Таким образом, удалено 12 опухолей, 7 из которых являлись гормонпродуцирующими, источником метастазирования были гастриномы и нефункционирующие опухоли. При электронной микроскопии (рис. 6) в гастриномах множество округлых гранул размером 150–200 нм c эксцентрически расположенной электронно-плотной сердцевиной. В цитоплазме клеток выявлены свободные рибосомы и полисомы, гранулярная цитоплазматическая сеть была представлена отдельными короткими профилями, митохондрии крупные с нарушенной ориентацией крист. В инсулиномах цитоплазма клеток умеренно плотная, содержала многочисленные специфические гранулы инсулина в среднем 300 ± 50 нм в диаметре. Электронно-плотные гранулы имели округлую форму, были окружены пограничной мембраной, что соответствовало незрелым гранулам, содержащим проинсулин.
Обсуждение
Синдром МЭН I описал P. Wermer в 1954 г. [2]. При этом заболевании инсулиномы выявляют у 23–29% больных, гастриномы – у 40% [3]. Синхронное развитие синдромов гипогликемии и Золлингера–Эллисона встречается крайне редко. При литературном поиске удалось обнаружить описание 8 наблюдений такого варианта течения синдрома МЭН I. Впервые сочетание инсулин- и гастринпродуцирующих опухолей описали S. Murakami и соавт. в 1995 г. [4]. Авторы сообщали о пациенте 55 лет с аденомой гипофиза, гиперпаратиреозом, гастриномой, инсулиномой головки ПЖ и постбульбарными дуоденальными язвами. Первым этапом выполнили резекцию паращитовидных желез. Спустя месяц осуществили гастрэктомию по поводу язвы желудка. Попыток удаления гастринпродуцирующей опухоли не предпринимали, инсулинома в головке ПЖ также не была удалена. В послеоперационном периоде для устранения гипогликемии постоянно внутривенно вводили раствор глюкозы. Смерть больного наступила через 3 мес после операции. В дальнейшем были описаны 2 больных с синдромом МЭН I, у которых проявления гипогликемии и язвенной болезни ДПК развились с интервалом 3 и 4 мес [5, 6]. Имеется наблюдение больной 67 лет с нерезектабельной аденокарциномой ПЖ, инсулиномой тела и хвоста ПЖ и топически не верифицированной гастриномой. Больная прожила 7 лет. При посмертном гистологическом и иммуногистохимическом исследованиях подтверждена протковая аденокарцинома, инсулинома и гастрино- ма в ПЖ [7]. Единственным наблюдением явилось описание больной 18 лет с синдромами гипогликемии и Золлингера–Эллисона, у кото- рой была удалена нейроэндокринная опухоль головки ПЖ 15 мм, продуцировавшая как гастрин, так и инсулин [8]. Описанная нами пациентка, исходя из анамнеза и косвенных, но объективных проявлений болезни, страдала клиническим синдромом МЭН I, который был диагностирован лишь к исходу 9-го года болезни. У больной имелась не поддающаяся объяснению ситуация, заключавшаяся в наличии тяжелой гипогликемии при нормальном содержании инсулина плазмы крови и благоприятном течении язвенной болезни ДПК при пятнадцатикратном повышении уровня гастрина. Наличие множественных гормонально активных опухолей ДПК и ПЖ с метастатическим поражением регионарных лимфатических узлов исключало возможность выполнения органосохраняющей операции. Одномоментное радикальное хирургическое вмешательство по поводу инсулином и гастрином, выполненное робот-ассистированным способом, в литературе не описано. Множественность поражения эндокринных органов и наличие метастатического поражения лимфатических узлов не позволяют сделать оптимистический прогноз заболевания. Больная нуждается в генетическом исследовании для подтверждения синдрома МЭН I и постоянном наблюдении эндокринолога, онколога, диетолога.