Пятилетний опыт лечения рака предстательной железы на «da Vinci».
Введение
В 2001 г. французский уролог C.C. Abbou впервые в мире выполнил робот-ассистированную радикальную простатэктомию (РАРП)1. Сегодня в мире установлено 3 660 роботизированных систем «da Vinci», из которых 25 – в России. Общее число выполненных роботических вмешательств в мире к концу 2015 г. превысило 650 тыс, причем количественный прирост составил 14% относительно уровня 2014 г., и в 2016 г. динамика роста сохраняется2. Первый робот «Da Vinci» был установлен в России в 2007 г. На конец 2015 г. российскими специалистами было выполнено 4 895 операций, из которых 27% – в 2015 г. Большинство вмешательств были урологические – 880 операций, из которых 80% пришлось на РАРП3.
Робот-ассистированная хирургия в наше время становится серьезной альтернативой открытому и лапароскопическому способам хирургического лечения рака предстательной железы (РПЖ), т. к. не только обеспечивает сопоставимые с ними онкологические результаты, но и позволяет достичь лучшего восстановления функции мочеиспускания и эректильной функции, что было продемонстрировано во множестве исследований4-6. Первые результаты РАРП в России были представлены в конце 2000-х гг.7-8. Целью нашей работы являлся анализ периоперационных результатов собственной серии из 257 РАРП, выполненных по поводу РПЖ, и оценка эффективности техники робот-ассистированных вмешательств.
Пациенты
В период с 2010 до 2016 г. на базе СЗФМИЦ им. В.А. Алмазова в Санкт-Петербурге нами было выполнено 257 РАРП пациентам 48–78 лет, страдающим РПЖ стадии T1–T3aN0M0. Объем предстательной железы составлял от 11,5 до 155 см3, уровень общего простатспецифического антигена (ПСА) сыворотки крови – от 3,1 до 120 нг/мл. Диагноз аденокарциномы предстательной железы (сумма баллов по Глисону 4–9) у всех больных был установлен на основании результатов мультифокальной биопсии простаты.
В настоящее исследование не были включены пациенты с тяжелой сопутствующей сердечно- сосудистой патологией (инфаркт миокарда, аорто-коронарное шунтирование, стентирование коронарных артерий в анамнезе), после вмешательств на предстательной железе (после трансуретральной резекции простаты, брахитерапии), обширных вмешательств на брюшной полости, неоадъювантной гормональной терапии, а также первые 25 пациентов, которые составляли «кривую обучения». С учетом критериев исключения, для дальнейшего анализа были отобраны 142 пациента.
Все операции выполнялись под эндотрахеальным наркозом в положении Тренделенбурга из трансперитонеального доступа. Первым этапом в брюшную полость пациентов устанавливались троакары: по нижнему или верхнему краю пупка устанавливался 12-мм порт для бинокулярного лапароскопа, по дуге полуокружности, образованной передними верхними остями подвздошных костей и пупком, устанавливались три 8-мм порта для роботических инструментов и один 12-мм ассистентский порт. Затем выполнялась антеградная радикальная простатэктомия по стандартной методике, описанной P. Walsh9, и по модицифированной нами методике с сохранением, реконструкцией и усилением перипростатических анатомических структур малого таза: тазовой фасции, пубопростатических связок, ректоуретральных мышц, уретры (рисунок). Пациентам с сохранной эректильной функцией производилась нервосберегающая РАРП с полным или частичным сохранением сосудисто-нервного пучка. Для интраоперационного гемостаза использовались клипсы «Hem-o-lok», нити «Викрил». Перевязка дорзального сосудистого пучка и наложение пузырно-уретрального анастомоза осуществлялись с помощью шовного материала «V-loc». Удаленная простата извлекалась через отверстие оптического 12-мм порта.
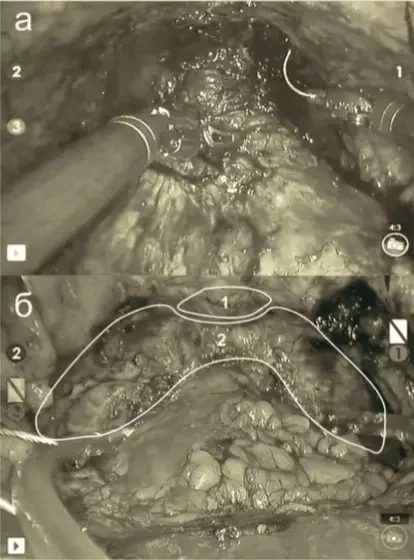 Рисунок. а – вход в малый таз после выполнения уретроцистонеоанастомоза при стандартной антеградной технике выполнения РАРП; б – вход в малый таз после выполнения уретроцистонеоанастомоза по модифицированной технике РАРП: 1 – сохраненные пубопростатические связки, 2 – сохраненная тазовая фасция.
Рисунок. а – вход в малый таз после выполнения уретроцистонеоанастомоза при стандартной антеградной технике выполнения РАРП; б – вход в малый таз после выполнения уретроцистонеоанастомоза по модифицированной технике РАРП: 1 – сохраненные пубопростатические связки, 2 – сохраненная тазовая фасция.Оценивались время операции, объем кровопотери, частота конверсий, интраоперационных осложнений, послеоперационных осложнений по шкале Clavien–Dindo10, длительность нахождения в стационаре, патологоанатомическая стадия опухоли по TNM, показатели опухоль-специфической и общей выживаемости больных, частота восстановления удержания мочи и эректильной функции после операции. Комплексная оценка результатов хирургического лечения осуществлялась на основании частоты достижения «трифекты» или «пентафекты». Достижение «трифекты» означало удаление опухоли (ПСА < 0,2 нг/мл), сохранение континенции и сохранение эректильной функции [6]. «Пентафекта» считалась достигнутой у пациента, когда, помимо «трифекты», было обеспечено отсутствие периоперационных осложнений и отрицательный хирургический край11.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ Microsoft Excel 2007 («Microsoft Corporation», США). Результаты представлены в виде среднего арифметического±стандартное отклонение. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
Результаты
Время РАРП составило в среднем 170±50 мин, объем кровопотери – 130±35 мл. Конверсий не было, частота интраоперационных осложнений составила 2,1%. Интраоперационные осложнения были представлены ранением правой подвздошной артерии и двумя ранениями стенки мочевого пузыря, дефекты которых были ушиты интракорпорально. Переливание компонентов крови потребовалось одному пациенту. Частота послеоперационных осложнений Clavien I–II составила 21%, Clavien III – 3,5%. Осложнений Clavien IV–V не было. Послеоперационные осложнения включали один случай лимфореи, три эпизода острой задержки мочи, по одному случаю тампонады мочевого пузыря, кишечной непроходимости, образования пузырно-прямокишечного свища, миграции клипсы Hem-o-Lok в мочевой пузырь. Средний койко-день составил 12,0±4,2 дня. Уретральный катетер удаляли на 7–8-е сутки. Спустя 1 мес после удаления катетера мочу удерживали 91% пациентов, а спустя 1 год – 98,6% пациентов. В течение 1 месяца эрекция восстановилась у 72% больных, к концу года – у 92% от общего числа всех больных с исходно сохранной эректильной функцией, которым была выполнена нервосберегающая РАРП. Частота положительного хирургического края составила 14%. Спустя 12 мес «трифекта» была достигнута у 87%, «пентафекта» – у 52% пациентов. Пятилетняя безрецидивная выживаемость составила 94%, опухоль-специфическая и общая выживаемость – соответственно 100 и 97,5%.
Обсуждение
Робот является продолжением руки хирурга. Он не выполняет движений сам, но его движения полностью подчинены руке хирурга. Отсутствие естественного тремора рук хирурга, которое обеспечивает робот, вкупе с 3D-изображением, 10-кратным увеличением и непревзойденной свободой движений инструментов – все это обеспечивает не только низкую частоту интраоперационных осложнений, но и позволяет справиться с ними без конверсии. Осложнения послеоперационного периода у большинства пациентов были представлены группами I–II Clavien, требующими консервативной терапии. Стандартная оценка восстановления континенции и эрекции осуществляется спустя 12 мес. после операции. Под термином «удержание мочи» мы подразумеваем отсутствие необходимости в использовании страховочной прокладки или использование одной страховочной прокладки4,6. Высокие показатели раннего (в течение 1 мес.) восстановления удержания мочи мы связываем с особенностями применяемой нами модифицированной техники РАРП. Полученные нами результаты РАРП по основным операционным показателям, показателям «трифекты» и «пентафекты» оказались сопоставимыми с данными зарубежных и отечественных экспертных урологических центров12,13.
Заключение
РАРП выполняют сегодня в России наравне с открытой и лапароскопической простатэктомией. Благодаря возможностям, заложенным в роботическую систему «Da Vinci», мы можем обеспечить сохранение, реконструкцию и усиление всех анатомических структур, участвующих в механизме континенции для ее раннего восстановления. Достижение «трифекты» и «пентафекты» должно стать целью и критерием оценки качества выполненной радикальной простатэктомии. Совершенствование техники РАРП является перспективным направлением для достижения раннего восстановления континенции у больных РПЖ.









