Первичные результаты аорто-бедренного шунтирования с применением робот-ассистированной хирургической системы da Vinci
Введение
Аортофеморальное шунтирование является стандартным методом реваскуляризации при окклюзирующих заболеваниях нижних конечностей. Традиционный открытый метод протезирования аорты достаточно надежен и обеспечивает длительный эффект, однако сопряжен с высокими интраоперационными рисками и летальностью 1. Эндоваскулярные методы в данном аспекте менее опасны, но не всегда имеют длительный стойкий эффект и часто неэффективны при протяженных участках окклюзии 2. Лапароскопические реконструктивные вмешательства не нашли широкого распространения главным образом из-за технических трудностей, связанных с использованием лапароскопической аппаратуры 3-4. Роботическая хирургия — одна из самых востребованных и динамически развивающихся областей медицины, широко используемая в урологии, онкологии, проктологии, гинекологии, торакальной и сердечно-сосудистой хирургии. Первые операции на аорто-подвздошном сегменте с использованием роботической хирургии произведены около 10 лет назад 5, в России первая операция аортобифеморального шунтирования произведена в ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (г. Новосибирск) в 2016 году 6. В феврале 2018 года состоялось открытие первого роботического центра хирургии в Приволжском федеральном округе на базе Клиники Башкирского государственного медицинского университета (г. Уфа). В настоящей работе представлен первый опыт успешных робот-ассистированных сосудистых операций в рамках мастер-класса «Проведение аорто-бедренного шунтирования с применением робот-ассистированной хирургической системы Da Vinci».
Клинический случай № 1
Пациент К., 56 лет
Диагноз: Атеросклероз. Синдром Лериша. Стеноз терминального отдела аорты, окклюзия подвздошных артерий справа, стеноз слева. Окклюзия левой бедренной артерии. Хроническая артериальная недостаточность 3-й степени.
Сопутствующий диагноз: ИБС. Стенокардия напряжения ФК 3. Гипертоническая болезнь 3-й стадии, 3-й степени, риск осложнений 4.
Проведена стандартная предоперационная подготовка, заключавшаяся в общеклиническом обследовании, КТ-ангиографии (рис. 1), коррекции терапии сопутствующих заболеваний и очистке кишечника при помощи солевых слабительных.
Операция (13.02.2018): В условиях комбинированной общей и продленной перидуральной анестезии в положении больного на правом боку проекционным доступом в паху выделена общая беденная артерия и ее бифуркация с обеих сторон. Далее после наложения пневмоперитонеума по среднеключичной линии установлены порт роботической камеры и порты манипуляторов. По передней подмышечной линии установлены 3 ассистентских порта.
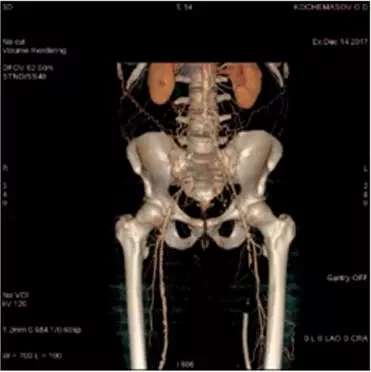 Рисунок 1. КТ-ангиография брюшной аорты и подвздошных артерий пациента К.
Рисунок 1. КТ-ангиография брюшной аорты и подвздошных артерий пациента К.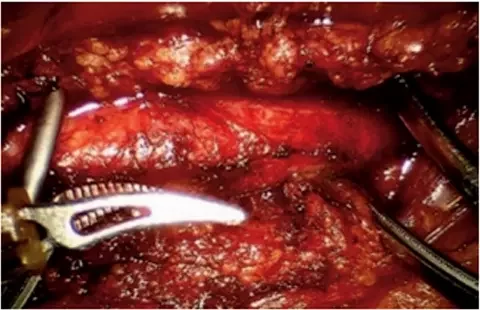 Рисунок 2. Мобилизованная инфраренальная аорта
Рисунок 2. Мобилизованная инфраренальная аорта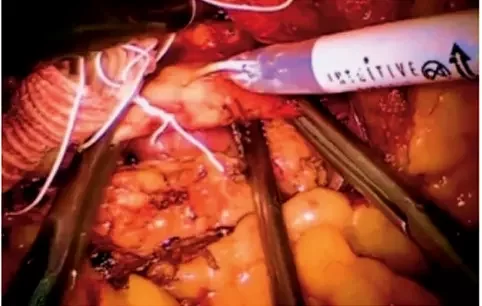 Рисунок 3. Наложены проксимальный и дистальный зажимы на аорту. Продольная аортотомия
Рисунок 3. Наложены проксимальный и дистальный зажимы на аорту. Продольная аортотомияПосле отведения тонкого кишечника вправо мобилизован дуоденоеюнальный изгиб кишечника и выделена инфраренальная аорта от уровня левой почечной артерии до нижней брыжеечной артерии (рис. 2). Поясничные артерии клипированы. Через порт в брюшную полость введен вязаный бифуркационный сосудистый протез 14 х 7 х 7 мм, бранши выведены в раны в паху. Наложены зажимы на аорту дистальнее почечных артерий и проксимальнее нижней брыжеечной артерии. Произведена продольная аортотомия (рис. 3). Атероматозные массы по краю аортотомии удалены. Наложен анастомоз протеза с аортой непрерывным обвивным швом нитью из политетрафторэтилена 4-0 по типу конец-в-бок (рис. 4). Зажимы с аорты сняты (рис. 5). Общее время пережатия аорты составило 23 минуты. Далее произведено ушивание париетального листка брюшины над аортой. Наложены проксимальные анастомозы браншей протеза с бифуркацией общей бедренной артерии с обеих сторон. Кровоток восстановлен. Произведено дренирование брюшной полости и ран в паху. Послойное ушивание ран. Кровопотеря составила 150 мл.
Результат: Общая продолжительность операции составила 3 часа 20 минут. Пациент был экстубирован через 15 минут на операционном столе, переведен в отделение реанимации, где находился 20 часов после операции, обезболивание проводилось только по перидуральному катетеру наропином. Через 3 часа после операции пациенту разрешен прием жидкости, через 12 часов — прием твердой пищи. Дренажи удалены через 20 часов после операции. Вертикализирован через 20 часов после операции. Самостоятельный стул через 1 сутки после операции. Выписан из отделения сердечно-сосудистой и рентген-хирургии в удовлетворительном состоянии на долечивание в отделение медицинской реабилитации через 5 суток после операции.
Клинический случай № 2
Пациент Ш., 61 год
Диагноз: Атеросклероз. Синдром Лериша. Окклюзия правой подвздошной артерии, левой общей бедренной артерии (рис. 6). Хроническая артериальная недостаточность 3-й степени.
Сопутствующий диагноз: Протезированный митральный клапан (2013). Ожирение 3-й степени (ИМТ 35).
Предоперационная подготовка и ход операции (13.02.2018) аналогичен предыдущей, проведено линейное аорто-бедренное шунтирование справа вязаным протезом 8 мм (уровень наложения проксимального анастомоза аналогичен) и тромбэндартерэктомия из общей бедренной артерии слева с пластикой ксеноперикардиальной заплатой. Кровопотеря 200 мл.
Результат: Продолжительность операции составила 3 часа 40 минут. Пациент был экстубирован через 20 минут на операционном столе, переведен в отделение реанимации, где находился 16 часов после операции, обезболивание проводилось только по перидуральному катетеру наропином.
 Рисунок 4. Наложение анастомоза
Рисунок 4. Наложение анастомоза Рисунок 5. Окончательный вид анастомоза после снятия зажимов с аорты
Рисунок 5. Окончательный вид анастомоза после снятия зажимов с аорты Рисунок 6. КТ-ангиография брюшной аорты и подвздошных артерий пациента Ш.
Рисунок 6. КТ-ангиография брюшной аорты и подвздошных артерий пациента Ш.Через 3 часа после операции пациенту разрешен прием жидкости, через 12 часов — прием твердой пищи. Дренажи удалены через 20 часов после операции. Вертикализирован через 20 часов после операции. Самостоятельный стул через 1 сутки после операции. Выписан из отделения сердечно-сосудистой и рентген-хирургии в удовлетворительном состоянии на долечивание в отделение медицинской реабилитации через 5 суток после операции.
Клинический случай № 3
Пациент А., 51 год
Диагноз: Атеросклероз. Посттромботическая окклюзия передней и задней тибиальных артерий с обеих сторон. Хроническая артериальная недостаточность 4-й степени левой нижней конечности.
Осложнение: Трофическая язва тыла левой стопы (1 см).У пациента имеется дистальная форма окклюзионного поражения артерий нижних конечностей и отсутствуют условия как для открытых, так и для эндоваскулярных методов реваскуляризации (рис. 7). Ввиду выраженного болевого синдрома пациент обезболивался нестероидными противовоспалительными препаратами и трамадолом. Операцией отчаяния в подобных случаях является поясничная симпатэктомия. Для удаления ганглиев применяются как экстра-, так и трансбрюшинные, как открытые, так и видеоэндоскопические доступы. В настоящее время показания к подобным операциям резко снижены и операция показана только молодым пациентам, у которых сохранена реактивность сосудов, что подтверждается пробами с новокаиновой блокадой или фармакологическими пробами (ксантинолникотинат, нитроглицерин, вазапростан и другие) 7. У данного пациента отмечен хороший терапевтический эффект при внутривенном капельном введении вазапростана 20 мкг/сут.
Проведена стандартная предоперационная подготовка, заключавшаяся в общеклиническом обследовании, коррекции терапии сопутствующих заболеваний и очистке кишечника при помощи солевых слабительных.
Операция (27.02.2018): В условиях общей анестезии в положении больного на правом боку с валиком на уровне пупка после наложения пневмоперитонеума установлен порт для камеры на среднеключичной линии на уровне пупка и два порта для манипуляторов по передней подмышечной линии. Вскрыта париетальная брюшина и произведена мобилизация нисходящей ободочной кишки от селезеночного угла до сигмовидной кишки, нисходящая ободочная кишка отведена медиально, париетальная брюшина отслоена вдоль поперечной фасции, выделена m. iliopsoas до тел позвонков и обнажены симпатические ганглии (рис. 8). Произведено удаление III–IV поясничных ганглиев. Дренирование брюшной полости. Швы на раны. Кровопотеря 50 мл.
Результат: Общая продолжительность операции составила 1 час 20 минут. Пациент был экстубирован через 15 минут на операционном столе, переведен в отделение сердечно-сосудистой и рентген-хирургии. Через 3 часа после операции пациенту разрешен прием жидкости и пищи. Дренаж удален через 12 часов после операции, и пациент вертикализирован. Самостоятельный стул через 18 часов. Уже в раннем послеоперационном периоде (через 2 часа) пациент отмечает потепление конечности, боли в покое прошли, потребности в анальгетиках уменьшились, трамадол назначался только в первые сутки после операции. Трофическая язва на стопе очистилась, активно гранулирует, началась краевая эпителизация. В удовлетворительном состоянии пациент выписан на 6-е сутки на амбулаторное долечивание по месту жительства.
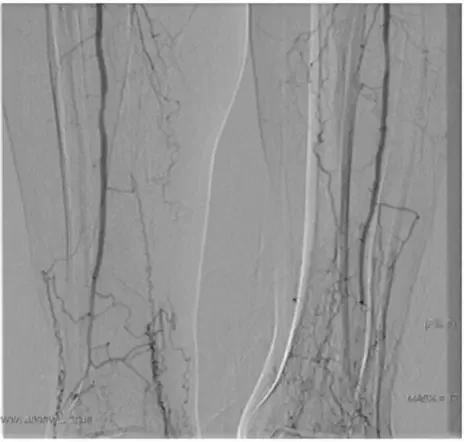 Рисунок 7. Ангиография пациента Ш.
Рисунок 7. Ангиография пациента Ш.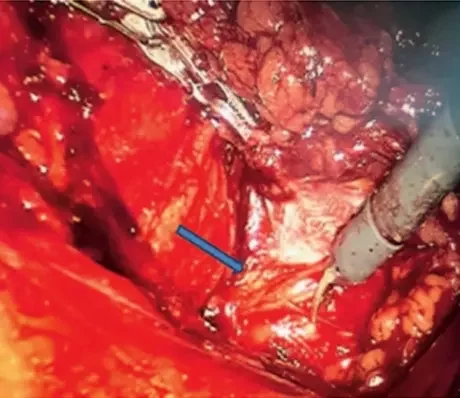 Рисунок 8. Поясничный ганглий (указан стрелкой)
Рисунок 8. Поясничный ганглий (указан стрелкой)Обсуждение
Общепризнанной тенденцией в хирургии является разработка и внедрение малоинвазивных операционных техник. В сосудистой хирургии традиционно основное внимание было направлено на эндоваскулярные методы реваскуляризации и протезирования малопротяженных участков пораженной аорты 2. Однако в нескольких центрах были апробированы и лапароскопические методики реконструкции при поражении аортоподвздошных сегментов 7-8, но технические трудности, связанные с этими процедурами, и отсутствие навыков лапароскопической хирургии у сосудистых хирургов 9 препятствуют их широкому распространению. В этом плане интересными представляются работы S. Bruls и др. 3-4, где впервые рутинно внедрена лапароскопия как при атеросклеротическом поражении, так и при аневризмах брюшного отдела аорты.
В связи с техническими трудностями формирования анастомоза «аорта — протез» классическими лапароскопическими инструментами ряд исследователей объединили лапароскопическую резекцию аорты с мануальным формированием сосудистого анастомоза.
A.Q. Howard и др. 7 описали технику протезирования брюшного отдела аорты сочетанием лапароскопической резекции с мини-лапаротомией (10 см) для наложения анастомоза. R. Kolvenbach и Da Silva независимо друг от друга предложили мануально-ассистированный метод операций на аорте, при котором резекция выполняется лапароскопически, но одна рука хирурга находится в брюшной полости для ассистирования при наложении сосудистого анастомоза, в то время как пневмоперитонеум поддерживается использованием специализированного герметичного рукава 10-11.
В апробированной и внедренной в Клинике Башкирского государственного медицинского университета роботизированной хирургической системе Da Vinci реализованы технические решения, необходимые для заключительного этапа реконструкции аорты, и, таким образом, устраняется необходимость в дополнительном абдоминальном или забрюшинном доступе 12.
Наиболее важным достижением является семь степеней свободы движения хирургических инструментов, полностью имитирующих объем движений человеческого запястья. Традиционные лапароскопические инструменты имеют только четыре степени свободы, что ограничивает их маневренность 13. Помимо этого, вид оперативного поля, предоставляемого роботизированной системой, является трехмерным, в отличие от двумерного изображения, обеспечиваемого лапароскопическими мониторами 14. Однако ограничения на проведение операции с использованием роботизированной системы все еще существуют, самым главным из которых является отсутствие обратной тактильной связи. На первых этапах освоения данной техники это может приводить к повреждению ткани и, как следствие, несостоятельности анастомозов. Однако по мере улучшения хирургических навыков происходит компенсация отсутствия обратной тактильной связи пространственным трехмерным представлением 15.
Приведенные клинические случаи собственного опыта робот-ассистированных операций в сосудистой хирургии показали хорошие ближайшие результаты в сочетании с минимальной травматичностью, позволяющие сократить длительность пребывания пациентов в отделении интенсивной терапии и стационаре.
Несмотря на относительно небольшое количество медицинских центров, где имеется возможность использовать хирургическую систему Da Vinci, авторы отмечают аналогичные положительные ранние и благоприятные отсроченные результаты для сосудистых 16-17 и кардиохирургических операций 18.
Заключение
Робот-ассистированная хирургическая система Da Vinci, являясь самой совершенной в области эндоскопической хирургии, позволяет проводить оперативное вмешательство с минимальной кровопотерей и травматизацией тканей, что способствует сокращению послеоперационного и восстановительного периодов.




