Модифицированная робот-ассистированная YV-пластика при рецидивном стенозе шейки мочевого пузыря. Первые результаты
Аннотация
Введение. Стеноз шейки мочевого пузыря (СШМП) является одним из наиболее грозных и плохо поддающихся коррекции осложнений трансуретральных хирургических вмешательств на предстательной железе (ПЖ). Несмотря на значительный прогресс в эндоурологии и обилие новых технологических решений, применяемых в трансуретральной хирургии, результаты эндоскопической коррекции СШМП все еще остаются неудовлетворительными. Одним из методов коррекции рецидивирующего СШМП является робот-ассистированная YV-пластика шейки мочевого пузыря.
Материалы и методы. С 2021 по 2022 гг. в СПб ГБУЗ «Клиническая больница Святителя Луки» выполнено 30 робот-ассистированных модифицированных YV-пластик шейки мочевого пузыря у пациентов с рецидивными стенозами шейки мочевого пузыря.
Результаты. Всем пациентам оперативное лечение проводилось по описанной ниже методике. Средний срок наблюдения за пациентами составил 8,9±3,2 месяцев. За весь период наблюдения рецидив СШМП возник только у 2 пациентов. Таким образом, эффективность модифицированной роботассистированной YV-пластики шейки мочевого пузыря составила 93,3%.
Заключение. Робот-ассистированная YV-пластика в представленной модификации имеет высокую степень эффективности и безопасности при рецидивном стенозе шейки мочевого пузыря.
Для цитирования: Попов С.В., Орлов И.Н., Цой А.В., Топузов Т.М., Малик В.В., Неймарк А.И., Неймарк Б.А. Модифицированная робот-ассистированная YV-пластика при рецидивном стенозе шейки мочевого пузыря. Первые результаты. Экспериментальная и клиническая урология 2023;16(1):148-153; https://doi.org/10.29188/2222-8543-2023-16-1-148-153
Введение
Стеноз шейки мочевого пузыря (СШМП) является одним из наиболее грозных и плохо поддающихся коррекции осложнений трансуретральных хирургических вмешательств на предстательной железе (ПЖ). Частота развития данного осложнения по результатам различных исследований варьирует от 10 до 24,8% [1]. И хотя этот показатель значительно меньше, чем вероятность других осложнений (например, ретроградной эякуляции или недержания мочи), особую негативную окраску СШМП придают два фактора — отдаленные сроки его возникновения и высокая частота рецидивов. Так, срок возникновения данного осложнения варьирует от 2 месяцев до 2 лет после операции, что иногда затрудняет первичную и дифференциальную диагностику [2].
Несмотря на значительный прогресс в эндоурологии и обилие новых технологических решений, применяемых в трансуретральной хирургии, результаты эндоскопической коррекции СШМП все еще остаются неудовлетворительными. Эффективность эндоскопической коррекции первичного СШМП составляет по данным разных авторов от 25 до 80% [2]. Отдаленная результативность трансуретральных вмешательств при рецидивирующих стенозах меньше — в среднем она не превышает 58% [3].
Для понимания причин таких неудовлетворительных результатов современных эндоскопических методик коррекции СШМП важно проанализировать факторы риска возникновения СШМП в целом. Так, хронические заболевания (сахарный диабет, атеросклероз), курение, малый объем ПЖ, хроническая ишемия мочевого пузыря, избыточная коагуляция в области шейки при трансуретральной резекции (ТУР) ассоциированы с высоким риском развития СШМП [4]. Все эти факторы связаны с повреждением микроциркуляторного русла, развитием стойкой ишемии шейки мочевого пузыря, неадекватными репаративными процессами с преобладаем формирования грубой рубцовой ткани. Таким образом, становится понятна склонность к рецидивированию СШМП — ишемизация тканей при трансуретральном вмешательстве не только не улучшает в последующем питание шейки мочевого пузыря, но и усугубляет ишемию, что и порождает дополнительное склерозирование зоны шейки мочевого пузыря и переднего фартука детрузора [5].
Одним из вариантов снижения процента рецидивирования СШМП после оперативной коррекции является уменьшение локальной ишемии тканей и восстановление их адекватного кровоснабжения, что может быть достигнуто с помощью реконструктивнопластических операций.
Еще в 1953 B.W. Young в 1953г предложил методику YV-пластики ШМП у пациентов в рецидивирующими стенозами [6]. Данная методика предотвращает рецидив заболевания за счет замещения рубцовых тканей хорошо кровоснабжаемым лоскутом мочевого пузыря [1, 7]. Несмотря на то, что данная методика была предложена еще в середине прошлого века, широкое применение она получила лишь в последнее десятилетие, что связано с развитием эндовидеохирургических, и в особенности, роботических технологий, которые обеспечивают прецизионность, эргономичность и высокое качество визуализации.
В 2018 году стандартная методика YV-пластики была переработана M. Musch и соавт. для роботической хирургической системы. Техника операции не отличалась от оригинального способа. В результате оперативного лечения у 12 (83,3%) пациентов был достигнут положительный эффект [8].
Наибольшая техническая сложность, характерная для стандартной роботической YV-пластики, связана со сложностью линейной инцизии шейки мочевого пузыря. У пациентов со СШМП интраоперационно выявляется выраженная рубцовая деформация шейки и ее спаянность с передним фартуком детрузора и паравезикальной клетчаткой, что затрудняет визуализацию шейки и ее точное линейное рассечение. Обилие рубцовых тканей в зоне хирургического интереса создает необходимость применения большого количества энергии, что впоследствии ухудшает кровоснабжение этой зоны. Данного негативного момента можно избежать при эндоскопическом рассечении суженного участка, что и было предпринято в нашей модифицированой методике робот-ассистированной YV-пластики СШМП. В настоящей статье представлены техника и первые результаты данной методики.
Материалы и методы
С 2021 по 2022 гг. в СПб ГБУЗ «Клиническая больница Святителя Луки» было выполнено 30 робот-ассистированных модифицированных YV-пластик шейки мочевого пузыря у пациентов с рецидивными стенозами шейки мочевого пузыря. В исследование включались все пациенты с верифицированным диагнозом «Рецидивный стеноз шейки мочевого пузыря», который установлен на основании жалоб, анамнеза, измерении уровня общего простатспецифического антигена (ПСА), урофлоуметрии с определением объема остаточной мочи по ультразвуковому исследованию (УЗИ), ретроградной и антеградной гибкой уретроцистоскопии, ретроградной уретрографии, микционной уретрографии.
Модифицированная методика робот-ассистированной YV-пластики
Пациент укладывается в литотомическое положение с наклоном стола в положение Trendelenburg на 30-35 градусов. Для выполнения операции в общей сложности устанавливаются 5 портов. Оптический порт устанавливают параумбиликально. Роботические порты располагают по дуге на расстоянии не менее 4 см друг от друга. Порты №1 и №2 устанавливают параллельно прямой мышце живота с обеих сторон от оптического порта, смещаясь на 2 см каудальней. Порт №3 располагают на 3 см выше над подвздошной остью. Ассистентский порт устанавливают контралатерально от порта №3. По общепринятой методике внутрибрюшинно осуществляют доступ к передней стенке мочевого пузыря. После установления визуального контроля над шейкой мочевого пузыря ассистент с помощью резектоскопа трансуретрально визуализирует основные анатомические ориентиры и верифицирует диагноз склероза шейки мочевого пузыря (рис. 1).
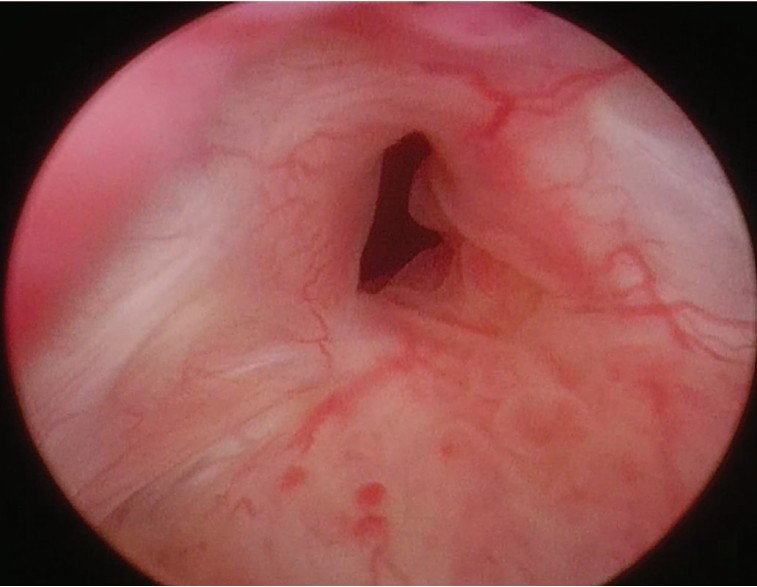 Рис. 1. Уретроскопическая картина стеноза шейки мочевого пузыря
Рис. 1. Уретроскопическая картина стеноза шейки мочевого пузыря
Затем выполняется эндоскопическое лазерное рассечение ШМП с использованием тулиевого лазера с параметрами: мощность — 1,5 Дж, частота — 23 Гц. Рассечение проводится линейно на 12 часах условного циферблата в пределах здоровых тканей. Инцизия выполняется под визуальным контролем со стороны предпузырного пространства до момента вскрытия просвета мочеиспускательного канала (рис. 2).
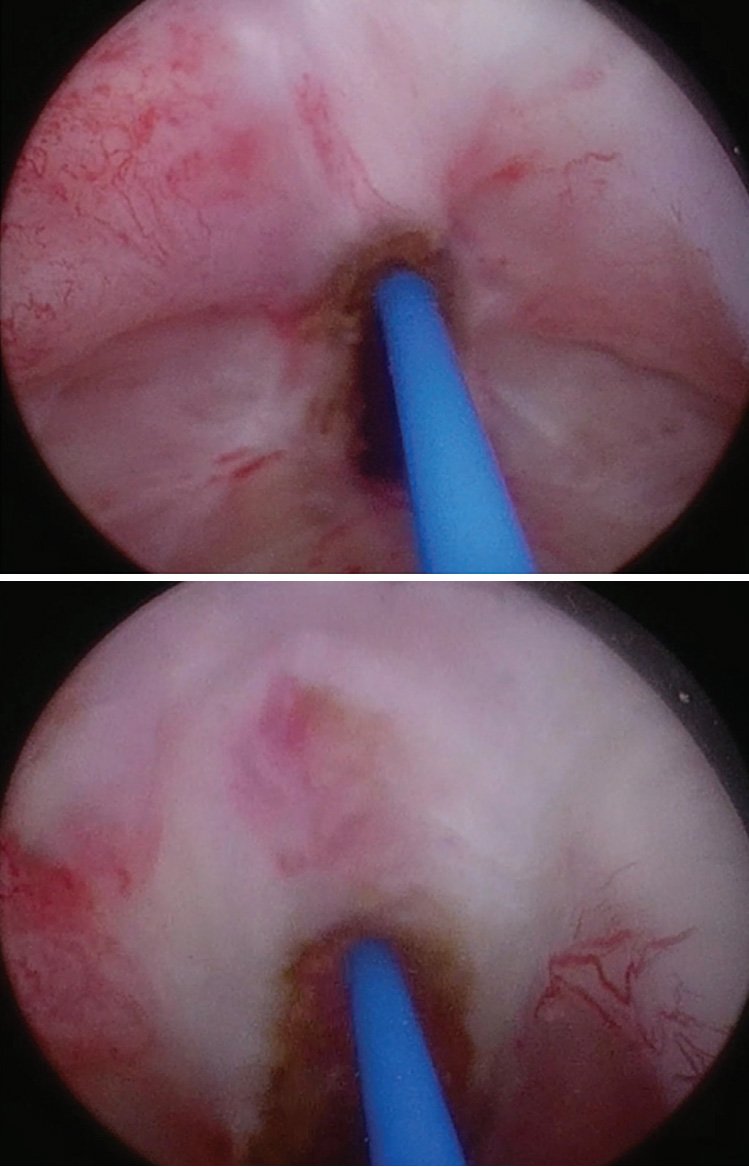 Рис. 2. Интраоперационная картина: трансуретральное лазерное рассечение шейки мочевого пузыря на 12 часах
Рис. 2. Интраоперационная картина: трансуретральное лазерное рассечение шейки мочевого пузыря на 12 часахОсновной целью трансуретрального доступа является СШМП до появления ирригационной жидкости со стороны предпузырного пространства (рис. 3).
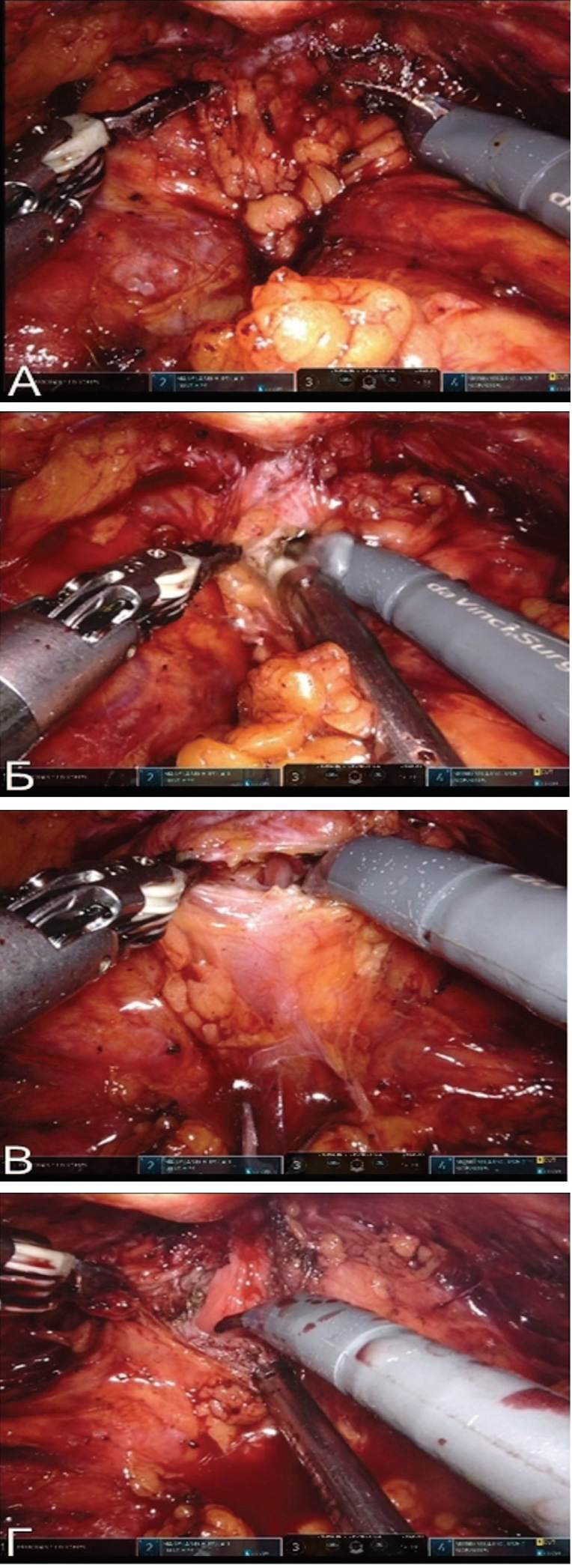 Рис. 3. Интраоперационная картина: А) Подготовленная передняя стенка мочевого пузыря для трансуретрального рассечения ШМП. Б) Появление ирригационной жидкости во время трансуретрального рассечения СШМП. В, Г) Формирование лоскута из передней стенки мочевого пузыря
Рис. 3. Интраоперационная картина: А) Подготовленная передняя стенка мочевого пузыря для трансуретрального рассечения ШМП. Б) Появление ирригационной жидкости во время трансуретрального рассечения СШМП. В, Г) Формирование лоскута из передней стенки мочевого пузыря
От области эндоскопического рассечения стенозированной ШМП продолжают рассекать шейку и переднюю стенку мочевого пузыря в заднелатеральные стороны в виде буквы «Y». Угол сформированного треугольного лоскута из передней стенки мочевого пузыря сшивают с началом места рассечения шейки c помощью нити V-loc 3/0. Таким образом, ушивание дефекта мочевого пузыря происходит в виде буквы «V» (рис. 4).
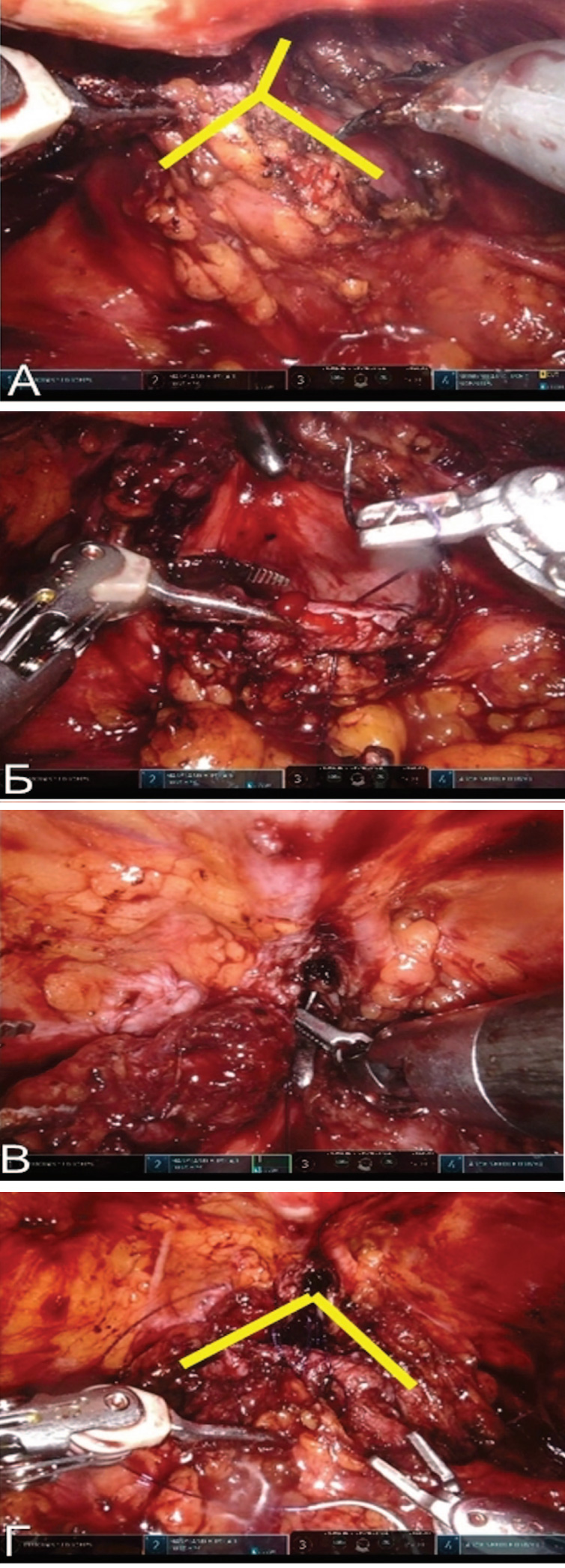 Рис. 4. Интраоперационная картина: А) Y-образное рассечение шейки и передней стенки мочевого пузыря с формированием лоскута. Б-Г) V-образное ушивание передней стенки мочевого пузыря
Рис. 4. Интраоперационная картина: А) Y-образное рассечение шейки и передней стенки мочевого пузыря с формированием лоскута. Б-Г) V-образное ушивание передней стенки мочевого пузыряПосле ушивания, по металлическому проводнику заводят уретральный катетер Foley №18 Ch. Предпузырное пространство дренируют в течение 24 часов. Уретральный катетер удаляют на 7-е сутки после контрольной ретроградной цистографии.
Результаты
Минимальный возраст больных составил 57 лет, максимальный – 76 лет, средний возраст – 66,7±5,2 года. Всем пациентам оперативное лечение проводилось по описанной выше методике. Средний срок наблюдения за пациентами составил 8,9±3,2 месяцев. Первичные данные о пациентах представлены в таблице 1.
| Показатель / Index | Значение / Meaning |
|---|---|
| Qmax до операции, мл/сек / preoperative Q max, ml/sec | 3.64 ± 2.68 |
| IPSS до операции, балл / IPSS before surgery, point | 20.52 ± 2.15 |
| QoL до операции, балл / QoL before surgery, point Me [Q25;Q75] |
5.4 [5;6] |
| Наличие цистостомы до операции, % / The presence of a cystostomy before surgery, % | 9 (30%) |
| Количество оперативных вмешательств в анамнезе, n, Me [Q25;Q75] The number of surgical interventions in the anamnesis, n, Me [Q25;Q75] |
2 [1;3] |
Длительность оперативного в среднем составила 91,1 ± 18,4 минут. После окончания операции всем пациентам устанавливался уретральный катетер. Средняя длительность катетеризации составила 7,6±1,0 дней.
Средний объем кровопотери в результате оперативного вмешательства составил 41,33 ± 29,48 мл. Средний уровень гемоглобина в периферической крови до операции у пациентов составил 140,37 ±12,76 г/л, тогда как после операции — 132,3 ± 13,4 г/л.
В целом методика продемонстрировала относительно высокую безопасность и низкий уровень развития послеоперационных осложнений. Ни в одном случае не было выявлено осложнения выше II степени по классификации Clavien, что в основном было ограничено назначением гемостатических и антибактериальных препаратов.
Результаты оперативного лечения оценивались через 3 месяца после операции. Пациенты вновь проходили стандартное обследование, включающее в себя сбор анамнеза и жалоб, а также выполнение урофлоуметрии с определением объема остаточной мочи (ООМ) по УЗИ. Максимальная скорость мочеиспускания (Qmax)через 3 месяца составила 17,51 ± 2,92 мл/сек (p<0,05). Кроме того, данный показатель оставался устойчиво высоким и по истечению 6 месяцев после операции. Аналогичная положительная тенденция сохранялась в послеоперационном периоде и для ООМ ( табл. 2).
| Показатель / Index | Группа PA YV-пластики ШМП / Group RA YV-plastics of bladder neck |
|---|---|
| Qmax до операции (мл/сек) / Qmax before surgery (ml/sec) | 3.64 ± 2.68 |
| Qmax через 3 месяца, (мл/сек) / Qmax after 3 months, (ml/sec) | 17.51 ± 2.92 |
| Qmax через 6 месяцев, (мл/сек) / Qmax after 6 months, (ml/sec) | 16.33 ± 1.69 |
| OOM до операции (мл) / preoperative PVR urine (ml) | 96.11 ± 43.34 |
| OOM через 3 месяца (мл) / PVR urine after 3 months (ml) | 22.97 ± 16.39 |
| OOM через 6 месяцев (мл) / PVR urine after 6 months (ml) | 16.00 ± 14.18 |
Рецидив СШМП фиксировался в тех случаях, когда максимальная скорость мочеиспускания снижалась ниже 12 мл/сек; у пациента возникал эпизод острой задержки мочеиспускания, либо требовалось дополнительное оперативное вмешательство по поводу обструктивных симптомов мочеиспускания.
За весь период наблюдения рецидив СШМП возник только у 2 пациентов. Таким образом, эффективность модифицированной робот-ассистированной YV-пластики ШМП составила 93,3%.
Обсуждение
Ограниченная эффективность эндоскопического подхода в коррекции рецидивного СШМП диктует необходимость поиска иного подхода в выборе метода лечения [9]. Так, A. Simonato и соавт. предложили трансперинеальный анастомоз конец-в-конец с последующей имплантацией искусственного сфинктера мочевого пузыря [10].
C. Theodorou и коллеги предложили абдомино-перинеальный доступ с симультанной установкой искусственного сфинктера мочевого пузыря [11]. Обе методики в связи с большой травматичностью зоны наружного сфинктера мочевого пузыря, неизбежно приводят к стрессовому недержанию мочи тяжелой степени, что диктует необходимость установки искусственного сфинктера.
Несмотря на то, что методика YV-пластики ШМП предложена еще в середине XX века, свое практическое применение она получила с появлением роботических технологий. Так, M. Musch и соавт. впервые опубликовали результаты лечения 12 пациентов с рецидивным СШМП. Данный метод показал высокую степень безопасности и эффективность у 83,3% пациентов [8]. В последующем предложены не менее эффективные методики в виде Т-пластики ШМП, а также субтригональной имплантации буккального графта в область ШМП [7, 12, 13]. Однако, с учетом числа опубликованных работ, основополагающим методом реконструкции ШМП на данный момент остается методика YV-пластики [8, 14-17]. В подавляющем числе случаев СШМП представлен циркулярным сужением в виде центростремительного рубцового процесса, который может быть замедлен за счет послеоперационной инстилляции гиалуроновой кислоты как показано в исследованиях L. Zhang и соавт. и Ф.А. Севрюкова и соавт. [18, 19]. Таким образом, аугментация ШМП с помощью мобилизованного кровоснабжаемого лоскута из передней стенки мочевого пузыря имеет патогенетическое обоснование.
Рубцовая деформация шейки мочевого пузыря часто препятствует прецизионному рассечению стенозированного участка ШМП. С этой целью нами предварительно выполняется эндоскопическое рассечение шейки в зоне стеноза, что значительно облегчает дальнейший ход операции. Полученные результаты являются многообещающими в решении проблемы для данной категории пациентов, хотя требуют сравнительных исследований и отдаленных результатов.
Выводы
Робот-ассистированная YV-пластика в представленной модификации имеет высокую степень эффективности и безопасности при рецидивном стенозе шейки мочевого пузыря.