Сравнительный анализ робот-ассистированных и лапароскопических операций в онкогинекологии
Введение
Современная малоинвазивная хирургия начала свое развитие в 1901 г., когда Георг Келлинг (1866–1945), хирург и гастроэнтеролог из Дрездена, доложил об успешном проведении целиоскопии и осмотре брюшной полости без широкого разреза в эксперименте на собаке [1]. Позднее, в 1933 г., Карлу Ферверсу удалось выполнить первый лапароскопический (ЛС) адгезиолиз, который можно рассматривать как первую хирургическую лапароскопию в современном понимании этого термина [2]. Один из основных этапов становления лапароскопии заключался в совершенствовании техники входа в брюшную полость, в чем пионерами стали немецкие хирурги Кальк (1927) и Вереш (1938). Затем стали внедряться методы освещения брюшной полости, подачи углекислого газа и использование электрокоагуляции. Это привело к постепенному росту объемов операций. Так, в 1962 г. была проведена первая ЛС трубная стерилизация, в 1980 г. – ЛС аппендэктомия, в 1985 г. – ЛС холецистэктомия, а в 1989 г. – ЛС гистерэктомия (ГЭ). С учетом числа достоинств и минимизации негативных аспектов в интра- и послеоперационном периоде с 1990 г. лапароскопия стала широко распространенным оперативным доступом, который постепенно прочно занял свою нишу практически во всех областях хирургии [3].
Вследствие стремительного и всестороннего развития малоинвазивной хирургии в конце ХХ века появилась робот-ассистированная (РА) хирургия, основная идея которой заключалась в минимизации тремора рук хирурга при работе. В дальнейшем в РА хирургии увидели возможность формирования точных и деликатных швов в анатомических областях, труднодоступных для традиционных хирургических методов, и облегчения тем самым работы хирурга в целом. Сейчас же широко обсуждается идея полной субституции человеческого фактора в операционной.
В гинекологии первой операцией с использованием РА хирургии было формирование трубного анастомоза у пациентки после хирургической стерилизации в 1999 г. [4]. Трубный анастомоз – вмешательство, требующее статичной и четкой визуализации, выполняемое тонкими нитями на легко травмируемых тканях в полости малого таза, поэтому использование робота в этом случае является прямой трансляцией основной идеи использования РА хирургии в целом.
В статье “Future platforms of robotic surgery” говорится, что РА технологии отвечают всем требованиям для проведения сложных прецизионных послойных диссекций в статичном поле, обеспечивают качественную визуализацию в труднодоступных анатомических областях и позволяют формировать лигатуры деликатными шовными материалами [5], поэтому успех внедрения роботов в хирургию привел к последовательному росту объемов выполняемых операций в гинекологии. Так, в 2002 г. была впервые проведена РА ГЭ [6], затем – РА миомэктомия, а в 2004 г. – сакровагинопексия [7].
Начиная с 2006 г. РА операции начали внедряться и в онкогинекологию. Первое достаточно известное описание РА радикальной ГЭ с двусторонней диссекцией тазовых лимфатических узлов у пациентки с карциномой шейки матки опубликовали в Норвегии B.M. Sert и V.M. Abeler [8]. Почти одновременно с этим врачи-онкоурологи из США освоили забрюшинный вариант поясничной лимфаденэктомии с помощью робота [9]. Урологи и гинекологи сообщили об определенных преимуществах РА технологии в сравнении с ЛС, однако необходимо указать, что в 2000-х годах при лапароскопии использовались только стандартные биполярный диссектор и ножницы, а в современной лапароскопии используются комбинированные инструменты, позволяющие одновременно коагулировать и разделять ткани за счет разных видов энергий, что ускоряет проведение операции и снижает количество интра- и послеоперационных осложнений.
Спустя 2 года впервые удалось выполнить РА трансабдоминальную поясничную лимфаденэктомию [10]. Этот вариант несколько сложнее забрюшинного доступа технически, ввиду того что необходимо выполнить достаточно широкую мобилизацию толстой и двенадцатиперстной кишки с использованием дополнительных способов их фиксации для адекватного доступа к зоне операции. Кроме того, в ходе движения диссекции от уровня бифуркации аорты до почечных сосудов нередко требуется перестановка троакаров, что в контексте РА хирургии требует редокинга. В этом варианте РА операции не демонстрируют очевидных преимуществ, однако дискуссия о своеобразном соревновании между РА хирургией и традиционной лапароскопией продолжается до сих пор.
Один из наиболее крупных систематических обзоров последних лет, сравнивающих параметры малоинвазивных операций, включал 57 697 пациенток, 16 826 из которых была выполнена РА ГЭ. Авторы ввели одинаковые критерии сравнения и не выявили статистически значимых отличий ни по каким показателям. Дополнительно были отмечены неблагоприятные факторы для обеих групп пациенток, из которых наиболее значимыми стали коморбидность, ожирение, возраст, ранее перенесенные операции [11].
В настоящее время в библиотеке Кокрановского сотрудничества, включающей аннотации из баз данных PubMed, Embase, CINAHL и ClinicalTrials.gov, а также на российском портале eLibrary приведено более 1000 публикаций на тему РА операций в онкогинекологии. Рандомизированных исследований при этом всего 2 [12, 13].
Первое крупное сравнительное исследование цитируется более 156 раз [12]. В исследование было включено 99 пациенток, пролеченных в период 2010–2013 гг. в объеме ЛС или РА экстирпации матки. Средняя продолжительность операции в группе традиционной лапароскопии (n = 49) составила 170 (126–259) мин, а в группе РА хирургии (n = 50) – 139 (86–197) мин (р <0,001). При сравнении других показателей авторы пришли к выводу, что РА операции предлагают эффективную и безопасную альтернативу ЛС экстирпации матки, реже приводя к конверсиям доступа и осложнениям.
Другое рандомизированное исследование цитируется всего 14 раз [13]. В данном исследовании 176 и 193 пациентки перенесли РА и ЛС операции соответственно в период 2010–2015 гг. Средняя продолжительность операции при РА хирургии составила 190 (75–432) мин, а при ЛС – 145 (33–407) мин (р <0,001). Авторы сделали вывод, что РА операции требовали более длительной работы, чем ЛС, и не превосходят последние по частоте и характеру периоперационных осложнений у онкогинекологических пациенток.
Когортное исследование, в котором оценивались целесообразность и безопасность РА ГЭ у пациенток с ожирением (индекс массы тела (ИМТ) >30 кг/м2), продемонстрировало, что частота осложнений или конверсий не коррелирует с показателем ИМТ [14]. Это подтвердилось в ряде других исследований. Например, некоторые авторы сообщили о результатах РА лечения больных раком тела матки в сочетании с морбидным ожирением в зависимости от ИМТ. В исследование было включено 50 пациенток со средним ИМТ 41 кг/м2, 10 пациенток с ИМТ 47 кг/м2 и еще 10 пациенток с ИМТ 53 кг/м2. Был сделан вывод, что исходы лечения пациенток с ожирением РА методом не зависят от ИМТ [15].
По данным литературы, РА хирургия определяется в основном как раздел технологий будущего ввиду малоинвазивности (в частности, использования однопортового доступа), возможности ее компьютеризации, внедрения дополнительных способов визуализации и сопоставимости с данными компьютерной и магнитнорезонансной томографии в режиме реального времени [16]. Однако трезвая оценка ситуации говорит о том, что технологии РА хирургии очень близки к традиционной лапароскопии и находятся, по сути, в самом начале своего развития. Успешное и быстрое проведение РА операций напрямую зависит от навыков хирурга и его ассистентов. Немаловажен и экономический аспект вопроса, ведь РА операции обладают высокой себестоимостью, начиная от закупки и установки оборудования и заканчивая обучением врачей методике РА хирургии [17–19].
Цель исследования – определить достоинства и недостатки ЛС и РА хирургии при онкогинекологических операциях.
Материалы и методы
В ретроспективное исследование было включено 282 пациентки, прооперированные в отделении онкогинекологии №70 ГБУЗ «Городская клиническая больница им. С.П. Боткина Департамента здравоохранения г. Москвы» в период с февраля 2020 г. по сентябрь 2022 г., со следующими клиническими диагнозами: рак эндометрия IA–II стадий, рак шейки матки in situ и IA1 стадий или атипическая гиперплазия эндометрия (табл. 1). Операции были выполнены малоинвазивными методами, из них 74 – посредством РА хирургии, 208 – с применением ЛС хирургии.
Все пациентки были разделены на 3 группы с учетом объема оперативного вмешательства: ГЭ; ГЭ + тазовая лимфаденэктомия (ТЛАЭ); гистерэктомия + тазовая и забрюшинная поясничная лимфаденэктомия (ГЭ + ПЛАЭ + ТЛАЭ) (табл. 2). РА операции выполнялись роботами Da Vinci (модели Si и Xi). ГЭ и ГЭ + ТЛАЭ выполняли на модели Si, при этом Da Vinci располагали возле правой ноги пациентки, а ГЭ + ПЛАЭ + ТЛАЭ – на модели Xi, при этом Da Vinci устанавливали с правой стороны от живота пациентки. Для ЛС операций использовали классическую стойку Karl Storz. При выполнении забрюшинных ПЛАЭ подключали дополнительную стойку, которую, помимо основной, ставили либо справа от пациентки при выполнении парааортального этапа, либо слева во время паракавального. При проведении всех операций пациенток располагали лежа на спине со специальными креплениями для поддержания ног, которые фиксировали в разведенном состоянии, при этом уровень бедер находился на прямой линии с туловищем, чтобы ноги не мешали манипуляциям с видеолапароскопом при его ориентации на поясничный отдел аорты и нижней полой вены.
Для воспроизведения каждого вида операций троакары устанавливались согласно следующим схемам (рис. 1)
Таблица 1. Распределение пациенток в зависимости от диагноза
| Диагноз | Робот-ассистированные операции (n = 74) | Лапароскопические операции (n = 208) | ||
| n | % | n |
% |
|
| Атипическая гиперплазия эндометрия | 11 | 14,9 | 24 | 11,5 |
| Рак шейки матки in situ | 2 | 2,7 | 5 | 2,5 |
| Рак тела матки T1aN0М0 G 1–2 | 41 | 55,4 | 113 | 54,3 |
| Рак тела матки T1bN0M0–T2N0M0 | 20 | 27,0 | 66 | 31,7 |
Таблица 2. Распределение пациенток в зависимости от объема выполненной операции
| Объем операции | Робот-ассистированные операции (n = 74) |
Лапароскопические операции (n = 208) |
||
| n | % | n | % | |
| Гистерэктомия | 54 | 73,0 | 142 | 68,0 |
| Гистерэктомия с тазовой лимфаденэктомией | 12 | 16,2 | 50 | 24,0 |
|
Гистерэктомия с тазовой и забрюшинной поясничной лимфаденэктомией |
8 | 10,8 | 16 | 7,6 |
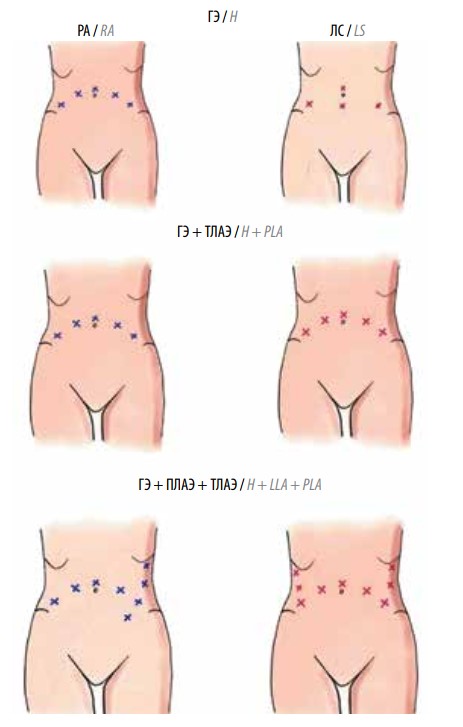 Рис. 1. Схемы расположения троакаров при
робот-ассистированных
Рис. 1. Схемы расположения троакаров при
робот-ассистированных
(РА) и лапароскопических (ЛС) операциях. ГЭ – гистерэктомия; ГЭ
+
ТЛАЭ –
гистерэктомия с тазовой лимфаденэктомией; ГЭ + ПЛАЭ +
ТЛАЭ – гистерэктомия с тазовой и
забрюшинной поясничной лимфаденэктомией
При выполнении ЛС ГЭ устанавливали суммарно 4 троакара: один параумбиликально и три над лоном.
В случаях ЛС ТЛАЭ использовали 5 троакаров: один параумбиликально, два по параректальным линиям и по одному слева и справа в подвздошных областях.
Во время забрюшинного поясничного этапа устанавливали дополнительно 2 троакара: один в подреберье с соответствующей стороны и один на середине расстояния между ним и троакаром, установленным в подвздошной области. При этом операцию начинали именно с забрюшинного этапа как в ЛС группе, так и в РА. После окончания поясничной лимфодиссекции вмешательство продолжали трансабдоминальным ЛС или РА доступом.
При выполнении РА операций минимально устанавливали 5 троакаров в случае ГЭ и столько же в случае добавления этапа ТЛАЭ.
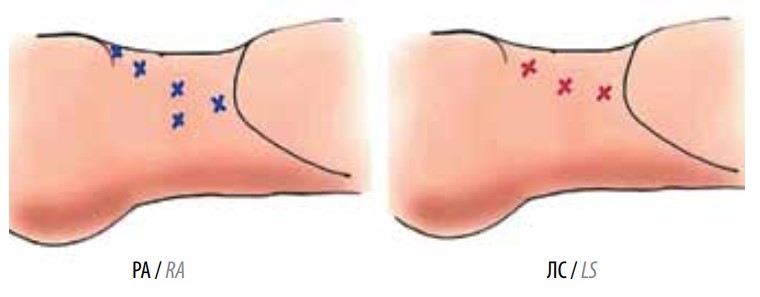 Рис. 2. Расположение троакаров при забрюшинных робот-ассистированных (РА) и
лапароскопических (ЛС)
лимфаденэктомиях (вид сбоку)
Рис. 2. Расположение троакаров при забрюшинных робот-ассистированных (РА) и
лапароскопических (ЛС)
лимфаденэктомиях (вид сбоку)
При выполнении забрюшинной ПЛАЭ устанавливали 2 дополнительных троакара в направлении левого подреберья и 1 троакар ниже, в левой подвздошной области. Также ниже всех троакаров устанавливали троакар для ассистента.
Отличием в расположении троакаров при РА операциях по сравнению с ЛС была необходимость установки 4 троакаров для забрюшинного доступа и 1 дополнительного троакара для ассистента. При этом при лапароскопии на данном этапе использовали всего 3 троакара (рис. 2).
В наборе инструментов для РА операций использовали граспер, биполярный диссектор, ножницы с подключением к монополярной коагуляции. Через ассистентский троакар использовали аспиратор, при необходимости подавали и извлекали салфетки, вводили эндоконтейнеры. Во всех ЛС операциях использовали биполярный диссектор Ligasure Blunt диаметром 5 мм и грасперы. Все ЛС операции выполняли без маточного манипулятора. В РА операциях он был использован в единичных случаях. Все ГЭ и забрюшинные лимфаденэктомии выполнялись 2 врачами. При осуществлении тазовой ГЭ посредством лапароскопии дополнительно привлекали третьего ассистента, а при РА операциях на всех этапах ассистент был один, за исключением случаев, когда использовался маточный манипулятор.
Анализ данных проводился в стандартной программе Microsoft Excel. Для обработки информации использовались методы описательной статистики и критерий Стьюдента.
Результаты
Для сравнения технических характеристик малоинвазивных операций и состояния пациенток в каждой группе были проанализированы данные о длительности операций, ИМТ, возрасте, периоперационных осложнениях, а также количестве послеоперационных койко-дней, проведенных пациентками в стационаре.
Гистерэктомия. Всего в группе ГЭ выполнена 201 операция, из них 54 РА и 142 ЛС. Характеристика операций представлена в табл. 3.
Таблица 3.Характеристика лапароскопических и робот-ассистированных гистерэктомий
| Показатель | Робот-ассистированные операции (n = 54) | Лапароскопические операции (n = 142) |
| Возраст, лет | 57,8 (38–81) | 62 (30–88) |
| Индекс массы тела, кг/м2 | 29,2 (23–45) | 33 (22–54) |
| Продолжительность операции, мин* | 117 (70–200) | 74,2 (30–120) |
| Осложнения, n (%) | 2 (3,7) | 0 |
| Число койко-дней | 3,1 | 2 |
*Продолжительность операции имеет статистически значимое различие, p <0,0001.
Таблица 4. Характеристика лапароскопических и робот-ассистированных гистерэктомий с тазовой лимфаденэктомией
| Показатель | Робот-ассистированные операции (n = 12) | Лапароскопические операции (n = 50) |
| Возраст, лет | 62,6 (51–72) | 64 (46–80) |
| Индекс массы тела, кг/м2 | 31,2 (29–36) | 31 (22–44) |
| Продолжительность операции, мин | 170 (90–190) | 142 (70–160) |
| Количество удаленных лимфатических узлов | 14,3 (8–20) | 16 (9–29) |
| Осложнения, n (%) | 1 (8,3) | 1 (2,0) |
| Число койко-дней | 3,3 | 2,5 |
Среди осложнений в группе РА операций зафиксирован случай тромбоэмболии легочной артерии в раннем послеоперационном периоде у пациентки, прооперированной с помощью Da Vinci, что привело к летальному исходу. Вторым осложнением стало внутрибрюшное кровотечение из троакарного доступа, развившееся в 1-е сутки послеоперационного периода, с общей кровопотерей объемом 1000 мл, потребовавшее впоследствии выполнения экстренного оперативного вмешательства. В группе ЛС ГЭ осложнений не было.
Гистерэктомия с ТЛАЭ. В группе ГЭ + ТЛАЭ выполнено 62 операции, из них 54 РА и 142 ЛС. Дополнительным критерием сравнения стало количество удаленных лимфатических узлов. Характеристика операций представлена в табл. 4.
Средний объем кровопотери в обеих группах не превышал 30 мл. Из осложнений в группе РА хирургии зафиксировано ранение общей подвздошной вены при лимфаденэктомии за счет «соскакивания» одного инструмента с другого ввиду их пересечения друг с другом вне поля зрения. При этом эпизоде не произошло значимой кровопотери, вена была интракорпорально ушита. В группе ЛС операции в 1 случае произошло неполное пересечение запирательного нерва. Нерв был ушит интракорпорально. Неврологической симптоматики в послеоперационном периоде выявлено не было.
Таблица 5. Сравнение характеристик робот-ассистированных и лапароскопических забрюшинных поясничных лимфаденэктомий с продолжением тазовой лимфаденэктомией и пангистерэктомией
| Показатель | Робот-ассистированные операции (n = 8) | Лапароскопические операции (n = 16) |
| Возраст, лет | 58,5 (53–68) | 56,3 (31–73) |
| Индекс массы тела, кг/м2 | 31,5 (29–35) | 33,3 (24–49) |
| Продолжительность операции, мин | 328 (255–400) | 200,9 (110–255) |
|
Количество удаленных лимфатических узлов: тазовых поясничных |
10,8 (7–16) 7,75 (2–13) |
11,4 (6–19) 7,64 (3–15) |
| Осложнения, n (%) | 1 (12,5) | 1 (6,3) |
| Число случаев перфорации брюшины | 5 | 2 |
| Число койко-дней | 4,1 | 3,5 |
Гистерэктомия с ТЛАЭ и ПЛАЭ. В группе ГЭ + ПЛАЭ + ТЛАЭ выполнено 24 операции, из них 8 РА и 16 ЛС. Характеристика операций представлена в табл. 5. Дополнительно зафиксировали количество перфораций брюшины на забрюшинном этапе лимфаденэктомии, которые приводили к необходимости завершения выполнения лимфаденэктомии и перехода к ТЛАЭ ввиду десуфляции забрюшинного пространства. Попытки ушивания брюшины удались только в 2 случаях: 1 в группе РА операций и 1 в группе ЛС (табл. 5).
Среди осложнений в РА группе в 1 случае произошло внутрибрюшное кровотечение из маточной артерии, объем которого составил около 1000 мл, что потребовало экстренной повторной операции лапаротомическим доступом. В ЛС группе в 1 случае была зафиксирована кишечная непроходимость, обусловленная попаданием петли тонкой кишки в запирательную ямку, что потребовало повторного хирургического лечения лапаротомическим доступом.
Обсуждение
При сравнении средней продолжительности операций получена статистически значимая разница. Так, ЛС ГЭ проводилась в среднем на 43 мин быстрее РА (74,2 мин против 117 мин) (p <0,001). При выполнении ТЛАЭ средняя продолжительность РА операций была на 28 мин больше продолжительности ЛС операций (142 мин против 170 мин) (p <0,001). При добавлении этапа забрюшинной лимфаденэктомии продолжительность операций в РА группе была больше на 128 мин по сравнению с ЛС группой. Сопоставляя результаты с данными литературы, можно отметить более высокую скорость выполнения операций как в ЛС, так и в РА группе [12, 13].
Можно выделить 2 вероятные причины «лучших» временных характеристик ЛС операций по ́ сравнению как с данными литературы, так и с РА группой нашего исследования. В первую очередь более длительные операции характерны для периода набора 2010–2015 гг., указанного в рандомизированных исследованиях. Технологии выполнения операций и представления об их этапах претерпели множество модернизаций. Вторая причина заключается в использовании современного инструментария в ЛС группе. При РА операциях использовалась комбинация биполярного диссектора и ножниц с монополярным электродом, что могло приводить к увеличению продолжительности операций в РА группе.
В литературе в отношении других вмешательств, таких как сакрокольпопексия или простатэктомия, авторы аналогично указывают на более высокую продолжительность операций в РА группе [20–22]. Исследования о простатэктомиях и сакровагинопексиях – операциях, включающих этапы деликатного формирования швов – часто содержат среди выводов определенные стилистические черты, характеризующие РА операции как прецизионные точные вмешательства с высококачественной визуализацией, что является субъективными показателями. Однако в разделе недостатков сообщается как о большей продолжительности операции, так и о более длительном общем пребывании пациенток в операционной [22, 23]. Такая же тенденция отмечается при операциях по поводу эндометриоза [23, 24].
Помимо несколько более сложного стереотипа движений в РА хирургии в сравнении с ЛС с использованием Ligasure, следует остановиться на ушивании влагалища. Особенность заключается в высокой плотности ткани, которую роботический иглодержатель не вполне надежно прокалывает иглой. Формирование лигатуры на влагалищной манжете нитью толщиной более 2–0 для робота является весьма грубым действием ввиду сравнительно деликатного характера инструментов. И наконец, разрывы влагалища после малоизвазивных операций, по данным литературы, происходят чаще именно в РА группе. Иностранные авторы предлагают 2 варианта решения этой проблемы: либо использовать «зубчатую» нить, либо ушивать влагалище ЛС доступом [25].
Представляется интересным остановиться на специфике работы хирургической бригады. Ассистент и медсестра в РА хирургии значительно меньше вовлечены в ход операции, чем при ЛС операции. В определенных случаях это может являться преимуществом. Однако при появлении необходимости в участии ассистента в операции ему потребуется определенное время, чтобы адаптировать свою пространственную ориентацию на работу в определенной зоне операции. При ЛС операции ассистент находится постоянно в состоянии пространственной адаптации. Этот факт особенно важен при выполнении забрюшинной лимфаденэктомии.
Одной из частых проблем ретроперитонеального доступа является перфорация брюшины, которая ведет к десуффляции забрюшинного пространства и невозможности продолжения операции этим доступом. В нашей практике это, как правило, происходило при замене инструментов или введении салфеток. При РА операциях перфорация брюшины происходила в 3 раза чаще, хотя и этот факт не продемонстрировал статистической значимости ввиду малой выборки.
Интересная точка зрения приводится в одном метаанализе [26], где авторы рассуждают о необходимости не только качественного обучения роботического хирурга, но и выделения высококвалифицированных операционных медсестер. Если предположить, что профессиональная медсестра в РА хирургии – вполне реальная перспектива, то профессиональный ассистент – намного более сложная задача ввиду особенностей этого раздела хирургии. Позиция ассистента в РА хирургии своеобразна тем, что требует хороших навыков ЛС хирургии и не приближает врача к позиции консольного хирурга [27].
В послеоперационном периоде РА операций развилось 2 кровотечения: в одном случае – из троакарного отверстия, в другом – из маточной артерии. Сложно прокомментировать, почему данные осложнения не происходили при ЛС операциях, однако можно предположить, что в случае с троакарным отверстием РА стойка сильнее прижимает ткани, что приводит к отсроченным кровотечениям ввиду большей травматизации передней брюшной стенки.
В возникшей ситуации с маточной артерией, возможно, коагуляция биполярным диссектором менее надежна, чем коагуляция «умным» биполярным инструментом. В другом приведенном случае произошло повреждение общей подвздошной вены за счет «соскакивания» одной РА «руки» с другой вне поля зрения. Отсутствие ощущений от напряжения инструментов в этом случае сыграло значимо негативную роль. Следует отметить, что в объеме кровопотери в среднем не было никакой разницы между сравниваемыми группами.
В нашем исследовании не проводилось гемотрансфузий, описываемых в литературе [12, 13]. В одной из публикаций по поводу сравнения РА и ЛС операций в гинекологии также демонстрируется преобладание осложнений в РА группе [28]. Интересно сформулировано заключение в одном метаанализе [29], в который вошло 2115 пациенток. Приведены результаты, согласно которым операции в РА группе дольше на 29,5 мин, и авторы заявляют, что это статистически значимо. Но достоверность приводится и при сравнении объема кровопотери, где разница с преимуществом в РА группе составила 86 мл, а общая кровопотеря составила до 150 мл в обеих группах. Часто при такой кровопотере ее объем формулируется как «минимальный».
При РА операциях конверсии происходили реже, чем при ЛС. В настоящее время конверсия доступа может быть трактована как крайне нежелательное явление, причина которого – неправильный отбор пациентов для конкретной операции. В представленном нами исследовании конверсий удалось избежать.
Интересно отметить специфические особенности РА операций по сравнению с традиционной лапароскопией. ЛС хирургия имеет ряд недостатков, связанных с наличием двухмерного изображения, ограниченного диапазона движения инструментов. В РА системе эти недостатки исключаются благодаря наличию трехмерного изображения, высокой четкости, хирургических инструментов с технологией EndoWrist, которая увеличивает амплитуду движения инструментов (7 степеней свободы движения), позволяет выполнять изгиб инструмента на 90°, стабилизирует движения и уменьшает тремор. Однако в нашем исследовании это свойство продемонстрировало преимущество только в 1 случае.
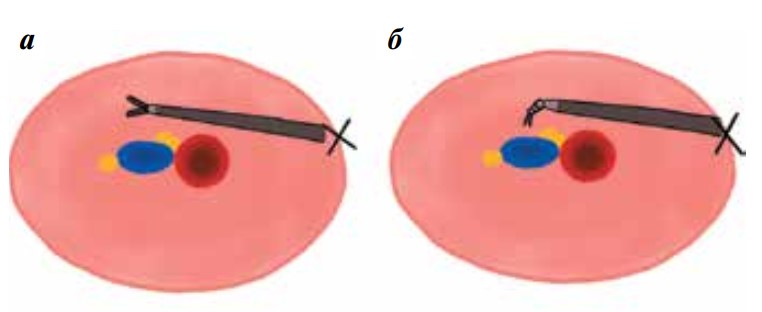 Рис. 3. Положение лапароскопического инструмента при попытке
Рис. 3. Положение лапароскопического инструмента при попытке
паракавальной
лимфаденэктомии из левостороннего доступа при поясничной забрюшинной лимфаденэктомии (а) и
положение
инструмента для робот-ассистированных операций (б)
При выполнении забрюшинной ПЛАЭ при установке инструментов у пациентки слева при РА операции можно выполнить из этого доступа и аортокавальную, и паракавальную лимфодиссекцию, в отличие от ЛС операции, при которой за счет «прямых» инструментов вена находится дальше и ниже аорты, ко торая не позволяет адекватно манипулировать в проекции нижней полой вены (рис. 3).
Лучшая эргономика достигается также благодаря расположению хирурга в положении сидя, расположению рук хирурга на специальных подлокотниках [15].
Что касается перспектив, возможно, именно РА технологии вкупе с системами искусственного интеллекта позволят синергировать методы лучевой диагностики и хирургической визуализации и реализовать действительно малоинвазивные single-port-технологии [26, 30–32].
Выводы
Опираясь на собственный клинический опыт, вопреки общепринятому мнению можно утверждать, что ЛС операции по многочисленным показателям имеют ряд преимуществ перед РА. ЛС операции демонстрируют меньшую продолжительность выполнения, меньшее число периоперационных осложнений, а также более контролируемую обстановку в операционном поле. Наш опыт показывает, что РА хирургия в онкогинекологии находится в самом начале своего развития и имеет серьезный потенциал. Реальная и трезвая оценка ее характеристик определит правильное направление развития данной технологии в будущем.

