Способ формирования панкреатогастроанастомоза после панкреатодуоденальной резекции
Введение
Надежный панкреатодигестивный анастомоз (ПДА) – ключевой момент реконструктивного этапа панкреатодуоденальной резекции (ПДР), выполняемой при опухолях органов гепатопанкреатодуоденальной зоны [1–3]. Именно проблемы с ПДА являются основной причиной осложнений и летальных исходов среди больных этой категории [4, 5]. История формирования ПДА, безусловно, начинается с панкреатоэнтероанастомоза (ПЭА), когда в 1943 г. R.B. Cattell показал важность сшивания протока и слизистой кишки (duct-to-mucosa). В 1946 г. J.M. Wauch описал клиническое наблюдение панкреатогастроанастомоза (ПГА). В 60–70-х годах общая летальность после ПДР достигала 25–30%, в составе которой проблемы с ПДА играли не первую роль. К 90-м годам XX века, когда были устранены проблемы периоперационного ведения больных, устранения механической желтухи, техники отдельных этапов ПДР, выяснилось, что именно ПДА является “ахиллесовой пятой” всей операции [цит. по 4]. Именно несостоятельность этого анастомоза и связанные с ним осложнения оказывают наибольшее влияние на конечный результат операции [3, 5]. В связи с этим технике формирования ПДА и результатам применения различных его модификаций посвящено множество работ [1, 4, 6]. В них отмечено, что формирование ПГА имеет некоторое преимущество перед ПЭА, особенно при “неадаптированной”, рыхлой поджелудочной железе (ПЖ) [7]. В последние годы в повседневную практику активно внедряют лапароскопическую и роботизированную ПДР. Такой подход сталкивается с определенными сложностями формирования ПДА в необычных условиях. В связи с внедрением миниинвазивной ПДР вопрос о технике анастомоза возник перед хирургами с новой стороны.
Цель работы – оценка воспроизводимости и безопасности запатентованного ПГА при различных вариантах ПДР.
Материал и методы
С марта 2019 г. по февраль 2021 г. выполнено ретроспективно-проспективное одноцентровое когортное исследование, в которое включили 47 пациентов со злокачественными новообразованиями (ЗНО) периампулярной зоны, перенесших ПДР. Исследование одобрено Этическим комитетом научных исследований Кубанского ГМУ (Ethics Approval Ref. No 7-04/20). Критерием включения пациентов в исследование считали клинически либо гистологически установленный диагноз злокачественной опухоли головки ПЖ или периампулярной зоны, которым вы- полнили ПДР. Критериями невключения были противопоказания к ПДР: ASA III–V, признаки острого панкреатита до операции при УЗИ или КТ. Критериями исключения считали операцию R1, что требовало полного удаления железы, интраоперационное получение данных об отдаленных метастазах, “плотную” паренхиму ПЖ при широком протоке ПЖ (ППЖ).
Все операции выполняла одна команда хирургов по технике “no-touch” со стандартной лимфаденэктомией [8]. Выбор ПДА зависел от плотности паренхимы ПЖ и от диаметра ППЖ. Для индивидуализации выбора вида ПДА использовали коэффициент накопления, основанный на изменении контрастирования паренхимы ПЖ при КТ [9]. По этому признаку было два варианта состояния ее ткани: плотная и мягкая. При плотной ПЖ с коэффициентом накопления контрастного препарата <1, а также при расширенном ППЖ >7 мм формировали двухрядный ПЭА duct-to-mucosa методом Cattell в модификации S. Strasberg (2002) [10]. Таких пациентов было 36. От ПЭА отказывались при мягкой ПЖ, когда коэффициент накопления контрастного препарата был >1, а также при узком ППЖ <3 мм. В такой ситуации выполняли инвагинационный ПГА по Bassi (2006) [11]. При диаметре протока 3–7 мм и мягкой железе формировали ПГА, а при плотной – ПЭА. Учитывая комфортные условия формирования ПЭА при плотной ПЖ и результаты, существенно не отличающиеся от большого числа опубликованных работ [1, 3, 5, 7], дальнейший анализ пациентов с ПЭА в этой работе не проводили. Периоперационное ведение пациентов осуществляли в рамках протоколов ERAS и FAST- TRACK, предполагающих единый подход к предоперационной подготовке, технике оперативного вмешательства, послеоперационного ведения больных и минимальному вмешательству в физиологические процессы [8]. С целью профилактики [8, 9] послеоперационного панкреатита культи поджелудочной железы и послеоперационных панкреатических свищей всем пациентам с момента начала манипуляций на поджелудочной железе вводился отреотид из расчета 100–120 мкг/сут. Длительность введения и дозировка октреотида в послеоперационном периоде определялись по уровню амилолитической активности отделяемого по дренажу, подведенном к культе поджелудочной железы.
Предлагаемый способ формирования панкреатогастроанастомоза. Развивая хирургическую технику и выполняя ПДР лапароскопическим доступом или в робот-ассистированном варианте, столкнулись со значительными трудностями формирования ПГА по Bassi. Это отразилось как на увеличении продолжительности операции, так и на надежности анастомоза, о чем подробнее сказано в разделе “Результаты”. Такая ситуация потребовала разработки нового способа формирования ПГА. Новый способ формирования ПГА при робот-ассистированной и лапароскопической (мПГА+) ПДР включал наложение шва-держалки на атравматичной игле с рассасывающейся нитью на культю ПЖ (рис. 1). Этот шов фиксировали за верхний и нижний края культи. При этом формировали петлю, за которую в дальнейшем осуществляли дозированную тракцию. Далее напротив культи ПЖ рассекали заднюю стенку желудка в поперечном направлении на 1/3 площади среза культи ПЖ. Такое несоответствие размеров необходимо для обеспечения герметичности последующего анастомоза, но именно оно приводит к сложности заведения культи ПЖ в просвет желудка. После этого фиксировали проксимальную полуокружность га- стротомного отверстия к передней поверхности ПЖ (рис. 2). Затем назогастральный зонд 4,5– 5,1 мм с пластиковым проводником проводили через гастротомное отверстие в брюшную полость. После этого подтягивали проводник до ближайшего отверстия зонда. В это отверстие заводили петлю шва-держалки, фиксировали ее, низводили проводник обратно в зонд под контролем зрения (рис. 3). Культю ПЖ умеренно подтягивали за зонд на 4–5 см в проксимальном направлении (рис. 4), инвагинируя ее в просвет желудка (рис. 5). Нитью, которой пришивали проксимальную полуокружность гастротомного отверстия к передней поверхности ПЖ, продолжали в обратном направлении по задней поверхности ПЖ (рис. 6). В итоге получался однорядный циркулярный ПГА. Петлю-держалку из рассасывающегося материала освобождали путем извлечения пластикового проводника из зонда. На предложенный способ формирования ПГА получен патент на изобретение [12].
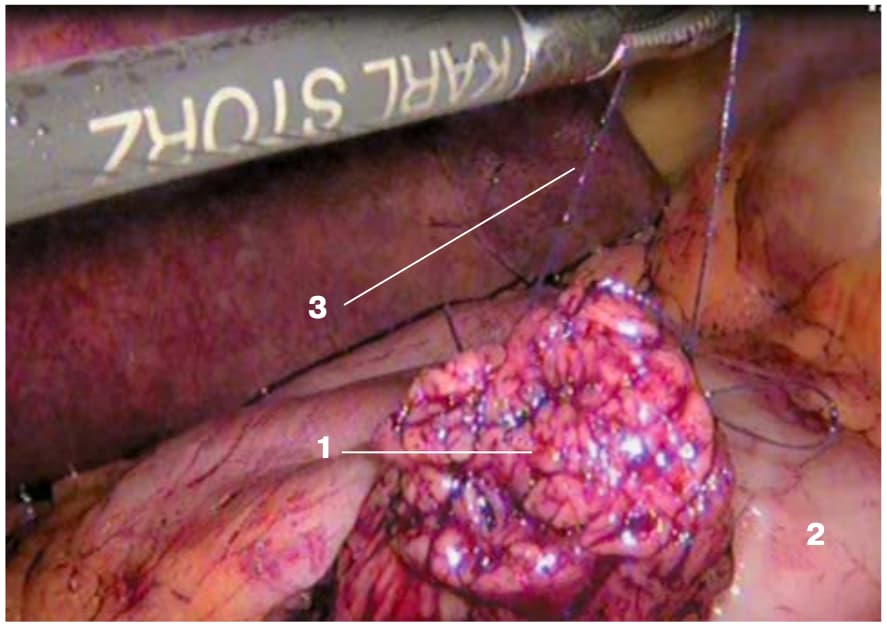 Рис. 1. Интраоперационное эндофото. Мобилизованная культя ПЖ. Здесь и далее: 1 – культя ПЖ; 2 – задняя стенка желудка; 3 – шов-держалка на культе ПЖ; 4 – назогастральный зонд; 5 – нерассасывающаяся нить, которой сформирован анастомоз.
Рис. 1. Интраоперационное эндофото. Мобилизованная культя ПЖ. Здесь и далее: 1 – культя ПЖ; 2 – задняя стенка желудка; 3 – шов-держалка на культе ПЖ; 4 – назогастральный зонд; 5 – нерассасывающаяся нить, которой сформирован анастомоз.
Fig. 1. Intraoperative endoscopic photo. The mobilized stump of the pancreas. Here in after:1 – the stump of the pancreas; 2 – the posterior wall of the stomach, 3 – the formed suture- holder on the stump of the pancreas; 4 – nasogastric tube; 5 – nonabsorbable suture with which the anastomosis is formed.
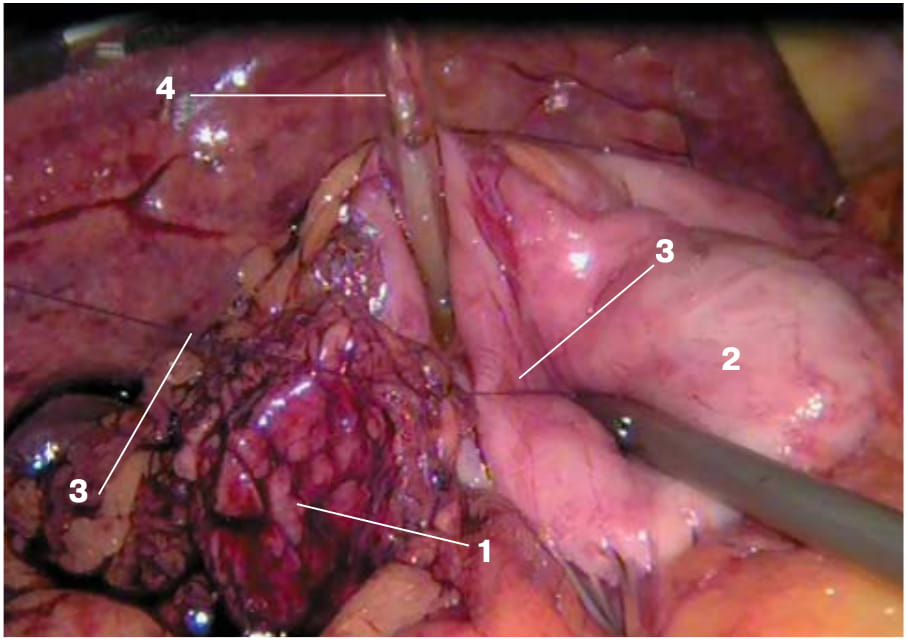 Рис. 2. Интраоперационное эндофото. Этап формирования передней полуокружности соустья непрерывным швом.
Рис. 2. Интраоперационное эндофото. Этап формирования передней полуокружности соустья непрерывным швом.
Fig. 2. Intraoperative endoscopic photo. The formation of the anterior semicircle of the anastomosis with a continuous suture.
Новый ПГА показал хорошие клинические результаты, поэтому его стали применять и при открытых ПДР (оПГА+). Так были сформированы группы сравнения для последующей статистической обработки. Все 47 пациентов с ПГА, вошедшие в исследование, были разделены на 4 группы. Первую группу (оПГА) составили 24 (51,1%) пациента, которым при ПДР лапаротомным доступом был сформирован ПГА по Bassi. Вторую группу (мПГА) составили из 9 (19,1%) пациентов, которым выполнена миниинвазивная ПДР и сформирован ПГА из мини-доступа по Bassi. Третья группа (мПГА+) насчитывала 7 (14,9%) больных, которым выполнена миниинвазивная ПДР с разработанным ПГА. Четвертая группа (оПГА+) – 7 (14,9%) пациентов, которым выполнена открытая ПДР с разработанным ПГА. При оценке результатов операций учитывали способ включения культи ПЖ в желудочно-кишечный тракт (по Bassi, предложенный способ), открытую или мининвазивную технику формирования соустья, продолжительность вмешательства, объем интраоперационной кровопотери. Послеоперационные осложнения оценивали по частоте развития панкреатических свищей (ISGPF), числу повторных вмешательств, госпитальной послеоперационной летальности. Демографические и клинические данные пациентов, интраоперационные находки в разных группах были сопоставимы. Для оценки значимости различий нескольких относительных показателей применяли критерий χ2 Пирсона с поправкой Йейтса на непрерывность. Его значение сравнивали со стандартным [df = 1] при 5%-ном уровне значимости, поскольку ожидаемое число наблюдений в некоторых ячейках было меньше 5 [13]. Статистический анализ выполняли с применением программного обеспечения IBM SPSS Statistics 26.
Результаты
Большинство пациентов первично госпитализировали с признаками механической желтухи (42 – 89,4%). В соответствии с принятым в клинике дифференцированным подходом [14], выполняли антеградное чрескожное чреспеченочное дренирование желчных протоков. За время, требовавшееся на уменьшение гипербилирубинемии, больных обследовали и готовили к радикальному хирургическому вмешательству. До операции ЗНО верифицировано морфологически у 13 (27,1%) пациентов. Результаты операций представлены в таблице. При выполнении ПДР лапаротомным доступом (оПГА+) новый анастомоз показал статистически значимое преимущество по продолжительности операции (223 ± 92 мин) по сравнению с методом Bassi (273 ± 81 мин). Это происходило за счет удобства быстрого способа инвагинации ПЖ в просвет желудка, однорядного анастомоза (по Bassi – двухрядный). Продолжительность операции при формировании мПГА оказалась максимальной из всех четырех групп и составила 387 ± 75 мин, что статистически значимо больше продолжительности операций при формировании ПГА открытым доступом и мПГА+ (р < 0,05). Это связано с большей трудоемкостью способа Bassi при миниинвазивной ПДР. Значимых различий в кровопотере при формировании различных видов анастомозов не было (р > 0,05). При использовании предложенного способа при мини-инвазивной и при открытой ПДР панкреатических свищей не было. Повторные вмешательства этим пациентам не потребовались. Панкреатический свищ наблюдали у 4 (16,7%) пациентов после оПГА. Этот показатель был значимо хуже в группе мПГА – 7 (77,8%). Такие результаты указывают на несовершенство метода Bassi, связанного с большим повреждением ПЖ при трудной инвагинации ее в просвет желудка и двухрядным швом паренхимы, приводящим к большему объему ее некроза. По этим признакам запатентованный способ выгодно отличается. Значимо отличалось число повторных операций. После оПГА они понадобились 3 (12,5%) пациентам, а после ПГА – 4 (44,4%). Отмечено 2 (22%) летальных исхода – только в группе мПГА; все остальные пациенты были выписаны. Статистическую значимость различий между методом Bassi и оригинальным способом сравнивали по частоте формирования панкреатического свища, повторных вмешательств и летального исхода. При сопоставлении мПГА и мПГА+ значение эмпирического χ2 для частоты панкреатического свища составило 7,54, для повторных вмешательств – 3,15, для летального исхода – 1,00. При сравнении оПГА и оПГА+ по частоте тех же явлений χ2 составил 2,75, 1,7 и 0. Большинство вычисленных значений было меньше стандартного значения χ2 Пирсона, которое при 5%-ном уровне значимости [df = 1] составляет 3,84. Это свидетельствует об отсутствии значимых различий между способами по частоте большинства учитываемых в опыте событий. Исключение составила частота панкреатического свища в результате применения двух сравниваемых методов при мини-инвазивной ПДР: при мПГА она была достоверно больше (χ2 = 7,54), чем при мПГА+.
Обсуждение
Несмотря на продолжающиеся дискуссии о выборе ПГА или ПЭА, анастомоз ПЖ с желудком имеет определенные преимущества [8, 15, 16]. Во-первых, интенсивное кровоснабжение стен- ки желудка способствует заживлению анастомоза. Во-вторых, анастомоз не ограничен размером панкреатической культи ввиду хорошей эластичности стенки желудка. В-третьих, риск развития тяжелого послеоперационного панкреатичес- кого свища (ПОПС; postoperative pancreatic fistula – POPF) меньше вследствие инактивации панкреатина в кислой среде желудка [16]. Среди недостатков ПГА указывают внешне- секреторную панкреатическую недостаточность ввиду уменьшения активности ферментов в кислой желудочной среде на фоне и без того нарушенной после ПДР нейрогуморальной регуляции [17–19]. Кроме того, после панкреатогастростомии кровотечение в просвет желудочно-кишечного тракта развивается значительно чаще, чем после панкреатоеюностомии. По-видимому, это происходит вследствие агрессивного воздействия желудочного сока с низким рН на тромбы в сосудах на срезе культи ПЖ [17, 19]. Существует гипотеза, что открытая культя ПЖ в просвете желудка подвергается продолжительной эрозии желудочным соком, что может привести к развитию панкреатического некроза с фиброзом и последующим рубцовым стенозом ППЖ [18]. Зачастую потребность в выполнении именно ПГА продиктована сложными, порой драматическими интраоперационными условиями, когда просвет ППЖ крайне мал, его не удается катетеризировать капиллярной трубкой, а ткань ПЖ весьма рыхлая и прорезается буквально каждый шов. В такой ситуации ПГА является методом выбора. Непривлекательной альтернативой может быть исходное формирование наружного панкреатического свища без формирования анастомоза. Мини-инвазивные ПДР не так давно вошли в хирургическую практику, но они показали возможности более ранней реабилитации пациента. Однако выяснилось, что метод Bassi для мини-инвазивной ПДР крайне трудоемок, увеличивает время операции, ведет к большому числу осложнений в виде ПОПС, сопровождается большей послеоперационной летальностью. Небольшой собственный опыт мини-инвазивного выполнения ПДР с ПГА по запатентованной методике свидетельствует об улучшении ближайших послеоперационных результатов лечения этой категории пациентов. Получив представленные результаты, отказались от применения метода Bassi для мини-инвазивной ПДР. Эти данные также указывают на преимущество выполнения ПГА предложенным способом и при традиционной ПДР.
Заключение
Предложенный способ включения культи ПЖ в желудочно-кишечный тракт после ПДР может найти широкое применение в клинической практике. Способ позволяет достаточно быстро создавать надежный и простой ПГА как при открытом вмешательстве, так и при ПДР мини-инвазивным доступом. При сравнительном анализе запатентованный способ показал клинические характеристики, выгодно отличающие его от анастомоза по Bassi. Использование метода при мини-инвазивной ПДР позволило избежать развития ранних послеоперационных осложнений, обусловленных несостоятельностью ПГА при мягкой ПЖ и, как следствие, уменьшить послеоперационную летальность, а также обеспечить удовлетворительное качество жизни пациентов.
Участие авторов
- Лищишин В.Я. – концепция и дизайн исследования, сбор и обработка материала, статистическая об-работка данных;
- Барышев А.Г. – концепция и дизайн исследования, редактирование, утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи;
- Петровский А.Н. – концепция и дизайн исследования, сбор и обработка материала, написание текста;
- Лищенко А.Н. – концепция и дизайн исследования, сбор и обработка материала, написание текста, редактирование;
- Попов А.Ю. – редактирование, утверждение окончательного варианта статьи;
- Порханов В.А. – концепция и дизайн исследования, утверждение окончательного варианта статьи.








