Робот-ассистированные операции в хирургической панкреатологии
Операции на поджелудочной железе (ПЖ) являются одними из наиболее сложных в абдоминальной хирургии. Прилежание ПЖ к магистральным ветвям аорты и воротной вены, высокая ферментативная активность органа обусловливают интраоперационные сложности и высокий риск послеоперационных осложнений 1, 2.
Для обеспечения оптимальных условий операции традиционно используется широкий лапаротомный доступ. С появлением возможности лапароскопического способа оперирования эта технология медленно, но неуклонно внедряется при операциях на ПЖ 3, 4. Следующим шагом в развитии мини-инвазивной хирургии явилась разработка роботического комплекса da Vinci 5, 6.
Цель сообщения: изложение технических аспектов и наибольшего в России опыта выполнения робот-ассистированных операций на ПЖ
Материалы и методы
В ФГБУ «Институт хирургии им. А. В. Вишневского» за период с 2009 г. по май 2017 г. было выполнено 86 робот-ассистированных операций на ПЖ. Операции проводились с помощью роботического хирургического комплекса da Vinci S. Среди прооперированных было 70 (81,4%) женщин и 16 (18,6%) мужчин. Средний возраст больных составил 49 (37; 59) лет и варьировал от 18 до 73 лет.
Предоперационное обследование включало компьютерную и магнитно-резонансную томографию, УЗИ, в том числе эндосонографию для точной оценки характеристик опухоли и ее взаимоотношений с ветвями чревного ствола и воротной вены.
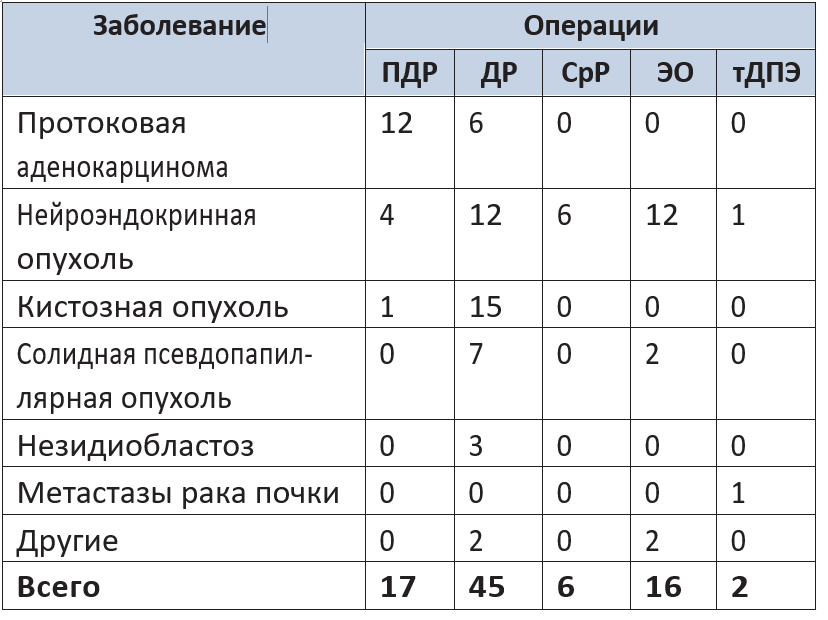
В число операций входили 17 панкреатодуоденальных и 45 дистальных резекций ПЖ, 16 энуклеаций опухолей, 6 срединных резекций, 2 тотальные дуоденумпанкреатэктомии. Характер заболеваний и выполненных операций отражен в таблице 1.
Таблица 1. Заболевания и объем выполненных робот-ассистированных операций
Результаты
Результаты оперативного лечения представлены в таблицах 2 и 3.
Таблица 2. Результаты робот-ассистированных операций на поджелудочной железе
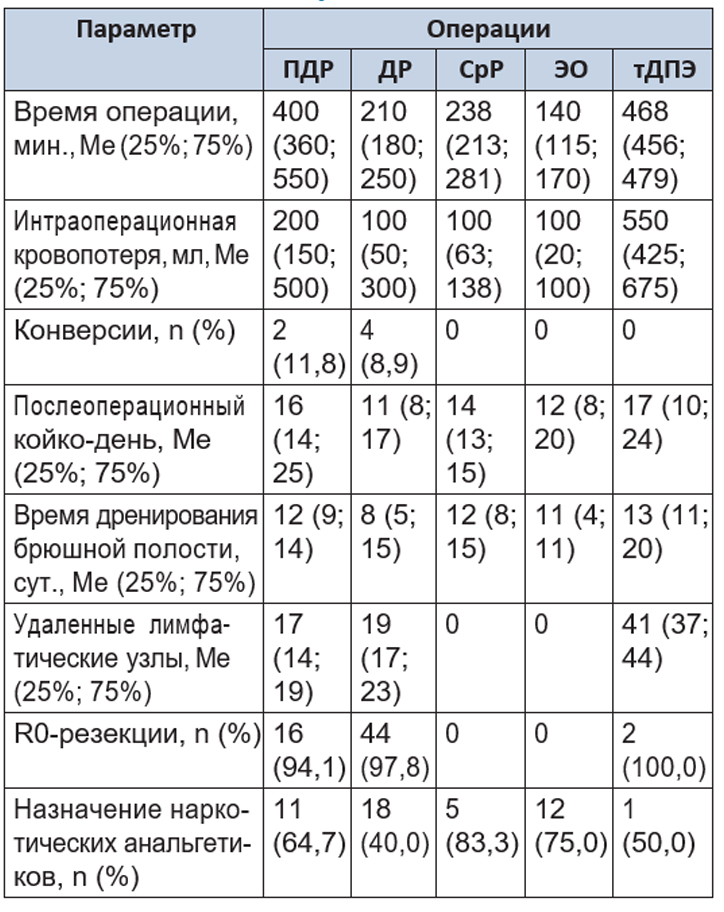
Таблица 3. Послеоперационные осложнения, n (%)
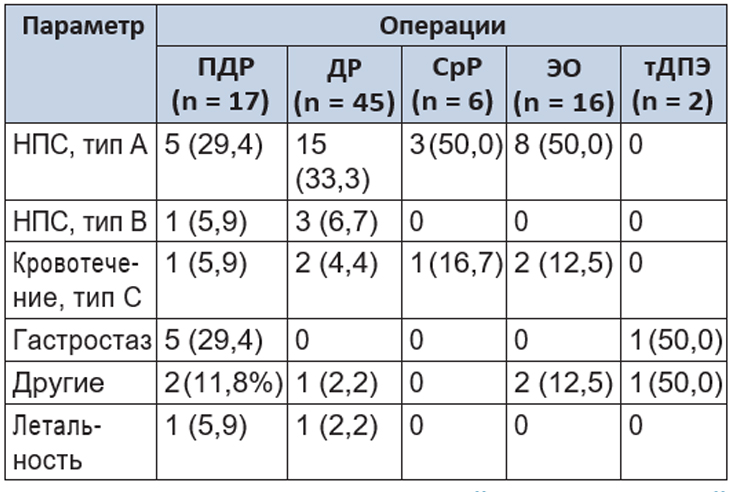
Примечание: В таблицах 1–3: ПДР — панкреатодуоденальная резекция; ДР — дистальная резекция; СрР — срединная резекция; ЭО — энуклеация опухоли; тДПЭ — тотальная дуоденумпанкреатэктомия; НПС — наружный панкреатический свищ.
Панкреатодуоденальная резекция выполнена 17 больным. Продолжительность операции варьировала от 305 до 670 минут и составила в среднем 400 минут. Первая резекция заняла 670 минут, с накоплением опыта время оперативного вмешательства сокращалось. Интраоперационная кровопотеря колебалась в пределах 100–700 мл. Потери крови возникали за счет капиллярного кровотечения при удалении лимфатических узлов.
Потребовались две конверсии на открытое вмешательство: в первом случае за счет инвазии опухоли в верхнюю брыжеечную вену, во втором — за счет воспалительной инфильтрации гепатодуоденальной связки после выполненного ранее антеградного дренирования.
Послеоперационные осложнения развились у 6 больных. Длительная лимфорея зафиксирована в одном случае. Послеоперационный панкреатит, осложненный наружным панкреатическим свищем, был у 6 больных (во всех наблюдениях операции выполнены при «мягкой» ПЖ). На фоне панкреатита гастростаз развился у 5 пациентов. В одном наблюдении на фоне послеоперационного панкреатита и наружного панкреатического свища возникло аррозионное кровотечение, которое привело к летальному исходу.
Дистальная резекция ПЖ выполнена 45 больным. Операции продолжались от 90 до 320 минут. Интраоперационная кровопотеря варьировала в пределах 50–400 мл.
Переход на открытое вмешательство потребовался у 4 пациентов. Причинами явились прорастание протоковой аденокарциномы в фасцию Герота у 2 больных, большой размер нейроэндокринной опухоли у одной больной, кровотечение из селезеночной вены, развившееся в одном наблюдении. В последнем случае вена была прижата зажимом, введенным через ассистентский порт, и без удаления зажима была выполнена лапаротомия в левом подреберье длиной 10 см.
Дистальная резекция с сохранением селезенки удалась у 28 больных с опухолями низкого потенциала злокачественности. При этом резекция селезеночных сосудов потребовалась в 5 случаях, признаков нарушения кровообращения в селезенке в послеоперационном периоде не было. Спленэктомия выполнена 17 пациентам: в 10 наблюдениях селезенку удаляли в связи с наличием или подозрением на наличие злокачественной опухоли; у 7 пациентов причиной спленэктомии послужила плотная фиксация селезеночных сосудов к опухоли, располагавшейся в воротах селезенки.
Осложнения после дистальных резекций отмечены у 18 больных, чаще всего наблюдались наружные панкреатические свищи типов А и В. На фоне панкреатита и панкреатического свища у 2 больных произошло внутрибрюшное аррозионное кровотечение, которое было остановлено эндоваскулярным способом. Имелся один летальный исход после дистальной резекции вследствие тяжелого послеоперационного панкреатита.
Срединная резекция ПЖ выполнена 6 больным с нейроэндокринными опухолями ПЖ. Операции характеризовались небольшой продолжительностью (от 210 до 290 минут) и малой кровопотерей (не более 150 мл).
В послеоперационном периоде не удалось избежать послеоперационного панкреатита и панкреатических свищей у 3 больных и аррозионного кровотечения типа С у одной пациентки. Свищи закрылись самостоятельно. Для остановки кровотечения потребовалась лапаротомия. Летальных исходов не было.
Энуклеация опухоли ПЖ выполнена 16 больным. Продолжительность операции определялась расположением опухоли. При локализации по передней поверхности железы ее удаление не занимало более 70–90 минут, из которых часть времени занимало интраоперационное лапароскопическое УЗИ. Расположение опухоли по задней поверхности железы существенно удлиняло операцию, поскольку требовалась мобилизация органа. Объем кровопотери был минимальным — 50–150 мл.
У 6 больных осложнения были представлены послеоперационным панкреатитом с формированием панкреатических свищей типа А. У одной больной на фоне свища присоединилась пневмония, у другой свищ привел к формированию абсцесса сальниковой сумки. Без клинических проявлений панкреатита панкреатический свищ возник в 2 случаях. Кровотечения у 2 больных были остановлены эндоваскулярным способом. Летальных исходов в этой группе не отмечено.
Тотальная дуоденумпанкреатэктомия со спленэктомией произведена 2 больным: в первом случае по поводу множественных метастазов почечно-клеточного рака, во втором — в связи с множественными нейроэндокринными опухолями ПЖ и двенадцатиперстной кишки. В послеоперационном периоде у одной больной возникла несостоятельность гепатикоеюноанастомоза, сформировался наружный желчный
свищ, который впоследствии закрылся самостоятельно.
Обсуждение
Использование роботического комплекса в хирургической панкреатологии является очередным шагом в развитии
мини-инвазивной хирургии. На данный момент робот-ассистированные операции на ПЖ выполняются в немногих крупных хирургических клиниках мира. Основными показаниями к операциям являются злокачественные и доброкачественные опухоли ПЖ. Прорастание опухоли в верхнюю брыжеечную вену рассматривается как противопоказание к мини-инвазивным способам выполнения операции 6–9. При осложнениях хронического панкреатита мини-инвазивные резекционные операции практически не выполняют 6–9. Мы также сдержанно относимся к робот-ассистированным операциям у этой категории больных ввиду сложности интраоперационного гемостаза при резекции паренхимы головки ПЖ и затруднений при определении адекватного объема резекции головки органа.
Наиболее частой робот-ассистированной операцией на ПЖ является панкреатодуоденальная резекция. R. Cirocchi и соавт. при анализе литературы за период с 2003 по 2012 г. сообщили о 207 таких роботических операциях 10. По мнению всех хирургов, выполняющих эту операцию, показаниями к ней являются злокачественные опухоли Т1 и Т2. Роботический комплекс использовали как на отдельных этапах операции (мобилизационном или реконструктивном), так и в полном объеме 6–8, 11. В нашей стране опухоли головки ПЖ на стадиях Т1 и Т2 диагностируют достаточно редко, вследствие чего вмешательство удается выполнить нечасто. В результате накопление материала, необходимого для проведения статистического исследования, растягивается на длительное время.
Дистальная резекция ПЖ также является частым вмешательством с использованием роботического комплекса. К концу 2016 г. было представлено 426 случаев успешного выполнения этой операции по поводу протоковой аденокарциномы, нейроэндокринных и других опухолей ПЖ 12–14. Средний возраст пациентов, перенесших робот-ассистированную дистальную резекцию, — 58,2 года. Наиболее часто это вмешательство выполняли по поводу нейроэндокринных неоплазий или кистозных опухолей ПЖ 10–14.
Принцип no touch при роботических операциях не применяют, что, на наш взгляд, с онкологической позиции является слабым местом технологии. Мы в своей практике первоначально пересекаем артерии и вены, обеспечивающие кровообращение в удаляемых тканях, и лишь после этого приступаем к мобилизации комплекса.
При овладении техникой роботических операций на ПЖ мы столкнулись с целым рядом технических трудностей, не характерных для открытого варианта операции. Основная проблема связана с достижением гемостаза. При традиционном способе оперирования хирург обеспечивает гемостаз из мелких сосудов с минимальной потерей времени, не теряя ориентации в хирургическом поле. При роботической операции даже незначительное количество крови, поступающее из мелкого сосуда, «закрывает» поле зрения, существенно ухудшает видимость. Для обнаружения кровоточащего сосуда требуется дополнительное время, что увеличивает объем кровопотери. Для исключения возникновения кровотечения при роботических операциях диссекция тканей, даже выполняемая в бессосудистых зонах межфасциальных пространств, требует использования коагуляции и работы с малыми порциями тканей, что увеличивает продолжительность вмешательства.
Преимущества роботического варианта оперативного вмешательства утрачиваются в тех ситуациях, когда размеры злокачественной опухоли превышают 2–3 см, имеется прорастание опухоли за пределы фасции Трейтца — Тольда. Поэтому мы считаем, что робот-ассистированные операции целесообразно выполнять при опухолях, соответствующих Т1–Т2. В то же время при опухолях головки ПЖ небольшого размера, как правило, не успевает развиться атрофия (склероз) паренхимы железы, отсутствует панкреатическая гипертензия. Таким образом, операция производится на «мягкой» железе, что существенно увеличивает риск послеоперацион- ного панкреатита 15, 16.
При доброкачественных опухолях тела или хвоста ПЖ хирурги высокой квалификации стремятся выполнить дистальную резекцию ПЖ с сохранением селезенки, что превращает операцию в ювелирную работу.
Сдерживающим фактором для робот-ассистированной дистальной резекции ПЖ при доброкачественных опухолях является размер новообразования. Смещение и мобилизация больших объемов тканей роботическими инструментами затруднены по нескольким причинам. Во-первых, ограничен обзор задней части опухоли. Во-вторых, приложение повышенных усилий к браншам инструментов при смещении опухоли вследствие их небольшой рабочей площади приводит к появлению режущего эффекта, что способствует повреждению капсулы опухоли. Наконец, для извлечения препарата из брюшной полости требуется большой разрез брюшной стенки, что уменьшает эффект малой травматичности операции 16–18.
Ситуации, при которых выполняют энуклеацию и срединные резекции ПЖ, в клинической практике бывают нечасто, поэтому публикации о них немногочисленны 6, 7, 11.
По нашему мнению, при доброкачественных опухолях ПЖ малого размера, располагающихся на 3/4 своего объема экстраорганно и не ближе 2–3 мм от панкреатического протока, робот-ассистированные вмешательства со временем станут операцией выбора.
Заключение
Применение роботического комплекса в хирургии поджелудочной железы пока не нашло большого числа приверженцев, несмотря на то что комплекс является идеальным инструментом в руках хирурга и обеспечивает безопасное выполнение операций. Однако использование роботического комплекса не позволяет избежать специфических послеоперационных осложнений, характерных для открытых операций на поджелудочной железе.
Автор, ответственный за переписку:
Калдаров Айрат Радикович — врач-хирург отделения абдоминальной хирургии № 1 ФГБУ «Институт хирургии им. А. В. Вишневского» Минздрава России. E-mail: Ayratikus@gmail.com