Робот-ассистированные хирургические вмешательства в репродуктивной гинекологии. Собственный опыт
Введение
Применение первых роботических систем в хирургии началось в 70-х годах прошлого века в рамках военных задач, поддерживаемых Национальным управлением по аэронавтике и исследованию космического пространства (NASA) и субсидируемых Управлением перспективных исследовательских проектов в области обороны (DARPA). Основной задачей была замена реального присутствия оператора при оказании хирургической помощи астронавтам или солдатам в зонах военных действий [1]. С 80-х до конца 90-х годов прошлого века в практике использовали первое поколение роботических систем, однако их применение заметно ограничивалось существующими интерфейсами вычислительных систем, а также громоздкой процедурой предоперационной подготовки. Примерно в одно и то же время созданы и одобрены для использования Управлением по контролю за продуктами питания и лекарствами США (FDA) две роботические системы: платформа Zeus («Computer Motion», США) и хирургическая система da Vinci («Intuitive Surgical», США). В 2003 г. Intuitive Surgical поглотила Computer Motion, что привело к развитию корпоративной монополии на рынке хирургических роботов, ситуации, которая сохраняется до настоящего времени. После такого объединения совершенствование системы Zeus прекращено в пользу системы da Vinci. Последняя, в свою очередь, оснащена компактной платформой, движущейся на колесах, роботизированными операционными «лапами» и стереоскопической камерой vivid, имеющей возможность предоставлять 10-кратный увеличенный обзор для более точной навигации. Эргономика и степень контроля значительно улучшены благодаря манипуляторам, имитирующим движения человеческих рук EndoWrist innovation, разработанным компанией «Intuitive», США. В последнее время хирургическая система da Vinci усовершенствована и включила дополнительные опции, например, технологию ближнего инфракрасного излучения. Современная система da Vinci XiTM, выпущенная в 2014 г., менее массивна, а ее составные элементы тоньше и расположены более эргономично, что позволяет проводить мультиквадрантные процедуры без необходимости замены системы.
Опросы, проведенные вскоре после появления роботических систем в гинекологии, продемонстрировали, что 24% гинекологов США используют роботизированную хирургию, при этом 66% респондентов сообщили, что намерены расширить использование роботической техники в ближайшие годы [2, 3]. Несмотря на очевидный интерес специалистов к использованию роботической техники, ее широкое применение ограничено, в первую очередь, доступностью приобретения подобной системы [3—5].
К концу 2019 г., по данным производителя, в мире установлено более 5 500 роботических систем и выполнено более 3 млн операций. Основными направлениями применения роботических установок являются урология и гинекология, в последнее время увеличивается доля применения данного метода в общей хирургии (рис. 1).
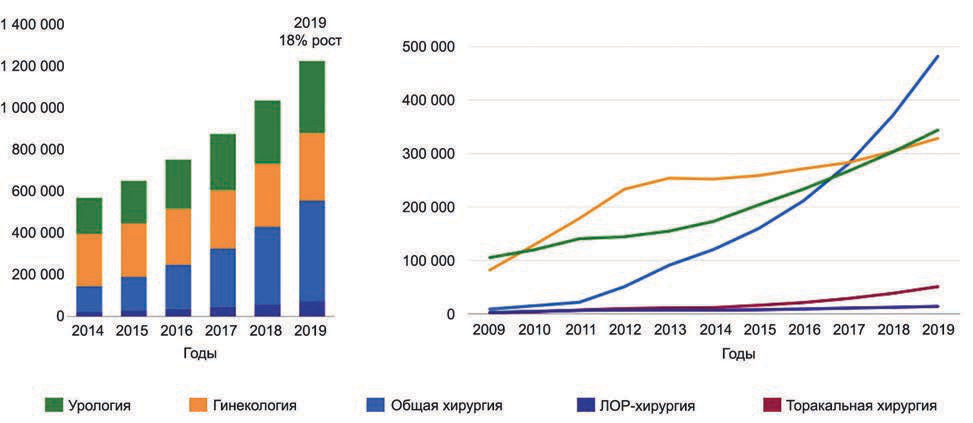 Рис. 1. Развитие роботической хирургии и основные сферы ее применения.
Рис. 1. Развитие роботической хирургии и основные сферы ее применения.
В Российской Федерации первая роботическая установка появилась в 2007 г. На сегодняшний день в 30 клиниках по всей России установлено суммарно 33 роботические системы, выполнено более 23 000 операций с применением робототехники. В ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России первая роботическая система установлена в 2011 г.
Цель исследования — оценить преимущества и возможные ограничения использования роботической хирургии, вероятные пути дальнейшего применения при основных нозологических формах гинекологических заболеваний, являющихся показанием к выполнению оперативных вмешательств у девочекподростков и женщин в возрасте от 13 до 49 лет.
Материал и методы
Выполнен ретроспективный анализ случаев роботических операций у женщин репродуктивного возраста за период 2011—2021 гг. на базе ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России. Проанализированы средняя продолжительность операции, объем кровопотери, сроки госпитализации. Оценены субъективные впечатления применения роботической системы при различных типах вмешательства на органах малого таза.
Результаты
Всего в период 2011—2021 гг. проведено 446 оперативных вмешательств у женщин, в том числе 42 операции у девочек-подростков в возрасте 13—17 лет (рис. 2).
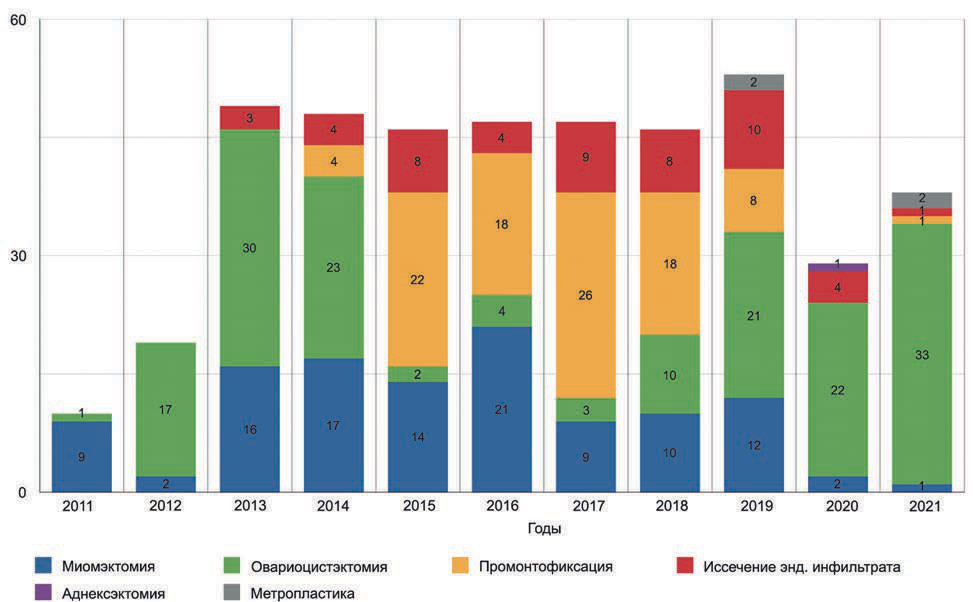
Рис. 2. Основные группы гинекологических оперативных вмешательств, выполненных в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России в период 2011—2021 гг.
Определены следующие показания к оперативному лечению:
- распространенный наружный генитальный эндометриоз с преимущественным поражением обоих яичников, поражением тазовой брюшины, стенки мочевого пузыря, мочеточников, в том числе с наличием ретроцервикальных инфильтратов;
- билатеральное поражение яичников доброкачественными опухолями (тератома, эндометриома);
- мочеполовые свищи различной локализации;
- множественные миомы матки с расположением миоматозных узлов в труднодоступных областях, а также в ситуациях, когда требуется реконструкция стенки матки, маточных труб;
- врожденные аномалии развития внутренних половых органов, опущение и выпадение матки и стенок влагалища; гидросальпинкс; несостоятельность рубца после кесарева сечения;
- опущение и выпадение матки и стенок влагалища; —забор фрагмента кортекса яичника с целью последующей криоконсервации.
Пациентки разделены на группы в зависимости от заболевания, послужившего показанием к оперативному вмешательству.
1-я группа — операции при опухолях яичников (n=166). Выполнено 166 оперативных вмешательств при доброкачественных опухолях яичников. Средняя продолжительность операции 95±20 минут, средний объем кровопотери 40±20 мл. Длительность пребывания пациенток в стационаре 3,8±0,2 дней (см. таблицу).
2-я группа — операции при эндометриозе. Общее количество оперированных — 51 женщина. В клинике ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России наружный генитальный эндометриоз занимает важное место в структуре роботических операций. Так, только в 2021 г. выполнено 33 операции по поводу эндометриомы яичника. Среднее время операции в этих случаях составило 95±20 мин, объем интраоперационной кровопотери 40±20 мл. Срок послеоперационного пребывания в стационаре составил 3,8±0,2 дня.
Применение роботической системы ассистенции обеспечивало наиболее тщательное выделение эндометриомы с сохранением здоровой ткани яичника. Кроме того, роботическая система облегчала процесс ушивание яичника, что в свою очередь позволило минимизировать коагуляционный гемостаз, негативно сказывающийся на овариальном резерве.
Неглубокие эндометриодные гетеротопии мочевого пузыря и мочеточника удаляли простым иссечением или фульгурацией. Глубокие поражения, например, такие как в случае инвазии детрузорной мышцы мочевого пузыря или мышечного слоя, собственной пластинки или просвета мочеточника, служат показанием к широкой резекции и наложению анастомозов. При подобных операциях тщательная диссекция с целью выделения мочеточника и наложения швов для анастомоза резецированного мочеточника были наиболее важными этапами лечения.
3-я группа — операции при миоме матки. Число пациенток с миомой матки — 113 человек. Средняя продолжительность операции в этой группе составила 130±30 мин, объем интраоперационной кровопотери — 150±50 мл, а средняя длительность госпитализации — 5±1 день. Очевидным преимуществом роботического подхода при лечении миомы являлась более высокая маневренность рабочих инструментов по сравнению с лапароскопией. Это отчетливо проявлялось при ушивании ложа миоматозного узла, поскольку в этом случае требовалось обеспечить надежный гемостаз путем наложения швов при высокой степени визуализиации и четкого совмещения границ слоев миометрия. Гибкость и интуитивность рабочих инструментов ускорял процесс наложения швов, особенно у хирургов с ограниченным опытом лапароскопии.
Среди вероятных недостатков метода следует выделить ограниченность поля зрения, а также невозможность использования морцеллятора у пациенток с крупными миомами.
4-я группа — операции при генитальном пролапсе. У пациенток данной группы оперативные вмешательства преимущественно сводились к промонтофиксации. Всего выполнено 96 операций. Средняя продолжительность операции — 122±24 минуты, объем кровопотери — 55±18 мл. Среди преимуществ метода следует вновь отметить гибкость используемых инструментов, которая отчетливо проявляется при наложении швов и манипуляциях с тканями. Вместе с тем преимущества роботического подхода «уравновешиваются» сопутствующими экономическими расходами.
5-я группа — реконструктивные операции. Выполнено 19 оперативных вмешательства, среди которых 3 — сальпингостоматопластика, 3 — коррекция маточно-пузырного свища, 3 — коррекция пороков развития тела матки, 10 — коррекция несостоятельного рубца после операции кесарева сечения. Средняя продолжительность операций — 168±29 минут, объем кровопотери — 43±6 мл. При проведении сальпингостоматопластики с применением роботического метода можно было использовать очень тонкий шовный материал (4/0, 5/0), что способствовало максимальной функциональной полноценности маточной трубы в дальнейшем. То же можно сказать об операциях коррекции истонченных несостоятельных рубцов после кесарева сечения. Особенно в случае повторной хирургической коррекции проявлялись оптимальные возможности роботической системы. Основной проблемой хирургических вмешательств при врожденном пороке тела матки (функционирующий рудиментарный рог с интерстициальным расположением) стало определение границы между двумя половинами матки. Более того, после иссечения патологически измененной части тела матки формировался довольно большой дефект миометрия, который следовало тщательно ушивать.
Основные показатели хирургического лечения представлены в таблице.
| Вид оперативного вмешательства | Количество выполненных операций |
Средняя продолжительность операции, мин |
Средняя величина кровопотери, мл | Количество койко-дней |
| Овариоцистэктомия |
166 |
95 ± 20 |
40 ± 20 |
3,8 ± 0,2 |
| Эндометриоз | 51 |
144 ± 31 |
85 ± 20 | 5,2 ± 0,2 |
| Миомэктомия | 113 |
130 ± 30 |
150 ± 50 |
5,0 ± 1,0 |
| Промонтофиксация |
97 |
122 ± 24 |
55 ± 18 |
5,0 ± 0,4 |
| Реконструктивные операции |
19 |
168 ± 29 |
43 ± 6 |
5,2 ± 0,2 |
Виды оперативных вмешательств и некоторые характеристики интраоперационного и послеоперационного периодов
Обсуждение
Оценивая объем проведенной работы следует отметить, что хирургическая резекция эндометриоидных гетеротопий рассматривается как наиболее эффективный метод лечения эндометриоза, особенно в ситуациях, когда медикаментозное лечение оказывается безуспешным [5, 6]. Вместе с тем радикальная резекция очагов эндометриоза в ходе лапароскопической операции может быть технически сложной даже для опытного хирурга, особенно в случае распространенного течения заболевания. Известные технические ограничения лапароскопии, включающие плоское изображение, ограниченную маневренность и недостаточное число степеней свободы инструмента, могут стать причиной тяжелых хирургических осложнений (перфорации кишечника, ранения мочеточника или мочевого пузыря) [7—9]. Фактически коэффициент конверсии на лапаротомию при таких операциях составляет примерно 10% даже у квалифицированных хирургов [6, 10]. В этой ситуации особенную ценность приобретает роботический подход, который обеспечивает пространственное изображение и повышенную точность движения инструментов. Преимущества роботизированных систем наиболее полно раскрывались именно при лечении распространенных и инфильтративных форм эндометриоза, в ситуациях, при которых требуется скрупулезная и методичная диссекция, полагающая своей целью восстановление нормальной анатомии органов малого таза и наиболее полное иссечение эндометриоидных гетеротопий. В случае начальных форм эндометриоза превосходство роботических операций не так заметно, что подтверждено в хорошо известном исследовании C.R. Nezhat и соавт. [11]. В этих случаях, традиционная лапароскопия оказывается реальной альтернативой, особенно в руках опытного хирурга.
В соответствии с нашим опытом, применение роботических систем при эндометриозе является методом выбора при наличии инфильтративного и спаечного процесса, а также при двустороннем поражении яичников. По-видимому, следующим этапом развития роботического подхода в лечении эндометриоза следует считать внедрение метода флуоресценции индоцианинового зеленого в ближней инфракрасной области (NIRF-ICG, firefly). Данный подход также может быть успешно применен для идентификации эндометриоидных гетеротопий, невидимых невооруженным глазом при освещении белым светом [12, 13].
Опыт проведении роботических операций на яичниках при доброкачественных опухолях показал, что, по субъективной оценке, метод не имел преимуществ у женщин с солидными опухолями больших размеров. В то же время при небольших размерах образования, двустороннем поражении яичников, при центральном расположении опухоли преимущества роботохирургии очевидны в отношении сохранения овариального резерва.
В настоящее время в научной литературе не представлены убедительные данные о преимуществе роботической техники над лапароскопией при миоме матки. Ретроспективные исследования демонстрируют меньшую кровопотерю и длительность госпитализации, однако более продолжительное время операции при робот-ассистированной миомэктомии [14].
По нашему мнению, основными показаниями к использованию роботического подхода при оперативных вмешательствах по поводу миом являются:
- множественные миоматозные узлы с преимущественно интрамуральной локализацией, деформирующие полость матки;
- миоматозные узлы, расположенные в шеечноперешеечной области;
- миоматозные узлы, расположенные интралигаментарно и в области трубно-маточных углов.
С тех пор, как FDA одобрило робота da Vinci для гинекологической хирургии в 2005 г., минимально инвазивная хирургия при генитальном пролапсе стала все более популярной. По сравнению с традиционным подходом, роботическую технику в этих случаях отличают более длительное время операции и более высокая стоимость. Международные исследования подтверждают данные наблюдения, отмечая также, что у пациенток после робот-ассистированных вмешательств более выражен послеоперационный болевой синдром, который, впрочем, кратковременный и успешно купируется приемом ненаркотических аналгетиков [15, 16]. При этом показатели послеоперационных осложнений и исходы с точки зрения восстановления анатомии и улучшения качества жизни не имели различий у пациентов исследованных групп после традиционных и робот-ассистированных вмешательств [15].
Среди преимуществ метода следует вновь отметить гибкость используемых инструментов, которая отчетливо проявляется при наложении швов и манипуляциях с тканями. Вместе с тем преимущества роботического подхода «уравновешиваются» сопутствующими расходами. Данных литературны, убедительно демонстрирующих превосходство робот-ассистированного подхода в лечении генитального пролапса, в настоящее время нет [17].
Выводы
Обобщая изложенное, мы полагаем, что применение роботического подхода оказывается оптимальным при решении следующих клинических задач:
- поражение яичников доброкачественными новообразованиями небольших размеров (эндометриома, тератома), особенно с билатеральной локализацией;
- распространенный наружный генитальный эндометриоз с вовлечением тазовой брюшины, стенок мочевого пузыря, мочеточников, кишечника;
- мочеполовые свищи различной локализации; — несостоятельность послеоперационного рубца после кесарева сечения;
- множественные миомы матки с преимущественной интрамуральной локализацией, а также в области перешейка, трубно-маточных углов с распространением в области забрюшинного пространства;
- реконструктивные оперативные вмешательства, в том числе, пластика маточных труб;
- рудиментарный функционирующий рог с интерстициальным расположением;
- забор ткани яичника с целью сохранения фертильной функции при криоконсервации.
Заключение
Десятилетний опыт использования робот-ассистированных систем в репродуктивной гинекологии показывает, что роботический подход представляет собой эволюционный этап развития эндоскопического метода, обладая вместе с тем собственными преимуществами и недостатками.
Основные преимущества роботической системы включают сочетание очевидных достоинств эндоскопического доступа и открытой хирургии, а именно хорошей визуализации, а также возможность работы в труднодоступных анатомических зонах, в том числе в забрюшинном пространстве. Это достигается благодаря высокой маневренности роботических инструментов и большого количества степеней свободы движений в ограниченных пространствах. Следует также отметить значительно меньшую кровопотерю и минимальную коагуляцию.
Данные преимущества робот-ассистированного доступа позволяют избежать или с более высокой степенью точности выявить внутриоперационные минимальные повреждения тканей органов брюшной полости и малого таза, своевременно их устранить. В послеоперационном периоде это позволило нам избежать осложнений. Все прооперированные нами пациентки имели гладкий послеоперационный период, длительность пребывания в стационаре не превышала таковую при лапароскопических операциях.
Преимущества роботического подхода наиболее очевидно раскрываются в тех ситуациях, когда требуются прецизионность выполняемых действий, филигранная диссекция тканей, особенно в условиях измененной анатомии. Кроме того, это оказывается чрезвычайно важным в тех условиях, когда необходимо сохранить наибольший объем здоровой ткани, как например в ходе операций на яичниках у девочек-подростков. К очевидным достоинствам роботической техники относятся и эргономические условия работы оператора. Комфортное положение за консолью, интуитивность движения инструментов, а также компенсация тремора — все это позволяет выполнять сложные и точные операции на протяжении длительного времени с меньшей усталостью [18—20].
Для дальнейшего развития данного направления необходимо также совершенствовать точность интраоперационной диагностики, используя методы хирургической навигации. Кроме того, перспективным представляется применение иных хирургических энергий, к примеру, ультразвукового и CO2 лазера. Эти модификации позволят усовершенствовать хирургическую тактику, исходя из задач и акцентов нашей деятельности.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.

