Робот-ассистированное линейное подвздошно-бедренное шунтирование
Резюме
Аортобедренное шунтирование остается золотым стандартом лечения заболеваний аортоподвздошного сегмента с превосходными результатами и долгосрочной проходимостью реконструкции, несмотря на усовершенствование эндоваскулярной хирургии. При выполнении открытых вмешательств высокие риски послеоперационных осложнений, связанные с обширными оперативными доступами. Развитие малоинвазивной хирургии, достижения компьютеризованных технологий произвели революцию во всех областях хирургии и позволяют минимизировать травматичность при выполнении сложных реконструктивных операций, способствуя уменьшению периоперационных рисков осложнений и улучшению периода реабилитации пациента. Использование компьютеризованных роботических систем в сосудистой хирургии позволяет эффективно и безопасно выполнять сложные манипуляции на аортоподвздошном сегменте. Приводим опыт выполнения робот-ассистированного линейного подвздошно-бедренного шунтирования у 69-летнего пациента с хронической артериальной недостаточностью IV степени по Покровскому — Фонтейну.
Введение
Проблемы лечения больных с атеросклеротиче- ским поражением аортоподвздошного артериального сегмента всегда находились в центре внимания сосудистых хирургов. Высокая травматичность традиционных методов реваскуляризации привела к разработке минимально инвазивных способов коррекции, включающих эндоваскулярные, лапароскопические и роботизированные операции [1—3]. Эндоваскулярное вмешательство в виде эндопротезирования брюшного отдела аорты предпочтительнее для пациентов с тяжелыми сопутствующими заболеваниями. Помимо этого, при имплантации стент-графта есть ограничения, связанные с анатомией брюшно- го отдела аорты [2]. У пациентов молодого возраста операцией выбора является протезирование брюшного отдела аорты [1, 3]. Лапароскопические вмеша- тельства вошли в сосудистую хирургию гораздо позже. При этом их распространение было ограничено в связи с отсутствием интереса практикующих хирургов и трудностями, связанными с формированием сосудистого анастомоза, длительным временем пережатия артерий, рядом послеоперационных ослож- нений [4, 5]. В дальнейшем роботическую хирургию начали активно использовать в сосудистой хирургии с целью расширения и улучшения оперативных вмешательств [1]. Сегодня применение робот-ассистированных технологий может повысить точность и эффективность выполнения сложных задач, а также сократить время обучения выполнения операций на аортобедренном сегменте. Это позволяет развивать робот-ассистированные технологии в сосудистой хирургии, способствуя уменьшению сроков реабилитации и улучшению послеоперационного периода у пациента.
Клиническое наблюдение
Пациент Ч., 69 лет, поступил в отделение сосудистой хирургии НИИ — Краевая клиническая больница No1 им. проф. С.В. Очаповского (Краснодар) в январе 2021 г. с жалобами на боль в икроножных мышцах в покое, трофические изменения стопы левой нижней конечности. По данным ультразвуковой доплерографии кровоток в проекции левых общей, поверхностной бедренных, подколенной, передней и задней большеберцовых артерий коллатерального типа, лодыжечный индекс давления 0,28. При МСКТ с внутривенным контрастированием выявлены атеросклеротическое поражение аорты и ее ветвей, окклюзия левой наружной подвздошной артерии (рис. 1). На основании проведенного исследования пациенту поставили основной диагноз: атеросклероз — окклюзия левой наружной подвздошной артерии; хроническая артериальная недостаточность IV степени левой нижней конечности. Сопутствующие заболевания: гипертоническая болезнь III стадии, риск 4. Хроническая сердечная недостаточность I стадии (II функциональный класс по NYHA). Хронический гастрит. С учетом благоприятных анатомических условий, конституции пациента для уменьшения операционной травмы принято решение о выполнении робот- ассистированного линейного подвздошно-бедрен- ного шунтирования синтетическим протезом слева.
Операцию проводили под эндотрахеальным общим обезболиванием, пациент в положении Тренделенбурга на спине с отведенными ногами. В асептических условиях роботической операционной выполнена трехкратная обработка операционного поля раствором антисептика. Первым устанавили порт видеокамеры. Следующие порты устанавливали под визуальным контролем. Поддерживаемое давление в брюшной полости 14—16 мм рт.ст. По срединной линии на 4 см выше пупочного кольца с использованием иглы Вереша наложен карбоксиперитониум. Слепым способом установлен видеооптический троакар 8 мм, в троакар введен лапароскоп. Патологических новообразований, спаечного процесса и свободной жидкости в брюшной полости при обзорной лапароскопии не выявлено. По параректальной линии в эпигастрии слева установлен троакар 8 мм для 2-го роботического манипулятора. На расстоянии от второго троакара 7—8 см латеральнее по передней подмыщечной линии установлен троакар 8 мм для 1-го роботического манипулятора.
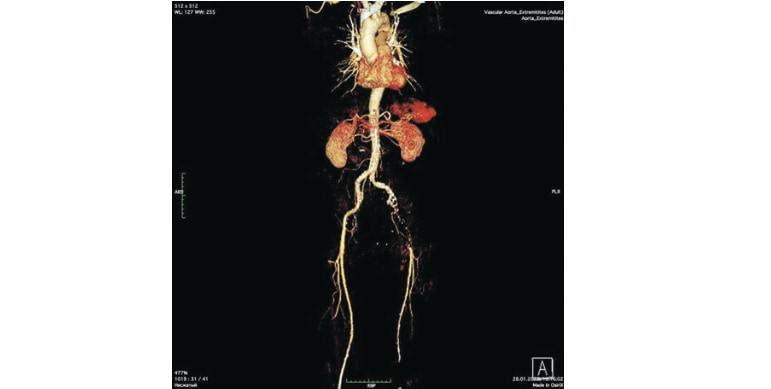 Рис. 1. Трехмерная реконструкция МСКТ с внутривенным контрастированием до оперативного вмешательства. Fig. 1. Preoperative 3D CT angiography.
Рис. 1. Трехмерная реконструкция МСКТ с внутривенным контрастированием до оперативного вмешательства. Fig. 1. Preoperative 3D CT angiography.
Далее по пораректальной линии справа в эпигастрии установлен ассистентский троакар 12 мм. Отступя от ассистентского троакара на 7 см правее установлен 8 мм троакар для 4-й роботического манипулятора (рис. 2, 3).
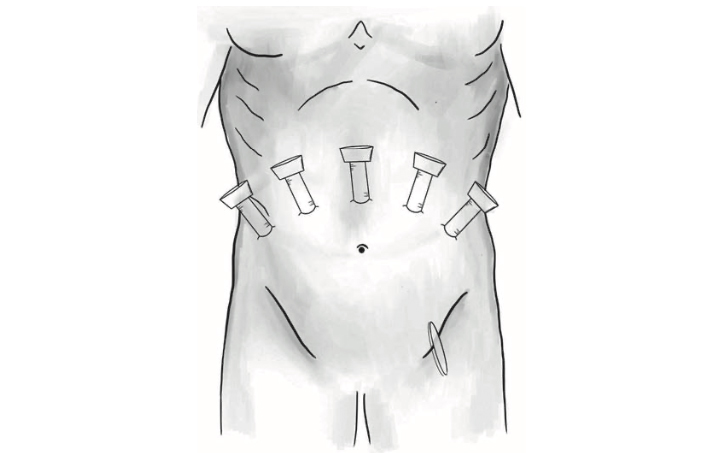 Рис. 2. Схема расположения троакаров. Fig. 2. Scheme of trocar arrangement.
Рис. 2. Схема расположения троакаров. Fig. 2. Scheme of trocar arrangement.
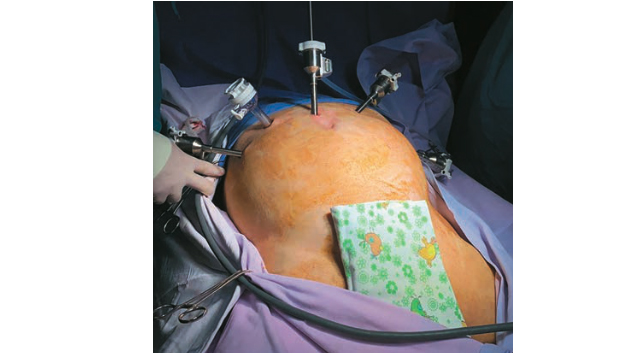 Рис. 3. Расположение троакаров (интраоперационая фотография).
Fig. 3. Trocar arrangement. Intraoperative image.
Рис. 3. Расположение троакаров (интраоперационая фотография).
Fig. 3. Trocar arrangement. Intraoperative image.
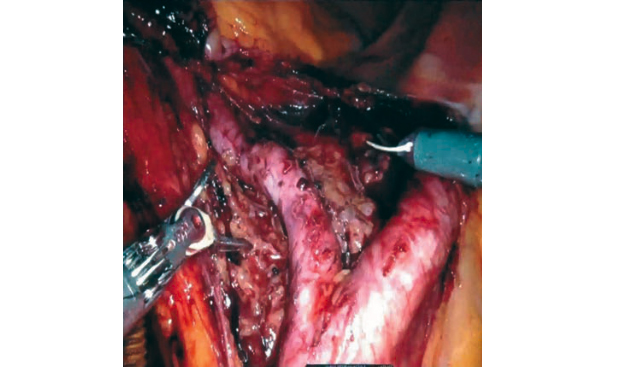
Рис. 4. Выделение терминального отдела аорты и общих подвздошных артерий (интраоперационая эндофотография). Fig. 4. Mobilization of terminal aorta and common iliac arteries.
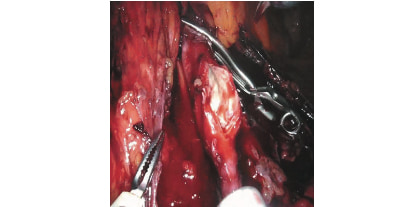
Рис. 5. Артериотомия левой общей подвздошной артерии (интраоперационая эндофотография). Fig. 5. Arteriotomy of the left common iliac artery.

Рис. 6. Подготовленная нить prolene 5/0 (интраопераци- оная фотография). Fig. 6. Polypropylene 5/0 suture.
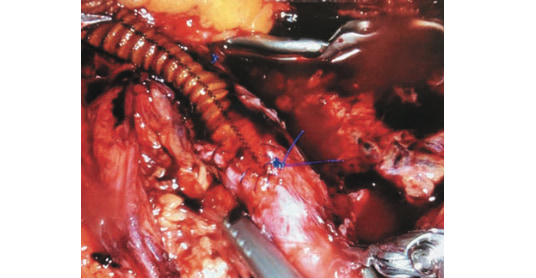
Рис. 7. Сформированный проксимальный анастамоз между общей подвздошной артерией и протезом JOTEC 8 мм (интраоперационая эндофотография). Fig. 7. Proximal anastomosis between common iliac artery and JOTEC 8 mm prosthesis.
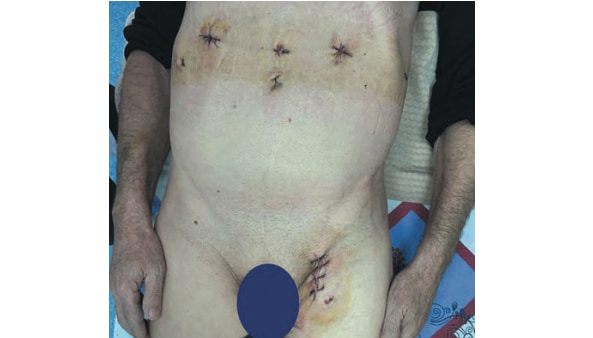 Рис. 8. Вид пациента на 3-и сутки после оперативного вмешательства (послеоперационая фотография).
Fig. 8. Patient after 3 postoperative days.
Рис. 8. Вид пациента на 3-и сутки после оперативного вмешательства (послеоперационая фотография).
Fig. 8. Patient after 3 postoperative days.
Общее время оперативного вмешательства 190 мин, при этом время окклюзии общей подвздошной артерии составило 37 мин, время формирования проксимального анастамоза с использованием робота-ассистента — 35 мин, объем кровопотери 150 мл. Послеоперационный период пациента протекал без особенностей и осложнений. На 2-е сутки после операции пациент переведен из отделения реанимации и интенсивной терапии в общую палату. Перистальтика кишечника в 1-е сутки снижена, самостоятельный стул получен на 2-е сутки. На 3-и сутки удалены дренажи (рис. 8) и выполнена МСКТ с внутривенным контрастированием с целью послеоперационного контроля (рис. 9). По данным МСКТ зона реконструкции проходи- ма. На 4-е сутки пациент выписан под наблюдения хирурга по месту жительства.
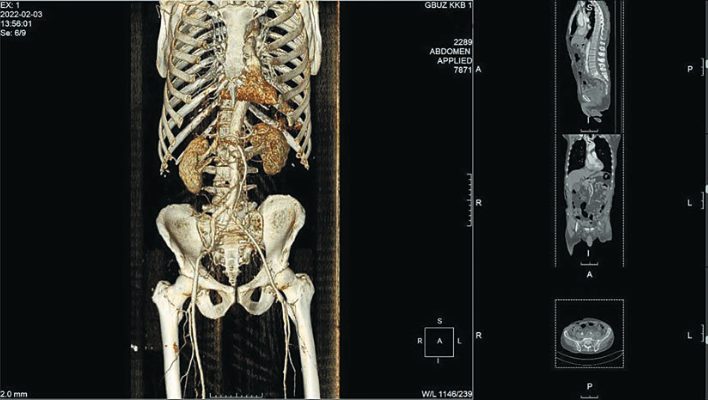
Рис. 9. 3D-реконструкция МСКТ с внутривенным контрастированием после оперативного вмешательства (интраоперационая эндофотография). Fig. 9. Postoperative 3D CT angiography.
Обсуждение
Использование робот-ассистированных установок в различных хирургических специальностях позволяет выполнять сложные реконструктивные операции с высокой точностью и минимальной травматизацией, что улучшает послеоперационный период и реабилитацию пациентов. При создании компьютезированных роботических систем использование в сосудистой хирургии роботов-ассистентов было сложно представить, не говоря уже о выполнении реконструктивных операций на магистральных со- судах. Однако возможности роботизированных хирургических установок позволяют хирургам выполнять сложные операции даже на аортоподвздошном сегменте с отличными результатами раннего и позднего послеоперационного периода. Štadler и соавт. (2009 г.) продемонстрировали, что роботизированные операционные системы повышают точность и управляемость хирургической операции с высоким уровнем технического успеха. Создание аортоподвздошного анастомоза с роботизированной помощью представляется более быстрым и точным по сравнению с традиционно открытым методом. Очень важен опыт лапароскопической сосудистой хирургии, поскольку робот-ассистированные аортоподвздошные операции сочетаются с традиционной лапароскопической хи- рургией. Хирургическая система da Vinci позволяет выполнять более точные движения при минимально инвазивных процедурах в сосудистой хирургии на разных уровнях [4—6]. В отличие от лапароскопических инструментов, у которых нет гибких концов, роботизированные инструменты копируют движения рук человека (с использованием технологии Endo-Wrist) [4].
К недостаткам робот-ассистированных операций относится высокая изначальная стоимость системы и расходного материала [5, 7, 8]. В современной робототехнике также отсутствует механизм тактильной обратной связи, которая предоставляет лапароскопия. Это приводит к тому, что хирург теряет тактильную чувствительность, что может повлечь разрывы швов. Потребность в опытном ассистенте требует командной работы, особенно при выделении аорты, аспирации, пережатии аорты, наложении швов и замене инструментов [9]. Кроме того, с учетом необходимости карбоксиперитонеума пациентам, страдающим острыми формами обструктивной болезни легких, не подходят ни лапароскопические, ни робот-ассистированные операции. Противопоказание к карбок- сиперитонеуму автоматически влечет за собой противопоказание к лапароскопически-роботизированным операциям на сосудах [4]. Усовершенствованная визуализация, увеличенное изображение и 7 плоскостей движения запястья разрешают хирургу добиться высочайшей точности и контроля. Роботизированные руки также позволяют масштабировать движения, обеспечивая эргономичное позиционирование. Полная свобода в движении кисти с поддержкою компьютерных и робототехнических аппаратур исключает тремор рук, способствует точному рассечению аорты и формированию анастомоза аорты с трансплантатом, который сокращает кровопотерю и время ишемии нижних конечностей [5]. Еще одно преимущество мини-инвазивной операции заключается в том, что ее можно использовать у пациентов с абдоминальным ожирением, когда стандартные вмешательства технически сложны и часто воз- никают проблемы с заживлением ран после лапаротомии [2, 3]. По некоторым данным, инфекционные осложнения ран после лапаротомии достигают 3,3%. К плюсам видеоскопических операций можно отнести и низкие риски возникновения пареза кишечника, вентральных грыж, послеоперационных сером, лимфореи и повреждения нервных структур [10]. Таким образом, развитие роботизированной хирургии брюшного отдела аорты является актуальным и представляет интерес для широкого внедрения в практику [1]. Выполненнение линейного подздошно-бедренное шунтирования на роботизированном комплексе da Vinci XI по длительности оперативного вмешательства, времени формирования анастомозов, объему кровопотери сравнимо с открытыми реконструктивными операциями. Немаловажно и то, что менее выраженный болевой синдром и укороченный восстановительный период у пациентов после операции являются неоспоримым преимуществом по сравнению с открытыми операциями.
Заключение
Активное внедрение роботических систем в сосудистую хирургию может улучшить результаты хирургических вмешательств, минимизируя риски инфекционных осложнений и травматичность тканей, уменьшая длительность пребывания пациентов в стационаре и способствуя скорейшему возращению пациентов к повседневной жизни. Авторы заявляют об отсутствии конфликта интересов.The authors declare no conflicts of interest.


