Робот-ассистированная резекция почки с нулевой ишемией у коморбидных пациентов
Аннотация:
Введение. Выполнение органосохраняющей операции является золотым стандартом хирургического лечения локализованного почечноклеточного рака (ПКР). Резекцию почки можно проводить как в условиях тепловой ишемии, так и без наложения сосудистого зажима. Особенно важно сохранение ренальной функции у коморбидных пациентов при проведении резекции почки по поводу ПКР.
Цель. Оценить периоперационные результаты робот-ассистированных резекций почки с нулевой ишемией у коморбидных больных с ПКР.
Материалы и методы. В ФГБУ «НМИЦ им. В.А. Алмазова» ретроспективно были изучены результаты лечения 11 коморбидных пациентов, которым за период с 2019 по 2022 г. выполнялись робот-ассистированные резекции почек в условиях нулевой ишемии. У 3 (27,3%)пациентов было выявлено новообразование единственной функционирующей почки. Перед планированием операции, на основании результатов мультиспиральной компьютерной томографии, всем больным выполнялась 3D – реконструкция с помощью программы моделирования 3D Slicer. Для быстрой мобилизации ренальных сосудов использовался «Способ безопасного выделения почечной артерии ивены при эндовидеохирургической резекции почки», запатентованный в РФ. Границы резекции определялись с помощью ультразвуковогоисследования внутриполостным датчиком BK Flex Focus 800. Функциональное состояние почек оценивалось по результатам скоростиклубочковой фильтрации (СКФ) c помощью формулы Chronic Kidney Desease Epidemiology Collaboration (CKD-EPI).
Результаты. Интраоперационных и послеоперационных осложнений во всех случаях не наблюдалось. Медиана консольного времени операции составила 110 мин (58 – 130). Медиана кровопотери на этапе резекции почки составила 100 мл (50–280). Хирургический край резекции во всех случаях был отрицательным. В послеоперационном периоде СКФ была сопоставима с предоперационными значениями.
Выводы. Робот-ассистированную резекцию почки с нулевой ишемией коморбидным пациентам целесообразнее проводить в многопрофильном центре компетенции. Эффективность периоперационных результатов робот-ассистированной резекции почки с нулевой ишемией достигается применением высокоинформативных диагностических методов визуализации и выполнением в ходе операциибезопасного способа выделения ренальных сосудов с проведением быстрой реноррафии опытным хирургом.Ключевые слова: почечно-клеточный рак; резекция почки; коморбидность; нулевая ишемия.
Для цитирования: Мосоян М.С., Шанава Г.Ш., Симонян А.М., Гилев Е.С., Айсина Н.А. Робот-ассистированная резекция почки с нулевой ишемией у коморбидных пациентов. Экспериментальная и клиническая урология 2023;16(2):52-57;https://doi.org/10.29188/2222-8543-2023-16-2-52-57
Введение
Почечно-клеточный рак (ПКР) по распространенности занимает 7-е место среди всех случаев урологических новообразований [1, 2, 3]. По данным литературы, пик заболеваемости ПКР в последние десятилетиянаблюдается у больных в возрасте 60-70 лет [2, 4]. Умногих пациентов данной возрастной группы имеютсясопутствующие заболевания [5, 6]. Сосуществованиедвух и более заболеваний, патогенетически взаимосвязанных между собой или совпадающих по времени у одного пациента, получило определение коморбидность[7]. Наиболее распространенными коморбидными состояниями являются сердечно-сосудистые заболевания,сахарный диабет, хроническая болезнь почек и др. [7].Наличие коморбидного заболевания отягощает течениеПКР, влияет на выбор тактики лечения новообразования, увеличивает койко-день у оперированных пациентов, способствуют развитию осложнений [8, 9].
По имеющимся современным международным и отечественным рекомендациям, в зависимости от стадии ПКР, выполняется резекция почки или нефрэктомия. На сегодняшний день выполнение органосохраняющей операции является золотым стандартом хирургического лечения опухолей почки при стадии cT1 [10 - 13]. Эффективность резекции почки обеспечивается 3 факторами («трифекта»): отрицательным хирургическим краем, минимальным нарушением почечной функции и отсутствием послеоперационных осложнений [14, 15]. Ренальная функция напрямую зависит от объема сохраненной почечной ткани и длительности ишемии во время операции [15, 16]. В последнее десятилетие в публикациях все чаще описывается успешное выполнение резекции почки с нулевой ишемией, что благоприятно сказывается на показателях скорости клубочковой фильтрации (СКФ) в послеоперационном периоде [14, 16]. Однако данных о проведении резекции почки без ишемии коморбидным пациентам в литературе представлено недостаточно.
Выполнение оперативных вмешательств коморбидным пациентам сопряжено с высокими рисками развития интра- и послеоперационных осложнений [17]. У пациентов с сердечно-сосудистыми заболеваниями, получающих антикоагулянтную терапию, вероятность развития интраоперационных кровотечений значительно выше, чем у больных без коморбидной патологии. В случае отмены антикоагулянтной терапии перед операцией возникают риски развития тромбоза сосудов [9].
На сегодняшний день поиск оперативных технологий, позволяющих выполнить резекцию почки с нулевой ишемией коморбидному пациенту с ПКР, которая обеспечивает эффективные онкологические и функциональные исходы и отсутствие послеоперационных осложнений, является актуальной задачей современной урологии.
Цель исследования – оценить периоперационные результаты робот-ассистированных резекций почки с нулевой ишемией у коморбидных больных с ПКР.
Материалы и методы
В ФГБУ «НМИЦ им. В.А. Алмазова» ретроспективно были изучены результаты лечения 11 коморбидных пациентов, которым за период с 2019 по 2022 г. выполнялась робот-ассистированная резекция почки в условиях нулевой ишемии.
Критерии включения:
- клиническая стадия новообразования почек cT1;
- индекс коморбидности Charlson > 3;
- возраст больных 18-70 лет.
Критерии исключения:
- индекс коморбидности Charlson 0, 1-2;
- подтвержденный диагноз доброкачественного новообразования или местнораспространенный опухолевый процесс по результатам гистологического исследования.
Медиана возраста больных, включенных в исследование, составила 64,5 лет [МКР: 63,0-66,3], медиана индекса массы тела (ИМТ) – 29,8 кг/м2 [МКР: 25,6 – 31,1]. У 3 (27,3%) пациентов было выявлено новообразование единственной функционирующей почки. Расчет индекса коморбидности определялся по балльной системе, предложенной M. Charlson в 1987 г. [18].
Демографические и предоперационные данные о пациентах представлены в таблице 1.
Таблица 1. Демографические и предоперационные данные пациентов
| Показатель Index |
Результат Result |
|---|---|
| Число пациентов, n The number of patients, n |
11 |
| Пол Sex Мужской, n (%) / Male, n (%) Женский, n (%) / Female, n (%) |
7 (63.6%) 4 (36.4%) |
| Медиана возраста, лет Median of age, years |
65 [63–67] |
| Медиана ИМТ, кг/м² Median of BMI, kg/m² |
29.7 [24.8–31.1] |
| Медиана индекса коморбидности Чарлсон Median of CCI |
4 [4–5] |
| Сторона расположения опухоли Tumor location Справа, n (%) / Right, n (%) Слева, n (%) / Left, n (%) |
5 (45.5%) 6 (54.5%) |
| Клиническая стадия Clinical stage cT1a, n (%) cT1b, n (%) |
10 (90.1%) 1 (9.9%) |
| Медиана размеров опухоли, мм Median of tumor size, mm |
33.6 [17.9–52.5] |
| Медиана баллов по шкале Median of score PADUA RENAL |
7 [6–9] 7 [6–9] |
Все пациенты были госпитализированы в ФГБУ «НМИЦ им. В.А. Алмазова» для проведения плановой операции. Данные об имеющихся коморбидных заболеваниях у пациентов с ПКР, включенных в исследование указаны в таблице 2.
Таблица 2. Коморбидные заболевания у пациентов с ПКР
| Показатель Index |
Результат Result |
|---|---|
| Число пациентов, n The number of patients, n |
11 |
| Коморбидные состояния / Comorbidities | |
| Гипертоническая болезнь (ГБ), n (%) Hypertension, n (%) |
9 (81.8%) |
| Ишемическая болезнь сердца (ИБС), n (%) Coronary heart disease, n (%) |
5 (45.5%) |
| Хроническая сердечная недостаточность, n (%) Chronic heart disease, n (%) |
4 (36.4%) |
|
Нарушения ритма сердца Heart arrhythmia | |
| Фибрилляция предсердий (ФП), n (%) Atrial fibrillation, n (%) |
3 (27.3%) |
| Желудочковая экстрасистолия, n (%) Ventricular extrasystole, n (%) |
2 (18.2%) |
Как показано в таблице 2, у всех пациентов одновременно имелись по несколько заболеваний сердечнососудистой системы. Все пациенты длительное время принимали антиагреганты. Учитывая характер коморбидных заболеваний, больные были проконсультированы кардиологами. По их рекомендациям пациенты, получающие антиагрегантную терапию, были переведены на прием низкомолекулярного гепарина.
Как показано в таблице 2, у всех пациентов одновременно имелись по несколько заболеваний сердечнососудистой системы. Все пациенты длительное время принимали антиагреганты. Учитывая характер коморбидных заболеваний, больные были проконсультированы кардиологами. По их рекомендациям пациенты, получающие антиагрегантную терапию, были переведены на прием низкомолекулярного гепарина.
Кроме стандартных методов диагностики, на этапе предоперационной подготовки по результатам мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости и забрюшинного пространства нами выполнялась 3D-реконструкция с помощью программы моделирования 3D Slicer.
Функциональные результаты оценивались по скорости клубочковой фильтрации (СКФ) в пред- и послеоперационном периоде по расчетной формуле: Chronic Kidney Desease Epidemiology Collaboration (CKD-EPI).
Операции выполнялись компетентным хирургом с опытом выполнения более 1500 робот-ассистированных операций.
Результаты
На этапе предоперационной подготовки выполнение 3D-реконструкции позволило детально рассмотреть топографо-анатомические особенности расположения опухоли и почечных сосудов (рис. 1). Это способствовало рациональному выбору доступа к ренальным сосудам и к новообразованию.
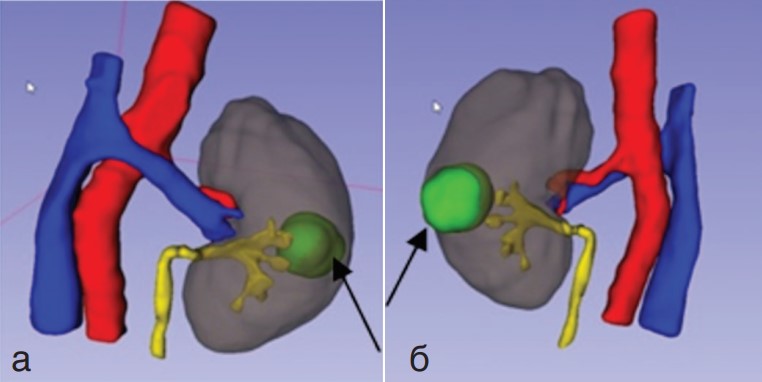 Ри.с 1. 3D – реконструкция расположения опухоли почек и почечных сосудов (а) Передняя поверхность левой почки. (б) Задняя поверхность левой почки. Стрелкой обозначено новообразование левой почки
Ри.с 1. 3D – реконструкция расположения опухоли почек и почечных сосудов (а) Передняя поверхность левой почки. (б) Задняя поверхность левой почки. Стрелкой обозначено новообразование левой почки
Резекция почки осуществлялась в традиционном положении пациента на боку. После сформированного трансперитонеального доступа при помощи робота-ассистента мобилизовалась почка и ее сосудистая ножка.
Несмотря на то, что резекция почки выполнялась без ишемии, во всех случаях производилась мобилизация ренальных сосудов (рис. 2).
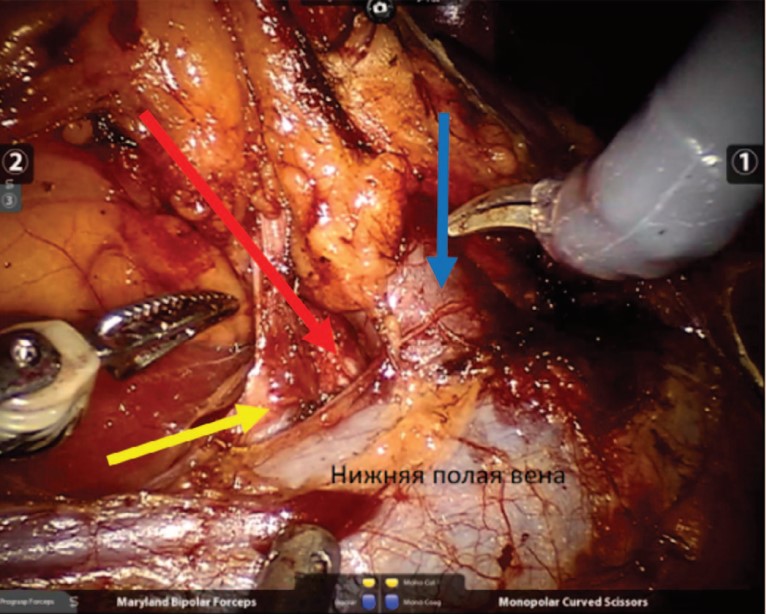 Рис. 2. Мобилизация сосудистой ножки правой почки. Синей стрелкой указана основная почечная вена. Желтой стрелкой обозначена добавочная почечная вена. Красной стрелкой указана почечная артерия
Рис. 2. Мобилизация сосудистой ножки правой почки. Синей стрелкой указана основная почечная вена. Желтой стрелкой обозначена добавочная почечная вена. Красной стрелкой указана почечная артерия
Быстрый доступ к почечной артерии обеспечивался ориентирами условного треугольника, где сторонами были медиальный край нижнего полюса почки, гонадная и почечные вены [19].
Перед началом резекции почки границы новообразования определялись в ходе УЗИ датчиком BK Flex Focus800 (рис. 3).
Перед началом резекции почки границы новообразования определялись в ходе УЗИ датчиком BK Flex Focus800 (рис. 3).
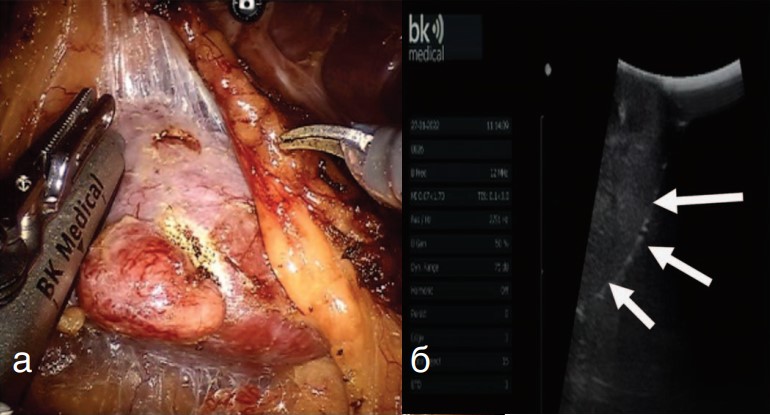 Рис. 3 (а, б) Интраоперационное определение границ резекции новообразования с помощью внутриполостного датчика УЗИ (а). Увеличенное изображение интраренальной части опухоли, обозначенное белыми стрелками (б)
Рис. 3 (а, б) Интраоперационное определение границ резекции новообразования с помощью внутриполостного датчика УЗИ (а). Увеличенное изображение интраренальной части опухоли, обозначенное белыми стрелками (б)
С учетом полученных результатов интраоперационного УЗИ проводилась резекция опухоли с нулевой ишемией в пределах здоровых тканей. Медиана кровопотери этапа резекции почки составила 100 мл [МКР: 50 – 280]. Края резецированной почки ушивались с применением рассасывающихся нитей V-Loc 3-0, которые дополнительно фиксировались эндоскопическими клипсами.
Медиана консольного времени операции составила 110 мин [МКР: 58 – 130]. Интраоперационных и послеоперационных осложнений во всех случаях не наблюдалось. Переливание компонентов крови ни одному пациенту не потребовалось. Средний послеоперационный койко-день пребывания пациентов в стационаре составил 8 дней. Пациенты выписывались из отделения с рекомендациями кардиолога по дальнейшему лечению сердечно-сосудистых заболеваний.
Во всех случаях по данным гистологического исследования хирургический край резекции был отрицательным. В 77,8% случаев гистологическое исследование выявило светлоклеточный рак почки. Остальные 22,2% случая составили хромофобную карциному почки. Осложнений выше I степени по классификации ClavienDindo не наблюдалось. В течение 3-х суток после операции у всех пациентов отмечалось повышение СКФ с дальнейшим снижением на 7-е сутки до предоперационных значений (табл. 3).
Таблица 3. Дооперационные и послеоперационные показатели СКФ
| Медиана СКФ мл/мин/1,73 м² / Median of GFR ml/min/1.73 m² | ||||
|---|---|---|---|---|
| Формула Formula |
До операции Preoperative |
Через 24 часа после операции Postoperatively 24 hours |
Через 72 часа после операции Postoperatively 72 hours |
Через 7 суток после операции Postoperatively 7 days |
| CKD EPI | 69,3 [60 – 88,2] | 68 [62,6 – 80,7] | 74,1 [60 – 88,9] | 70,1 [64 – 80,5] |
Обсуждение
С увеличением продолжительности жизни у населения наблюдается тенденция к возрастанию коморбидных патологий. В том числе и у пациентов старшего возраста с ПКР наблюдается неуклонный рост числа сопутствующих заболеваний. В настоящее время роботассистированная резекция почки является одним из самых эффективных методов лечения локализованного ПКР [20, 21]. Однако многим пациентам с тяжелыми коморбидными заболеваниями из-за высоких интра- и послеоперационных рисков развития осложнений в выполнении хирургического вмешательства многие клиники отказывают. Им предлагаются аблятивные способы лечения [13, 22].
Для безопасного выполнения резекции почки пациентам с коморбидными состояниями требуется особый подход. Целесообразно проведение операции в многопрофильном медицинском учреждении с участием в лечении больных профильных специалистов, курирующих сопутствующие заболевания. Наше исследование продемонстрировало, что участие кардиологов и компетентного хирурга обеспечивает возможность выполнения робот-ассистрованной резекции почки. Применение 3D-реконструкции на предоперационном этапе позволило виртуально спланировать ход операции. Использование интраоперационного УЗИ указало на точные границы резекции опухоли. Применение метода, предложенного В.Э. Федоровым и соавт. «Cпособ выделения почечной артерии и вены при эндовидеохирургической резекции почки», обеспечило безопасную и быструю мобилизацию ренальных сосудов [19]. Возможности роботических артикуляционных инструментов, обладающих повышенной подвижностью и точностью движений, позволили провести быструю реноррафию, что нивелировало интраоперационную кровопотерю.
Мы считаем, что края резецированной почки у коморбидных пациентов необходимо прочно ушивать. Для пациентов, получающих антикоагулянтную терапию, для достижения стойкого гемостаза недостаточно ограничиваться электрокоагуляцией и применением гемостатического клея. К тому же у больных с гипертоничекой болезнью всегда остается риск резкого повышения артериального давления в послеоперационном периоде, что может привести к кровотечению из области резекции почки.
Выводы
Робот-ассистированную резекцию почки с нулевой ишемией коморбидным пациентам целесообразнее проводить в многопрофильном центре компетенции. Эффективность периоперационных результатов роботассистированной резекции почки с нулевой ишемией достигается применением высокоинформативных диагностических методов визуализации и выполнением в ходе операции безопасного способа выделения ренальных сосудов с проведением быстрой реноррафии опытным хирургом.