Робот-ассистированная радикальная цистэктомия как современный метод персонифицированного лечения пациентов с мышечно-инвазивным раком мочевого пузыря
Аннотация
Введение. Радикальная цистэктомия (РЦ) является «золотым стандартом» лечения мышечно-инвазивного рака мочевого пузыря (МИРМП). Робот-ассистированная РЦ (РАРЦ) в сочетании с методами клеточной диагностики может выступать безопасным и эффективным способом лечения МИРМП.
Цель исследования — анализ собственного опыта применения РАРЦ с интраоперационной флуоресценцией индоцианином зеленым (ICG) и послеоперационным определением уровней опухолевых макрофагов при лечении пациентов с МИРМП.
Материалы и методы. В Клинике Башкирского государственного медицинского университета проведено исследование с участием 202 пациентов после РАРЦ по поводу МИРМП. 30 пациентам выполнялась интраоперационная ICG-флуоресценция. У всех пациентов определялись уровни опухолевых макрофагов в удаленных макропрепаратах. В послеоперационном периоде проводился анализ выживаемости.
Результаты. Чувствительность метода ICG-флуоресценции составила 94,4 %, а специфичность — 83,3 %. Высокие уровни экспрессии маркеров макрофагов CD68 и CD163 статистически значимо преобладают в группе со стадией cN+ (по клинической TNM-классификации — имеются признаки поражения) (p = 0,027 и p = 0,018 соответственно). У всех пациентов с высокими уровнями CD68 и CD163 наблюдали ICG-флуоресценцию регионарных лимфатических узлов (100 %). Зарегистрировано достоверное снижение выживаемости у пациентов с высокой пато морфологической стадией T (pT по классификации TNM) (r = 0,952, p < 0,05) и получены статистически достоверные показатели выживаемости для групп pT1–pT4 (p < 0,05 для общей, опухоль-специфической и безрецидивной выживаемости (ОВ, ОСВ, БРВ соответственно)).
Обсуждение. В мировой литературе появляется все больше исследований, доказывающих эффективность РАРЦ при лечении МИРМП. В сравнении с открытыми и лапароскопическими методиками демонстрируются лучшие хирургические и сопоставимые онкологические результаты.
Заключение. Результаты анализа собственного опыта РАРЦ свидетельствуют об эффективности данного метода лечения МИРМП. Использование ICG-флуоресценции и верификации опухолевых макрофагов позволяет оказывать персонифицированную помощь пациентам онкоурологического профиля.
Конфликт интересов. Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов.
Соответствие принципам этики. Исследование одобрено Локальным этическим комитетом Башкирского государственного медицинского университета (протокол № 237-05 от 7 июня 2023 г.). Все пациенты подписали информированное согласие на участие в исследовании и обработку персональных данных.
Для цитирования: Павлов В. Н., Урманцев М. Ф., Бакеев М. Р. Робот-ассистированная радикальная цистэктомия как современный метод персонифицированного лечения пациентов с мышечно-инвазивным раком мочевого пузыря // Уральский медицинский журнал. 2024. Т. 23, № 2. С. 54–64. DOI: https://doi.org/10.52420/umj.23.2.54. EDN: https://elibrary.ru/JJPVIG.
Введение
По распространенности среди всех злокачественных новообразований рак мочевого пузыря (РМП) находится на 9-м месте по всему миру. Около 75 % случаев РМП диагностируют у лиц мужского пола [1]. В Европе стандартизированный по возрасту коэффициент заболеваемости РМП равняется 19,1 для мужчин и 4,0 для женщин, а уровень смертности составляет 3,2 для мужчин и 0,9 для женщин (на 100000) [2]. Также отмечается более высокий уровень заболеваемости у населения развитых стран [3], а в будущем ожидается увеличение заболеваемости среди лиц обоих полов [4]. В условиях современной высокотехнологичной медицины имеются все возможности для создания эффективных стратегий лечения онкоурологических заболеваний. Имеющиеся в настоящее время эпидемиологические показатели РМП свидетельствуют о необходимости комплексного подхода к диагностике и лечению рассматриваемой патологии.
Во время первичной диагностики РМП в 70–75 % диагностируется немышечно-инвазинвый рак мочевого пузыря (НМИРМП) (pTis–pT11), при котором морфологически опухоль локализуется в уротелии или собственной пластинке мочевого пузыря без инвазии детрузора [5]. В 25–30 % случаев РМП верифицируют мышечно-инвазивный рак мочевого пузыря (МИРМП) (pT2–pT4) [6]. На протяжении 5 лет после лечения НМИРМП в 50–70 % случаев будет возникать рецидив, а в 10–30 % случаев — прогрессирование до МИРМП с регионарным и отдаленным метастазированием [7]. При этом, согласно данным ряда исследований, 5-летняя выживаемость для МИРМП составляет около 50 % [8]. Стоит отметить, что поражение регионарных лимфатических узлов верифицируется у 25 % пациентов, перенесших оперативное лечение по поводу МИРМП [9]. Текущие показатели прогноза РМП и высокие уровни диагностики поздних стадий делают обязательным совершенствование существующих методов лечения.
С 1960 г. радикальная цистэктомия (РЦ) является «золотым стандартом» лечения МИРМП, НМИРМП высокого риска, а также злокачественных новообразования малого таза, инфильтрирующих мочевой пузырь [9, 10]. С 2003 г. в крупных медицинских центрах по всему миру выполняются робот-ассистированные РЦ (РАРЦ) [11, 12]. За последние несколько лет закономерно увеличилось количество выполняемых РАРЦ [13]. В ряде крупных исследований демонстрировались преимущества роботизированной техники выполнения РЦ, что отразилось в снижении интраоперационной кровопотери, частоты гемотрансфузий, длительности послеоперационного пареза желудочно-кишечного тракта и ранней выписки из стационара [14–17].
Отдельного внимания заслуживают возможности современных технологий дополненной реальности и визуализации, которые интегрированы в эндовидеохирургические системы. Благодаря методам обработки и модификации интраоперационного изображения стало возможным фиксировать накопление специфических флюорофоров, что выступило важным подспорьем в выполнении целого ряда хирургических, урологических и онкологических вмешательств. С появлением технологии FireFly® (Intuitive Surgical Inc., Саннивейл, США) в роботизированной хирургической системе da Vinci® стали использоваться фармакологические агенты, способные к флуоресценции в ближнем инфракрасном диапазоне спектра. В настоящее время применяется лимфо- и вазотропный препарат индоцианин зеленый (англ. Indocyanine Green, ICG). Уже имеются положительные результаты применения такой методики интраоперационной визуализации при ряде урологических и онкологических вмешательств, в т.ч. при РАРЦ [17, 18]. Перспективным направлением выступает определение интраоперационной флуоресценции лимфатических узлов малого таза с помощью ICG.
В настоящее время детально изучается клеточное микроокружение при солидных опухолях различных локализаций. Микроокружение опухоли (МО) — сложная гистологическая структура, включающая в себя атипические злокачественные клетки, строму и инфильтрирующие клетки иммунной системы. Среди иммунных клеток различают CD8+ T-лимфоциты, NK-клетки2, макрофаги, ассоциированные с опухолью (МАО), и регуляторные T-клетки [19]. При этом самыми распространенными представителями МО выступают МАО [20]. Различают макрофаги, активированные классическим путем и оказывающие противоопухолевое действие (M1), и макрофаги, являющиеся альтернативно активированными с признаками проопухолевой активности (M2) [21]. В настоящее время ведутся научные работы, изучающие влияние МАО на возникновение и прогрессирование РМП. В аспекте комплексного лечения пациентов с МИРМП и определения дальнейшей тактики послеоперационной терапии РАРЦ выступает связующим звеном мультимодального подхода. Возможности безопасной и эффективной хирургии в совокупности с адекватной оценкой опухолевого процесса и биологических предикторов позволят значительно улучшить лечение и качество жизни для пациентов с МИРМП.
Цель работы — анализ собственного опыта применения РАРЦ с использованием интраоперационной флуоресцентной визуализации и послеоперационным определением уровней МАО при лечении пациентов с МИРМП.
Материалы и методы
В Клинике Башкирского государственного медицинского университета с 1 апреля 2018 г. по 31 июля 2023 г. проведено исследование с участием 202 пациентов с диагнозом МИРМП. Перед участием в исследовании все пациенты были проинформированы и подписали добровольное согласие. Опытную группу составили 165 мужчин (81,7 %) и 37 женщин (18,3 %). Средний возраст пациентов — (68,1±3,4) лет. Характеристика опытной группы по онкологическим показателям включала в себя отражение клинической стадии cT, степень дифференцировки (англ. Grade, G) и статус регионарных лимфатических узлов cN (cN0 — отсутствие поражения; cN+ — имеются признаки поражения; cNX — недостаточно данных для оценки поражения) по данным инструментальной диагностики (табл. 1).
Таблица 1
Характеристика пациентов с МИРМП до РАРЦ
| Онкологические критерии | Количество пациентов | |
|---|---|---|
| абс. | % | |
| Клиническая стадия | ||
| cT1 | 9 | 4,5 |
| cT2 | 79 | 39,1 |
| cT3 | 79 | 39,1 |
| cT4 | 35 | 17,3 |
| Гистологическая степень злокачественности (Grade) по данным биопсии | ||
| G1 | 13 | 6,4 |
| G2 | 62 | 30,7 |
| G3 | 127 | 62,9 |
| Статус регионарных лимфатических узлов по данным инструментальной диагностики | ||
| cN0/NX | 139 | 68,8 |
| cN+ | 63 | 31,2 |
Всем пациентам было показано оперативное лечение в объеме радикальной цистэктомии с тазовой лимфаденэктомией (ТЛАЭ). Деривацию мочи выполняли интракорпорально с формированием илеокондуита по Бриккеру (англ. E. M. Bricker) или артифициального мочевого резервуара по Штудеру (англ. U. E. Studer). Для женщин с МИРМП радикальный этап заключался в передней тазовой экзентерации, а при поражении прямой кишки — в тотальной тазовой экзентерации. Оперативное пособие выполняли с использованием роботизированных хирургических систем da Vinci® Si и Xi. Интраоперационную ICG-флуоресценцию выполняли 30 пациентам, из которых 24 мужчины (80 %) и 6 женщин (20 %). Для этого из общей когорты пациентов были случайным образом выбраны 15 пациентов с cN0/NX и 15 пациентов с cN+. Для приготовления раствора с концентрацией ICG 5 мг/мл использовали препарат Verdye 50 мг (Diagnostic Green GmbH, Мюнхен, Германия). Раствор в объеме 10 мл вводили при цистоскопии в перитуморозное пространство с обязательным захватом подслизистого слоя и поверхностной части детрузора. После инъекции ICG пациенту производили установку портов для выполнения РАРЦ. В режиме визуализации в ближнем инфракрасном диапазоне спектра осуществляли оценку флуоресцирующих лимфатических узлов, затем производили сравнение с изображением в белом свете. При проведении ТЛАЭ все ICG-позитивные лимфатические узлы были помечены. После выполнения РАРЦ макропрепарат пораженного органа, дистальные части мочеточников и все удаленные лимфатические узлы отправляли на патоморфологическое исследование. При гистологическом исследовании материал фиксировали в 10 %-м растворе формалина, затем заливали в парафиновые блоки. Изготавливали срезы толщиной 5–7 мкм и производили окрашивание гематоксилином и эозином. После выполняли обзорное гистологическое исследование с постановкой патоморфологического диагноза. Опухолевый материал пациентов, которым интраоперационно оценивали флуоресценцию ICG, в дальнейшем использовали для иммуногистохимического анализа в целях определения уровней МАО. Отдельно заготавливали срезы толщиной 4–5 мкм из пораженного опухолью мочевого пузыря. Для исследования применяли стрептавидин-биотиновый метод, а для постановки реакции использовали коммерческие моноклональные антитела CD68 и CD163, являющиеся мембранными рецепторами МАО. После оцифровки изображений с помощью анализатора Leica производили оценку экспрессированных клеток (в %) и интенсивность экспрессии. Поскольку выбранные антитела не имеют ядерной локализации, для определения интенсивности экспрессии использовали полуколичественный способ с балльной оценкой от 0 до 3: 0 — отсутствие реакции; 1 — слабая реакция, точечное окрашивание мембраны; 2 — умеренная реакция, частичное окрашивание мембраны; 3 — сильная реакция, полностью окрашенные мембраны. За всеми пациентами после РАРЦ (n = 202) проводили послеоперационное наблюдение после выписки из стационара для определения общей, опухоль-специфической и безрецидивной выживаемости (ОВ, ОСВ, БРВ соответственно). Анализ выживаемости с определением уровней ОВ, ОСВ, БРВ проводили с учетом стратификации пациентов по стадиям pT. Для визуализации показателей выживаемости использовали графики Каплана — Мейера (англ. Kaplan — Meier Estimator). Максимальный период наблюдения за пациентами для определения выживаемости ограничивался 36 мес. Статистическую обработку полученных данных проводили в программе Statistica 10.0 (StatSoft Inc., США). Параметрические количественные признаки были описаны в виде средних значений (англ. Mean, M) с учетом ошибки репрезентативности (m). Сравнительный анализ параметрических признаков проводили с помощью t-критерия Стьюдента (англ. Student’s t-Test), непараметрические количественные признаки оценивали с помощью U-критерия Манна — Уитни (англ. Mann — Whitney U-Test). Для сравнения качественных признаков использовали χ 2-критерий Пирсона (англ. Pearson’s χ 2-Test) и критерий Фишера (англ. Fisher’s Test). Для сравнения кривых выживаемости использовался логарифмический ранговый критерий. При обработке статистических данных уровень значимости считался достоверным при p < 0,05.
Результаты
При случайном распределении пациентов по статусу cN не было статистически значимых отличий между группами по статусу cT (p < 0,05). Во время проведения ТЛАЭ в ходе РАРЦ у 20 пациентов (66,7 %) интраоперационно при использовании режима визуализации в ближнем инфракрасном диапазоне спектра отмечена флуоресценция регионарных тазовых лимфатических узлов. При интраоперационной макроскопической оценке в белом свете у 13 пациентов (43,3 %) обнаружены признаки патологического поражения лимфатических узлов малого таза. При этом у всех 14 пациентов (100 %) с признаками лимфаденопатии при визуализации в ближнем инфракрасном диапазоне спектра наблюдалась ICG-флуоресценция лимфатических узлов. Для удобства интерпретации результатов ТЛАЭ все регионарные лимфатические узлы малого таза были разделены на подгруппы по топографо-анатомическому признаку. Выделены запирательные, глубокие запирательные, наружные подвздошные и общие подвздошные лимфатические узлы слева и справа. Удаленный макропрепарат представлен на рис. 1.
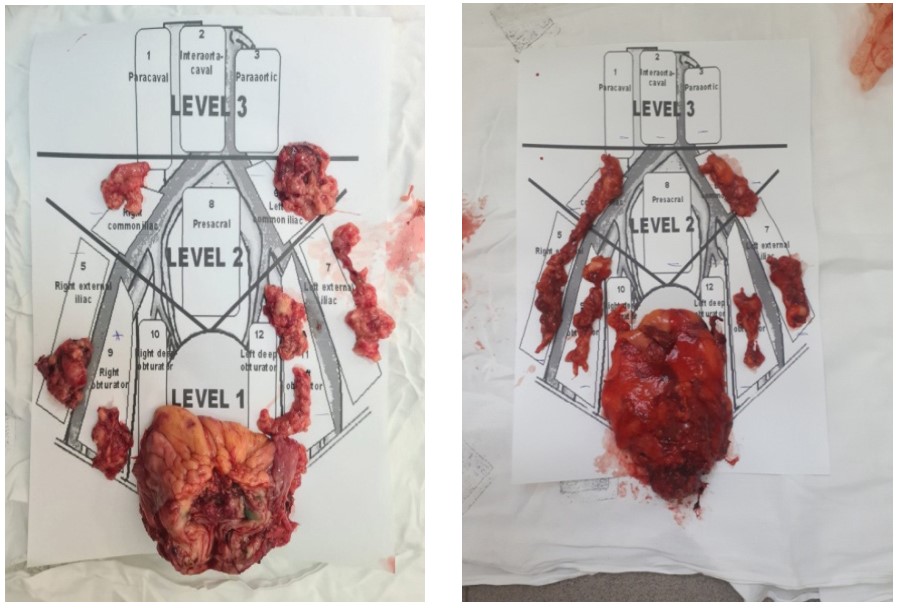 Рис. 1. Внешний вид удаленных комплексов лимфатических узлов (а) и пораженных опухолью
мочевых пузырей (б)
Рис. 1. Внешний вид удаленных комплексов лимфатических узлов (а) и пораженных опухолью
мочевых пузырей (б)
Тотальная ICG-флуоресценция регионарных лимфатических узлов отмечена у 9 пациентов (45,0 %), у 7 пациентов (35,0 %) флуоресцировали минимум два лимфатических узла из разных подгрупп, у 4 пациентов (20,0 %) наблюдалась флуоресценция одного лимфатического узла из одной внутрирегионарной подгруппы. По результатам послеоперационного патоморфологического исследования у 18 пациентов верифицирована стадия pN+, при этом у 14 пациентов (77,8 %) — pN1, а у 4 (22,2 %) — pN2. У всех пациентов из группы cN+ выставлена стадия pN+, у 3 пациентов из группы cN0/NX — стадия pN+. Среди 18 пациентов со стадией pN+ 9 пациентов (50 %) имели тотальную регионарную интраоперационную ICG-флуоресценцию, 6 пациентов (33,3 %) имели флуоресценцию как минимум в двух лимфатических узлах из разных регионарных подгрупп, 2 пациента (11,1 %) имели флуоресценцию одного лимфатического узла из одной внутрирегионарной подгруппы, а 1 пациент (5,6 %) не имел флуоресценцию ICG. Стоит отметить, что 3 пациента из группы cN0/NX с подтвержденным в дальнейшем pN+ имели микрометастатический характер поражения, при этом во всех 3 случаях (100 %) обнаружена ICG-флуоресценция соответствующих регионарных лимфатических узлов. Таким образом, по результатам первичной оценки интраоперационной ICG-визуализации лимфатических узлов у 30 пациентов с МИРМП после РАРЦ зафиксирован 1 ложноотрицательный результат с отсутствием ложноположительных. Чувствительность метода интраоперационной ICG-визуализации составила 94,4 % (отношение числа истинно положительных результатов к сумме ложноотрицательных и истинно положительных), а специфичность — 83,3 % (отношение истинно отрицательных к сумме истинно отрицательных и ложноположительных). Также стоит отметить ценность применения ICG-визуализации для пациентов с наличием стадии cN+ в целях последующей верификации pN+. Затем проводилось иммуногистохимическое исследование с использованием моноклональных антител CD68 и СD163 для определения уровней экспрессии МАО. Высокие уровни экспрессии CD68 и CD163 статистически значимо преобладают в группе cN+ (p = 0,027 и p = 0,018 соответственно). В то же время внутри группы cN+ и cN0/NX отсутствуют статистически значимые различия между характеристиками реакций с CD68 и CD163 (p > 0,05). Полученные результаты иммуногистохимических реакций с CD68 и CD163 отражены в табл. 2.
Таблица 2
Результаты иммуногистохимического исследования МАО
| Параметры иммуногистохимической реакции | cN0/NX (n = 15), M±m | p | cN+ (n = 15), M±m | p | ||
|---|---|---|---|---|---|---|
| CD68 | CD163 | CD68 | CD163 | |||
| Количество окрашенных клеток, % | 36,8±5,7* | 24,9±7,2** | >0,05 | 91,5±4,3* | 88,1±6,2** | >0,05 |
| Интенсивность экспрессии, баллы (по шкале оценки от 0 до 3) | 0,9±0,3 | 1,1±0,8 | >0,05 | 2,1±0,2 | 2,5±0,3 | >0,05 |
Примечания: * р = 0,027; ** р = 0,018
Коэффициент ранговой корреляции Спирмена (англ. Spearman’s Rank Correlation Coefficient) между количеством окрашенных клеток и интенсивностью экспрессии составил r = 0,917, p < 0,05. У всех пациентов (100 %) с высокими уровнями CD68 и CD163 интраоперационно наблюдалась ICG-флуоресценция регионарных лимфатических узлов.
После проведенного оперативного лечения нами ежемесячно регистрировались статусы пациентов. Для анализа выживаемости фиксировалась дата смерти пациента, причина смерти, дата возникновения рецидива злокачественного процесса. В структуре результатов гистологических исследований удаленных в ходе операций материалов наблюдалось преобладание патоморфологической стадии pT2 и pN+, а подробная характеристика послеоперационного распределения пациентов по критериям pT, Grade и pN отражена в табл. 3.
Медиана наблюдения составила 20 мес., максимальный период наблюдения ограничивался 36 мес. После обработки данных строились графики для определения ОВ, ОСВ и БРВ. Полученные результаты отражены на рис. 2–4.
Таблица 3
Характеристика онкологических параметров пациентов МИРМП после РАРЦ
| Онкологические критерии | Количество пациентов | |
|---|---|---|
| абс. | % | |
| Патоморфологическая стадия | ||
| pT1 | 5 | 2,4 |
| pT2 | 91 | 45,1 |
| pT3 | 68 | 33,7 |
| pT4 | 38 | 18,8 |
| Степень дифференцировки | ||
| G1 | 5 | 2,5 |
| G2 | 44 | 21,8 |
| G3 | 150 | 74,2 |
| G4 | 3 | 1,5 |
| Статус pN | ||
| pN0 | 39 | 19,3 |
| pN+ | 163 | 80,7 |
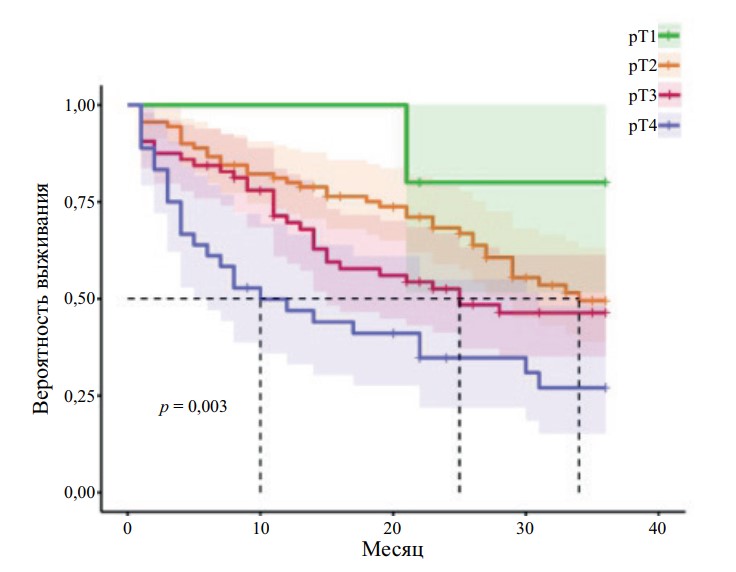 Рис. 2. Общая выживаемость пациентов с МИРМП после РАРЦ в зависимости от статуса pT
Рис. 2. Общая выживаемость пациентов с МИРМП после РАРЦ в зависимости от статуса pT
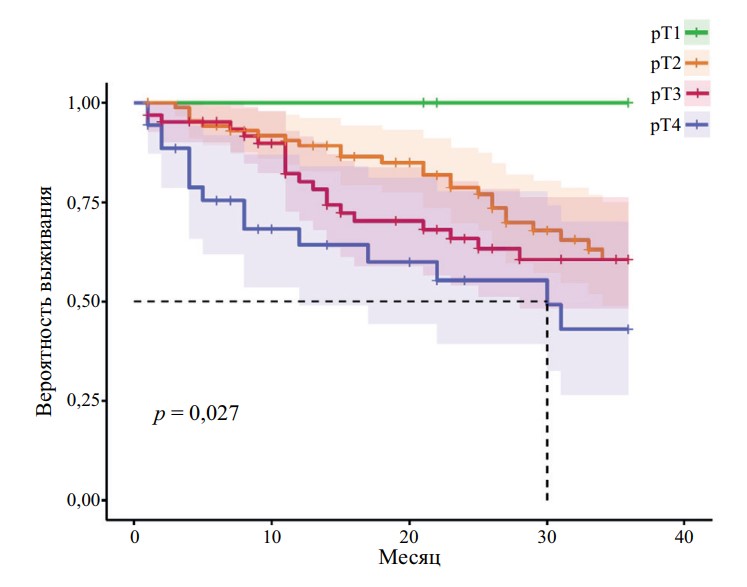 Рис. 3. Опухоль-специфическая выживаемость пациентов с МИРМП после РАРЦ в зависимости от статуса pT
Рис. 3. Опухоль-специфическая выживаемость пациентов с МИРМП после РАРЦ в зависимости от статуса pT
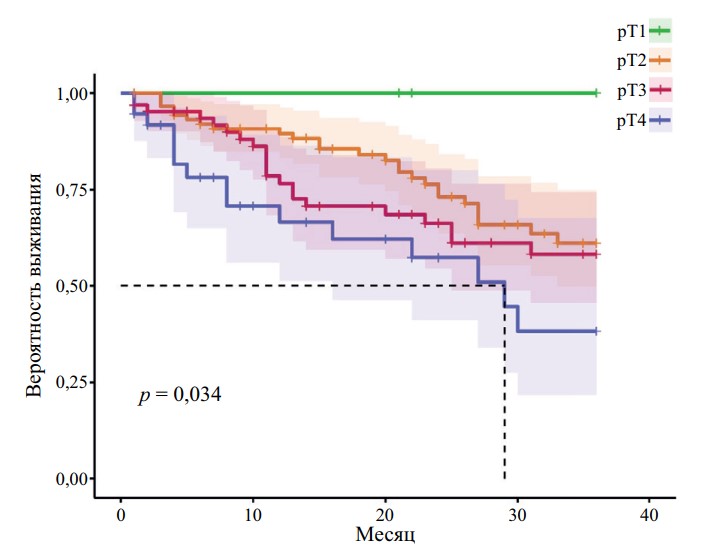 Рис. 4. Безрецидивная выживаемость пациентов с МИРМП
Рис. 4. Безрецидивная выживаемость пациентов с МИРМП
после РАРЦ в зависимости от статуса pT
На всех графиках наблюдается достоверное снижение выживаемости пациентов с увеличением стадии pT (r = 0,952, p < 0,05). Получены статистически достоверные показатели выживаемости для групп pT1–pT4 (p < 0,05 для ОВ, ОСВ, БРВ). При стадии pT4 медиана ОВ — 10 мес., ОСВ — 30 мес., БРВ — 29 мес. При стадии pT3 медиана ОВ — 25 мес., а при стадии pT2 — 34 мес.
Обсуждение
РЦ по праву считается уникальной операцией в урологии, поскольку совмещает в себе строгие требования радикализма, абластики и оригинальные реконструктивно-пластические манипуляции для восстановления пути мочевыделения. В настоящее время имеется много работ, посвященных разным аспектам применения РАРЦ в структуре лечения пациентов с МИРМП. В ряде исследований оцениваются периоперационные хирургические результаты. Критериями для них выступают объемы и частоты гемотрансфузий, среднее время оперативного вмешательства, продолжительность послеоперационного пареза кишечника и среднее время госпитализации. Стоит отметить, что в большинстве работ демонстрируются либо сопоставимые, либо превосходящие показатели РАРЦ над открытой РЦ (ОРЦ) или лапароскопической РЦ (ЛРЦ) [16, 22, 23]. Определенную роль для понимания текущего статуса РАРЦ также играют онкологические результаты.
В систематическом обзоре Дж. Х. Хан и др. (англ. J. H. Han et al.) продемонстрировано отсутствие серьезных различий между онкологическими показателями после ОРЦ и РАРЦ, что позволяет нам судить об эффективности робот-ассистированного подхода [24].
В рандомизированном клиническом исследовании Дж. В. Ф. Катто и др. (англ. J. W. F. Catto et al.) проведен анализ влияния РАРЦ на послеоперационную смертность в сравнении с ОРЦ. Доказано, что среди пациентов с неметастатическим РМП, перенесших РАРЦ, определялось достоверно меньшее количество смертей по сравнению с ОРЦ [25].
Результирующей работой среди многих исследований выступает систематический обзор и метаанализ, проведенный Б. П. Раи и др. (англ. B. P. Rai et al.), где с позиций многокомпонентного анализа крупных рандомизированных клинических исследований сравнивались хирургические, онкологические и функциональные результаты после РАРЦ и ОРЦ. Авторы заявили об отсутствии значимых отличий по онкологическим результатам между двумя вмешательствами. Робот-ассистированная методика, по данным исследования, существенно снижает потребности в интраоперационной гемотрансфузии и сокращает сроки пребывания в стационаре [26].
В работе А. Мортезави и др. (англ. Mortezavi et al.) исследуются результаты 3 169 РЦ, проведенных по поводу МИРМП. 889 пациентам была выполнена РАРЦ, а 2 280 — ОРЦ. Медиана наблюдения составила 47 мес. По истечении 5 лет после проведенных РЦ показатели смертности в группе ОРЦ составили 30,2 %, а в группе РАРЦ — 27,6 %. Пятилетняя ОВ в группе ОРЦ составила 57,7 %, в группе РАРЦ — 61,4 %. Семилетняя ОВ в группе ОРЦ — 51,2 %, в группе РАРЦ — 58,2 % (p = 0,01) [27].
С появлением задокументированных преимуществ робот-ассистированной техники по сравнению с открытой и лапароскопической становится очевидно, почему значительно вырос интерес к РАРЦ. Сама суть РАРЦ как малоинвазивного метода, а также ассоциированные с ней лучшие интраоперационные показатели, низкие частоты осложнений и сроки госпитализации соответствуют требованиям протоколов fast track — раннего восстановления после хирургических вмешательств (англ. Enhanced Recovery After Surgery, ERAS; программа ускоренного выздоровления, ПУВ). По этой причине идеология РАРЦ не противоречит современным требованиям хирургической помощи онкоурологическим пациентам. Изучение особенностей злокачественного новообразования требует дополнительных морфологических и молекулярных исследований. Полученные результаты позволяют определять чувствительность опухоли к тому или иному методу лечения, оценивать ожидаемые ответы на терапию, прогнозировать выживаемость. МАО являются ключевыми участниками иммуноопосредованных реакций в неопластическом очаге. Непосредственное участие МАО в процессах канцерогенеза делает их предметом изучения для последующего таргетного воздействия. Преобладание M2-фенотипа МАО указывает на прогрессирование злокачественного процесса и может быть ассоциировано с плохим прогнозом [28]. МАО являются самыми многочисленными иммунными клетками в составе МО со средней плотностью 14,55 клеток/мм2 в ядре опухоли при МИРМП [29]. Проводится множество исследований — как направленных на изучение влияния уровня и структуры МАО на прогноз после лечения РМП, так и для подбора чувствительной терапии [30, 31].
В нашем исследовании впервые в мировой литературе представлены результаты многокомпонентного анализа применения РАРЦ при лечении пациентов с МИРМП. Использование метода дополненной интраоперационной визуализации с применением ICG позволяет верифицировать большее количество пораженных регионарных лимфатических узлов. Полученные нами данные свидетельствуют о высокой надежности и эффективности применения интраоперационной ICG-флуоресценции для пациентов с МИРМП. Увеличение количества интраоперационно диагностируемых опухолевых и метастатических узлов оказывает влияние не только на оперативное вмешательство, делая его более радикальным, но и на продолжительность жизни в послеоперационном периоде. В нашей работе доказано значительное увеличение сроков выживаемости у пациентов после РАРЦ. Другой стороной использования робот-ассистированного подхода в аспекте улучшения онкологической эффективности оперативного вмешательства при МИРМП выступает определение в послеоперационном периоде уровней МАО. Соблюдение принципов абластики, антибластики и радикализма позволяет не только получить макропрепарат для стадирования патологического процесса, но и обеспечить надежное избавление организма от неоплазии. Иммуногистохимический анализ МАО выступает важной опцией патоморфологического исследования для прогнозирования послеоперационной выживаемости, что в совокупности с робот-ассистированной операцией способно улучшить качество жизни пациентов с МИРМП.
Полученные нами результаты совпадают с общемировой тенденцией в этом направлении — РАРЦ демонстрирует высокие показатели ОВ, ОСВ и БРВ. Методика интраоперационной ICG-визуализации выступает ценным инструментом оптимизации оперативного вмешательства и стадирования лимфатических узлов. Обнаружение маркеров опухолевых макрофагов (CD68, CD163) при РМП предстает перспективным направлением в изучении закономерностей канцерогенеза, что позволит персонифицировано подходить к лечению МИРМП, прогнозировать послеоперационную выживаемость. Робот-ассистированная система выступает интегральной платформой, позволяющей эргономично совершенствовать как оперативное пособие, так и продолжительность жизни после него.
Заключение
С позиций доказательной медицины РАРЦ набирает большое значение в структуре мультимодального и комплексного лечения пациентов с МИРМП. Для РАРЦ нами получены высокие значения послеоперационной выживаемости для стадий pT1–pT4. Использование вспомогательных методик, таких как интраоперационная флуоресценция и определение уровней МАО, способствуют повышению качества лечебного процесса за счет персонифицированного подхода к каждому пациенту. Результаты анализа собственного опыта РАРЦ укрепляют ее позиции в структуре оперативного лечения агрессивных форм РМП. Применение робот-ассистированного метода соответствует современным требованиям высокотехнологичной помощи пациентам онкологического и урологического профиля.










