Робот-ассистированная хирургия средостения
Средостение всегда было «ящиком Пандоры» для хирургов, так как в этой сложной анатомической области расположены органы и структуры, являющиеся основой для множества новообразований. Из тканей средостения могут развиться эпителиальные, мезенхимальные, лимфопролиферативные, нейрогенные и герминоклеточные опухоли.
Единой и общепринятой клинической классификации новообразований средостения нет до настоящего времени. Многие специалисты придерживаются следующей классификации:
- первичные новообразования средостения, развивающиеся из собственно тканей средостения или тканей, дистопированных в средостение при нарушении эмбриогенеза;
- вторичные опухоли средостения (метастазы злокачественных опухолей, расположенных вне средостения, медиастинальная форма рака легкого);
- опухоли органов средостения (трахеи, пищевода, вилочковой железы (ВЖ), грудного лимфатического протока, перикарда);
- опухоли из тканей, ограничивающих средостение (плевры, грудной стенки, позвоночника, диафрагмы);
- псевдоопухолевые заболевания (туберкулезный лимфаденит, саркоидоз, эхинококкоз и другие).
Основными трендами современной хирургии являются минимизация операционной травмы и органосбережение 1. Благодаря бурному развитию медицинских технологий, появлению микроинструментария и видеосистем с возможностью получения изображения высокой четкости, основным направлением в последние 20–25 лет стала мини-инвазивная хирургия 2, 3. Попытки широкого внедрения лапароскопических и торакоскопических технологий для выполнения онкологических операций предпринимались лишь в последнее десятилетие. В настоящее время совершенствуются технические приемы и определяются показания к выполнению мини-инвазивных вмешательств у онкологических больных, идет изучение их отдаленных результатов 4–6.
Хирургия средостения считается одним из наиболее сложных разделов современной медицины, она требует точной дооперационной диагностики и хорошего знания анатомии, а также владения прецизионной техникой оперирования. Особенно это касается развивающейся в последние годы мини-инвазивной хирургии средостения, включающей в себя торакоскопическую и робот-ассистированную (РА) методики 7, 8.
Цель исследования: оценить возможности РА операций в хирургическом лечении пациентов с новообразованиями средостения.
Материалы и методы
Национальный медико-хирургический центр имени Н. И. Пирогова одним из первых в нашей стране внедрил в клиническую практику роботизированный хирургический комплекс (РХК) Да Винчи в 2008 г. В 2009 г. эта технология была зарегистрирована по инициативе Пироговского центра как «робот-ассистированная эндовидеохирургия». К настоящему времени накоплен опыт более 1200 оперативных вмешательств в разных анатомических областях.
Первая операция на органах грудной клетки с использованием РХК в России выполнена в Пироговском центре в марте 2009 г. На сегодняшний день наш опыт насчитывает 83 операции. Больше всего вмешательств выполнялось на органах средостения — 49: 39 пациентов оперированы по поводу заболеваний тимуса, 6 — с невриномами заднего средостения, 3 — с кистой, 1 — с тератомой средостения.
В большинстве наблюдений сталкивались с эпителиальными новообразованиями ВЖ, которые были диагностированы у 14 пациентов. Выполнены 13 радикальных тимомтимэктомий и одна циторедуктивная операция, при генерализованной миастении — 25 тимэктомий. У 10 больных произведено РА удаление доброкачественных новообразований средостения.
Все мини-инвазивные вмешательства при новообразованиях средостения выполняли под общим обезболиванием с раздельной интубацией бронхов. Следует отметить особенности анестезиологического обеспечения РА операций. Главной особенностью является затрудненный доступ анестезиолога к пациенту после его подключения к консоли робота. Необходимо заранее продумывать интраоперационный мониторинг основных показателей, выполнить все манипуляции и сосудистые доступы до начала операции.Контроль всех параметров жизнедеятельности во время хирургического вмешательства проводится по монитору.
Как известно, интубация двухпросветной трубкой и однолегочная вентиляция предъявляют повышенные требования к сердечно-сосудистой и дыхательной системам пациента. Существенное значение имеют предоперационная подготовка больного и квалифицированное ведение его в раннем посленаркозном и послеоперационном периодах. С учетом однолегочной вентиляции особенно важна предоперационная оценка функции органов дыхания и сердечно-сосудистой системы.
При генерализованной миастении антихолинэстеразные препараты обычно отменяют в день операции, т. к. они могут увеличить продолжительность действия местных анестетиков эфирного типа и сукцинилхолина. Следует учитывать, что опиоиды и бензодиазепины в премедикации могут вызвать выраженное угнетение дыхания, особенно при тяжелом течении миастении. Во время анестезии можно применять все вспомогательные препараты, кроме деполяризирующих миорелаксантов.
Индукция анестезии выполняется пропофолом с использованием недеполяризующих миорелаксантов небольшой продолжительности действия (рокурония, атракурия) в минимальных дозах. У пациентов с тяжелым и длительным течением миастении с неполной медикаментозной компенсацией краниобульбарных нарушений миорелаксанты предпочитаем не использовать. Глубокая ингаляционная анестезия позволяет обеспечить релаксацию, достаточную для интубации трахеи, в том числе и двухпросветной трубкой. Для поддержания анестезии наиболее целесообразно применять ингаляционные анестетики.
Перевод на самостоятельное дыхание и экстубацию обычно выполняли на операционном столе. При тяжелом течении миастении с высокой вероятностью продленной ИВЛ в послеоперационном периоде сразу после вмешательства пациента переинтубировали на однопросветную эндотрахеальную трубку и переводили на аппаратном дыхании в реанимацию, где в последующем принимали решение о возможности экстубации.
Располагая к моменту первой РА операции опытом более 300 торакоскопических вмешательств на средостении, выполненных как через правую, так и через левую плевральные полости, на этапе освоения новой технологии посчитали наиболее оправданным правосторонний доступ. В дальнейшем также чаще применяли правосторонний доступ. Это связано с бо’льшим пространством в правой плевральной полости и лучшими возможностями для движения манипуляторов, а также с тем, что при операции на переднем средостении один из троакаров вводим в плевральную полость в 5-м межреберье по среднеключичной линии. В этом положении при операции через левую плевральную полость инструмент может оказывать давление на сердце, приводя в некоторых позициях к нарушениям сердечной деятельности.
Больного укладывали на спину с поворотом груди налево под углом примерно 30 градусов с валиком вдоль правой половины спины. Второй валик располагали поперек на уровне угла лопаток. Правую руку фиксировали на подставке.
Операцию начинали с установки манипуляторов, что в последнее время занимает 15–20 минут, во время освоения технологии докинг был более продолжительным. Консоль пациента располагали у головного конца операционного стола со смещением на 45 градусов ближе к спине больного (рис. 1).
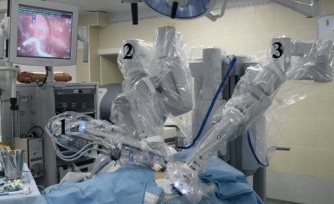 Рис. 1. Расположение консоли пациента у операционного стола. 1–3 — «руки»
оперирующей части роботизированной системы.
Здесь и далее в статье фото авторов
Рис. 1. Расположение консоли пациента у операционного стола. 1–3 — «руки»
оперирующей части роботизированной системы.
Здесь и далее в статье фото авторовПосле выключения из вентиляции правого легкого в плевральную полость вводили два троакара 10 мм в 5-м межреберье по средней подмышечной и средне-ключичной линии и троакар 10 мм в 3-м межреберье по передней подмышечной линии (рис. 2).
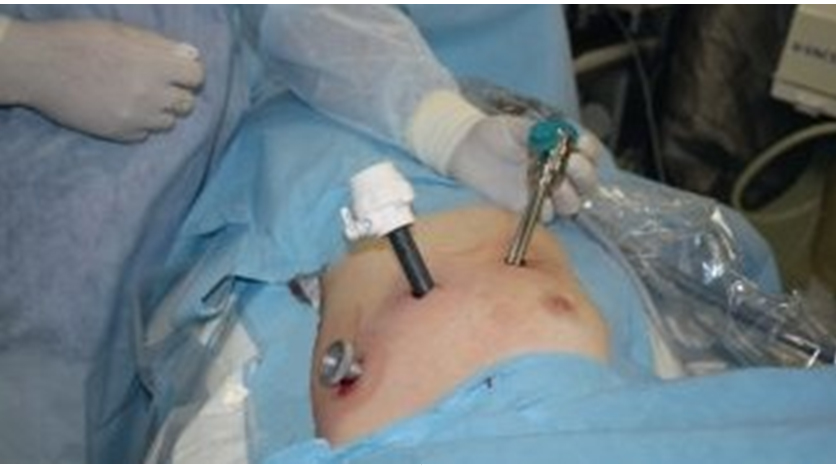 Рис. 2. Расположение троакаров при операциях через левую плевральную полость
Рис. 2. Расположение троакаров при операциях через левую плевральную полостьВидеокамеру вводили через троакар по средней подмышечной линии. С помощью электрокоагуляции вскрывали медиастинальную плевру на расстоянии примерно 1 см медиальнее диафрагмального нерва.
Рассечение плевры начинали снизу от нижнего полюса ВЖ, доходили до внутренних грудных артерий, по задней поверхности грудины переходили на левую сторону, а затем вниз до перикарда (рис. 3).
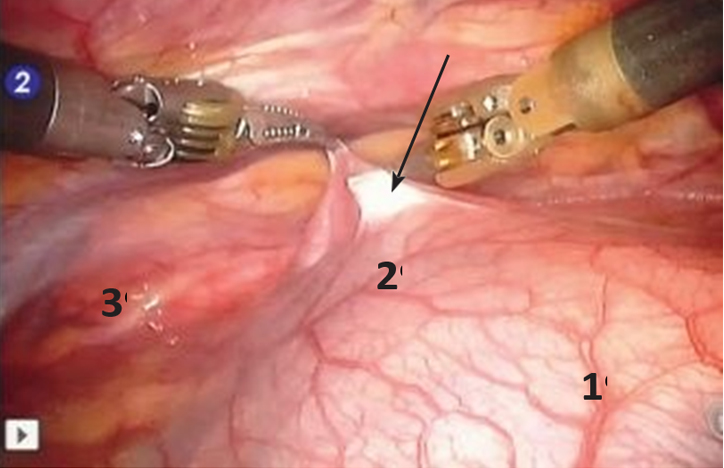 Рис. 3. Вскрытие медиастинальной плевры (указано стрелкой). 1 — перикард, 2 — вилочковая железа, 3 — внутренняя грудная артерия
Рис. 3. Вскрытие медиастинальной плевры (указано стрелкой). 1 — перикард, 2 — вилочковая железа, 3 — внутренняя грудная артерияМобилизацию железы начинали с нижнего полюса правой доли, доходя до впадения левой плечеголовной вены в верхнюю полую. Далее мобилизовывали нижний полюс левой доли. Используя тракции за доли, выполняли экстрафасциальное выделение ВЖ с верхними отростками долей (могут достигать щитовидной железы) и клипированием при необходимости сосудов из внутренней грудной и левой плечеголовной вен. Выделение вены Кейниса показано на рисунке 4.
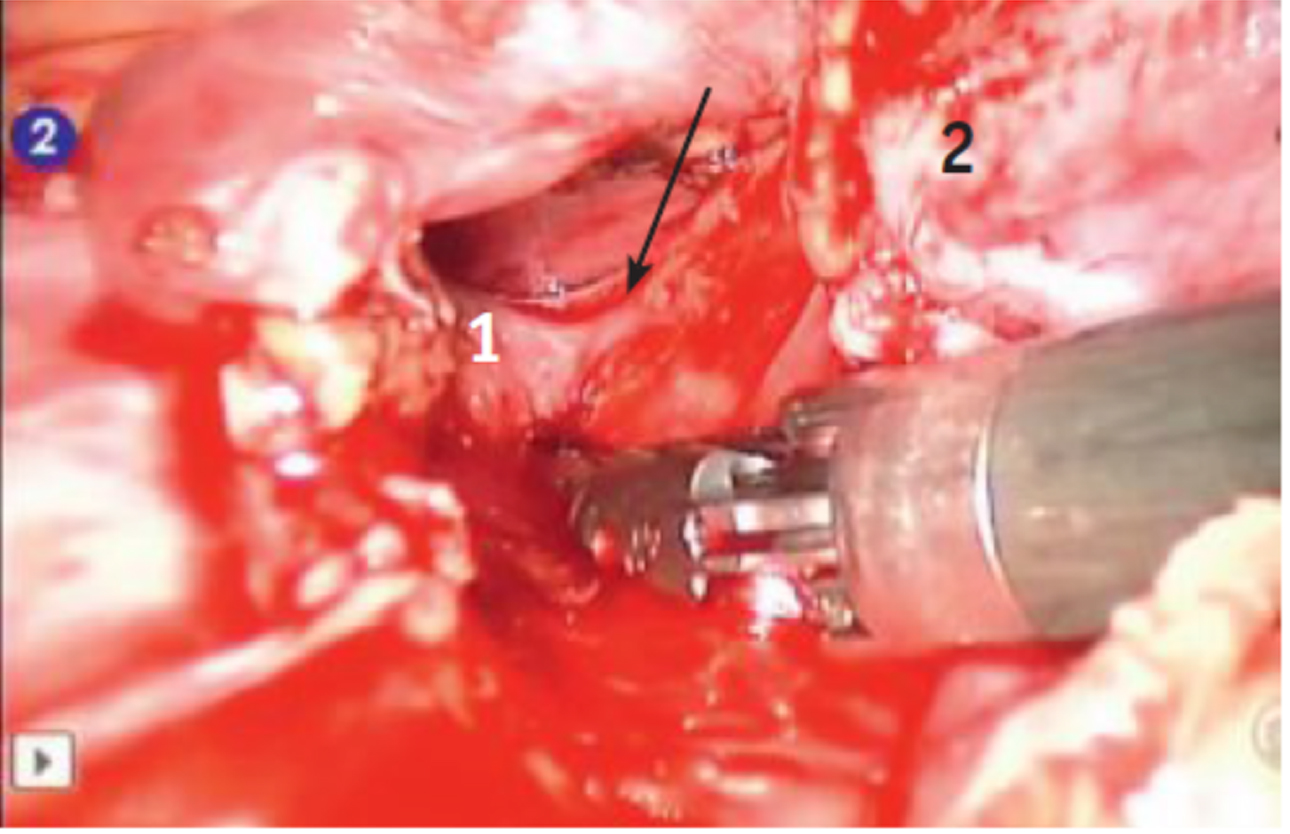 Рис. 4. Выделение вены Кейниса (указана стрелкой). 1 — левая плечеголовная вена, 2 — мобилизованная вилочковая железа
Рис. 4. Выделение вены Кейниса (указана стрелкой). 1 — левая плечеголовная вена, 2 — мобилизованная вилочковая железаМакропрепарат помещали в эндоконтейнер и удаляли через медиальный 10 мм троакар. При больших размерах железы 10 мм троакар меняли на 12 мм троакар. В случаях удаления опухоли большего размера, тимомы, медиальный разрез увеличивали до 2–3 см. После удаления препаратаприема видны свободная от клетчатки левая плечеголовная вена, дуга аорты, перикард (рис. 5).
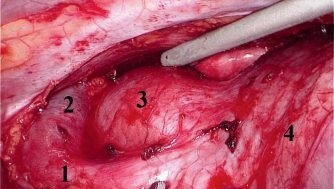 Рис. 5. Конечный вид операционного поля. Видны свободные от клетчатки верхняя полая (1) и левая плечеголовная вены (2), дуга аорты (3), перикард (4)
Рис. 5. Конечный вид операционного поля. Видны свободные от клетчатки верхняя полая (1) и левая плечеголовная вены (2), дуга аорты (3), перикард (4)Операцию заканчивали дренированием плевральной полости на одни сутки.
Результаты
Интраоперационных и послеоперационных осложнений в раннем и отдаленном послеоперационном периоде, а также летальных исходов не было.
Мы сравнили непосредственные результаты у пациентов с опухолями тимуса, которым были выполнены видеотора- коскопические и РА вмешательства (табл.).
| Оперативный доступ | Время операции, мин | Дренирование, сут. | Прием нестероидных противовоспалительных препаратов, сут. | Койко-день, сут. |
| Видеоторакоскопический | 93,6 ± 25,5 | 1,6 ± 0,7 | 1,9 ± 0,8 | 6,6 ± 1,9 |
| Робот-ассистированный | 141,1 ± 27,5* | 1,4 ± 0,5 | 1,6 ± 0,8 | 6,1 ± 1,6 |
* Р < 0,05.
Время операции — период от разреза до «последнего шва». При РА способе время рассчитывалось с учетом докинга (инсталляции консоли пациента).
При сравнении непосредственных результатов прежде всего обращает на себя внимание статистически значимое различие по длительности операций в группах. Бо’льшая продолжительность РА операций, по нашему мнению, связана как с меньшим опытом их выполнения, так и с дополнительными затратами на установку РХК (докинг). Несмотря на то что средняя длительность РА операций выше, чем видеоторакоскопических, нами не отмечены различия в таким показателях, как срок дренирования плевральной полости, длительность приема НПВП и продолжительность послеоперационного койко-дня. Это позволяет судить о том, что хирургическая агрессия при использовании этих методик сопоставима.
Анализ отделенных результатов РА операций с точки зрения онкологического процесса в сроки от 1 до 9 лет показал отсутствие локорегиональных рецидивов и прогрессирования заболевания у пациентов.
Заключение
На основании собственного опыта, совпадающего с данными зарубежных авторов, можно заключить, что применение РХК является безопасным и эффективным методом оперативного лечения пациентов с новообразованиями средостения.
Использование мини-инвазивных технологий по сравнению с традиционными методиками, несомненно, снижает тяжесть операционной травмы, а значит, и риск осложнений, ускоряет восстановление больных и обеспечивает хороший косметический эффект.
В заключение необходимо выделить такое преимущество РХК, как более комфортные условия работы оператора, сидящего за удобной консолью. Улучшенные движения инструментов (7 степеней свободы движений и возможность поворота на 360 градусов) позволяют производить сложные трехмерные манипуляции, обеспечивая безопасную и комфортную препаровку тканей вблизи сосудов, нервов и в отдаленных отделах контрлатерального средостения. Высокое разрешение и трехмерное изображение улучшают качество изображения операционного поля. Устранение тремора рук обеспечивает точность выполняемых визуаль- но-координационных движений.
Отмеченные преимущества РА хирургии, по нашему мнению, могут оказаться полезными при выполнении операций по поводу опухолей с инвазией в соседние органы и анатомические структуры, при сложных топографо-анатомических взаимоотношениях в средостении, требующих повышенной прецизионности оперирования.
Важно отметить, что в нашей стране все вмешательства с применением РХК включены в перечень видов высокотехнологичной медицинской помощи, которые выполняются бесплатно для пациента.
Автор, ответственный за переписку:
Ветшев Пётр Сергеевич — д. м. н., профессор, заместитель генерального директора ФГБУ «НМХЦ им. Н. И. Пирогова» Минздрава России. Е-mail: 22011937@mail.ru






