Робот-ассистированная хирургия рака желудка. Технические аспекты
Резюме
Хирургия рака желудка остается одним из наиболее сложных в техническом плане направлений в абдоминальной онкологии. Частота как интра-, так и послеоперационных осложнений довольно высока, несмотря на современные достижения анестезиологии и уровень технического обеспечения. Робот-ассистированные оперативные вмешательства позволяют продемонстрировать все преимущества малоинвазивных технологий для пациента. Дополнительную безопасность обеспечивает управление одним хирургом работой видеосистемы и роботических инструментов. Технические особенности роботического комплекса могут быть реализованы в улучшении качества выполнения оперативного вмешательства, снижении частоты интра- и послеоперационных осложнений, повышении качества лимфаденэктомии и улучшении онкологических результатов. В статье представлено описание собственной методики проведения оперативных вмешательств при раке желудка с помощью роботического хирургического комплекса. В отличие от зарубежных коллег, которые используют до семи роботических инструментов, разработан и оптимизирован процесс выполнения гастрэктомии и дистальной субтотальной резекции желудка с применением четырех роботических инструментов, что позволяет максимально стандартизировать методику и снизить финансовые затраты. Отдельно описана методика применения индоцианина зеленого с возможностью визуализации в инфракрасном спектре его накопления в лимфатических узлах, являющихся путями лимфогенного метастазирования, что может позволить повысить точность стадирования, определить прогнозы.
Ключевые слова: робот-ассистированная хирургия, рак желудка, онкология, резекция желудка, гастрэктомия.
Для цитирования: Коваленко С.А., Гладышев Д.В., Моисеев М.Е. и др. Робот-ассистированная хирургия рака желудка. Технические аспекты. РМЖ. Медицинское обозрение. 2023;7(4):218–224. DOI: 10.32364/2587-6821-2023-7-4-218-224.
Ведение
Хирургия рака желудка остается одним из наиболее сложных в техническом плане направлений в абдоминальной онкологии. Частота как интра-, так послеоперационных осложнений достаточно высока, несмотря на современные достижения анестезиологии и уровень технического обеспечения [1].
Развитие малоинвазивных хирургических технологий в целом не могло не оказать своего влияния на изменения в подходе к оперативному лечению такой сложной патологии, как рак желудка. Стремление к снижению травматичности оперативного вмешательства с сохранением общего качества операции и сопоставимых онкологических результатов привело к внедрению малоинвазивных лапароскопических и робот-ассистированных технологий в область хирургического лечения рака желудка [2]. Робот-ассистированные операции, в свою очередь, привлекают своими техническими преимуществами, которые могут быть реализованы в улучшении качества выполнения оперативного вмешательства, снижении частоты интра- и послеоперационных осложнений, повышении качества лимфаденэктомии и улучшении онкологических результатов. Известны такие общие преимущества малоинвазивной хирургии, как меньшая травматизация тканей брюшной полости и передней брюшной стенки, вследствие чего снижаются риски развития спаечного процесса, уменьшается степень системной воспалительной реакции, формируется более выраженный косметический эффект. В раннем послеоперационном периоде интенсивность болевого синдрома гораздо меньше, чем после открытых вмешательств. Это способствует ранней активизации и реабилитации, более раннему началу перорального питания, снижению рисков тромбоэмболических осложнений, отказу от применения наркотических анальгетиков, уменьшению продолжительности пребывания в стационаре. Помимо общих преимуществ малоинвазивной хирургии, которые могут быть реализованы при использовании традиционной лапароскопической техники, необходимо отметить и значимые технические особенности роботического хирургического комплекса, привлекательные с точки зрения прецизионности и безопасности [3, 4]:
- 3D-изображение высокой четкости с системой обзора InSite с возможностью инфракрасной навигации и интеграции изображения от других источников видеосигнала, таких как аппарат ультразвуковой диагностики и эндоскопическая стойка (функция TilePro);
- технология EndoWrist — гибкие инструменты с семью степенями свободы, что обеспечивает повышение качества отведения, удержания, диссекции, интракорпорального шва;
- масштабирование движений рук и инструментов;
- устранение физиологического тремора рук оперирующего хирурга;
- блокировка движений манипуляторов при отведении взгляда хирурга от окуляров консоли;
- возможность хирургу самостоятельно управлять тремя инструментами и камерой, что обеспечивает стабильность изображения, возможность экстренного реагирования на неотложную ситуацию;
- функция автофокусировки, калибровки, баланса белого, а также лазерного наведения в системе da Vinci Xi, что способствует ускорению докинга и оптимизации расстановки троакаров;
- удобная эргономика операционной бригады.
Впервые робот da Vinci при хирургическом лечении рака желудка был применен в 2001–2002 г. М. Хашизуме (Япония) и П. Джулианотти (Италия) [4, 5]. Двадцатилетний опыт использования робот-ассистированных технологий показал возможность, безопасность и онкологическую адекватность применения роботического комплекса в оказании хирургической помощи больным раком желудка [6]. К сожалению, в настоящее время не полностью решены проблемные технические аспекты в применении роботического хирургического комплекса. К ним можно отнести:
- статичность консоли пациента и отсутствие возможности смены положения операционного стола во время операции;
- отсутствие тактильной и инструментальной чувствительности, что может компенсироваться визуальной оценкой в постоянном режиме 3D-InSite при накопленном опыте выполнения оперативных вмешательств;
- отсутствие в комплектации встроенного рекордера;
- функция EndoWrist не доступна для гармонического скальпеля, что нивелирует преимущество его использования;
- работа ассистента в формате 2D;
- высокая стоимость роботического комплекса и расходного оборудования.
Несмотря на это, робот-ассистированные оперативные вмешательства позволяют реализовать все преимущества малоинвазивных технологий для пациента, а технические особенности роботического комплекса создают комфортные условия проведения оперативного вмешательства для операционной бригады — с удобной эргономикой, хорошей 3D-InSite-визуализацией, возможностью хирургу самостоятельно контролировать большую часть роботических инструментов и работу камеры, что обеспечивает дополнительную безопасность для пациента. Коллектив СПб ГБУЗ «Городская больница № 40» одним из первых в России стал активно использовать робот-ассистированные операции в абдоминальной онкологии, в том числе у пациентов с раком желудка.
Цель данной работы: описание собственной методики и демонстрация технических аспектов применения роботического комплекса для выполнения оперативных вмешательств при раке желудка.
Техника операций
При выполнении оперативных вмешательств мы использовали два роботических хирургических комплекса da Vinci — Si и Xi.
Докинг
При выполнении оперативных вмешательств при раке желудка нами была использована следующая расстановка троакаров и подключения манипуляторов. При работе на da Vinci Si в левом, правом подреберьях и в правой мезогастральной области по срединно-ключичной линии — по одному рабочему троакару диаметром 8 мм с дальнейшим подключением роботических манипуляторов № 1, 2, 3 соответственно, в умбиликальной зоне — троакар диаметром 12 мм для установки видеосистемы, в левой мезогастральной области по срединно-ключичной линии — ассистентский троакар диаметром 12 мм. При планировании тотальной гастрэктомии в правой мезогастральной области по срединно-ключичной линии устанавливали троакар диаметром 12 мм с дополнительно установленным 8-миллиметровым рабочим троакаром с целью дальнейшего использования линейного сшивающего аппарата. Через разрез в субксифоидальной области длиной 5 мм для отведения левой доли печени устанавливали ретрактор Натансона. При использовании в работе комплекса da Vinci Xi топическая расстановка рабочих и оптического троакаров остается без изменений, отличием же является возможность установки 8-миллиметрового универсального троакара под видеосистему. Таким образом, всего использовалось 5 троакаров (рис. 1). Положение на операционном столе было одинаковым при всех вмешательствах — положение обратного Тренделенбурга.
В отличие от зарубежных коллег, которые используют до семи роботических инструментов, нами разработан и оптимизирован процесс выполнения гастрэктомии и дистальной субтотальной резекции желудка с применением четырех роботических инструментов, что позволяет максимально стандартизировать методику и снизить финансовые затраты [8]. При выполнении оперативных вмешательств мы не используем роботический гармонический скальпель, в отличие от бразильских коллег, считая, что данный инструмент не имеет преимуществ по причине своих конструктивных особенностей [9]. При оперативных вмешательствах используются инструменты: Large Needle Driver, Fenestrated Bipolar Forceps, Monopolar Curved Scissors, ProGrasp Forceps.
Преимущества da Vinci Xi
Комплекс da Vinci четвертого поколения Xi имеет ряд технических особенностей и объективных преимуществ по сравнению с системой предыдущего поколения Si. Консоль (тележка) пациента имеет улучшенную эргономику с высокой мобильностью роботических манипуляторов, вертикальным доступом к пациенту с возможностью дополнительного вращения блока на 360°, что обеспечивает мультиквадратный анатомический доступ из четырех секторов с возможностью однократного докинга. Сенсорная панель консоли пациента с дополнительным программным обеспечением позволяет оптимизировать докинг под конкретную зону оперативного вмешательства и провести подключение консоли с любой стороны от пациента. При использовании системы Si при выполнении оперативного вмешательства при раке желудка докинг возможен только со стороны головы пациента. Лазерное наведение (targeting) помогает в расстановке троакаров и установке оптимального положения манипуляторов, а дополнительная функция patient clearance позволяет избежать конфликта инструментов и расширить спектр работы в операционном поле. Значимые отличительные особенности можно отметить в камере и эндоскопе. Эндоскоп более длинный и имеет универсальный диаметр 8 мм, что позволяет устанавливать его в любой из четырех троакаров. Камера имеет значительно меньший размер и массу с автоматической калибровкой 3D-изображения, автофокусировкой, балансом белого и встроенной системой флуоресцентной визуализации fire fly laser. Хирургический электрогенератор ERBE Vio dV интегрирован в видеостойку и имеет программное обеспечение, позволяющее провести настройки на консоли хирурга.
Робот-ассистированная дистальная субтотальная резекция желудка с D2-лимфаденэктомией
После ревизии брюшной полости и докинга проводили мобилизацию большого сальника с отсечением при помощи монополярных ножниц от ободочной кишки на всем протяжении с проникновением в сальниковую сумку и визуализацией задней стенки желудка. В ряде случаев при опухоли с локализацией по малой кривизне с сТ-стадией 1b–2 выполняли рассечение желудочно-ободочной связки на расстоянии 4–5 см от большой кривизны желудка с сохранением большого сальника. Мобилизацию желудка продолжали в латеральном направлении по межфасциальному слою до уровня нижнего края селезенки с раздельным выделением, клипированием и пересечением левых желудочно-сальниковых вены и артерии у основания с удалением 4sb группы лимфатических узлов, а в случаях сохранения большого сальника левую желудочно-сальниковую артерию пересекали выше отхождения артерии большого сальника (рис. 2 A).
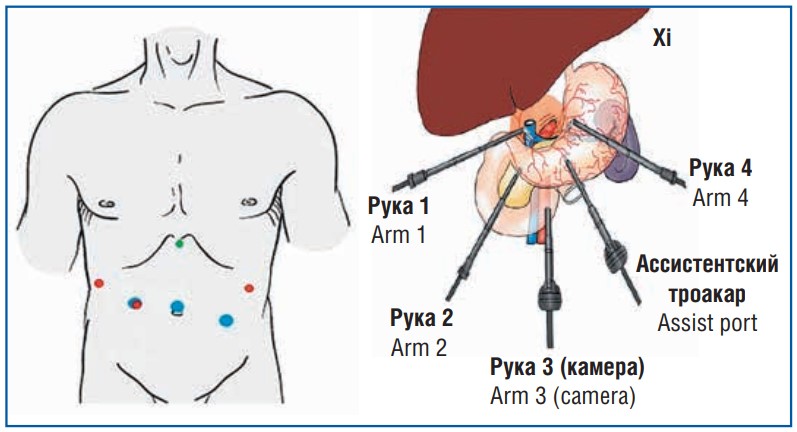 Рис. 1. Схема расстановки троакаров комплекса da Vinci Xi (частично адаптировано по [7])
Рис. 1. Схема расстановки троакаров комплекса da Vinci Xi (частично адаптировано по [7])
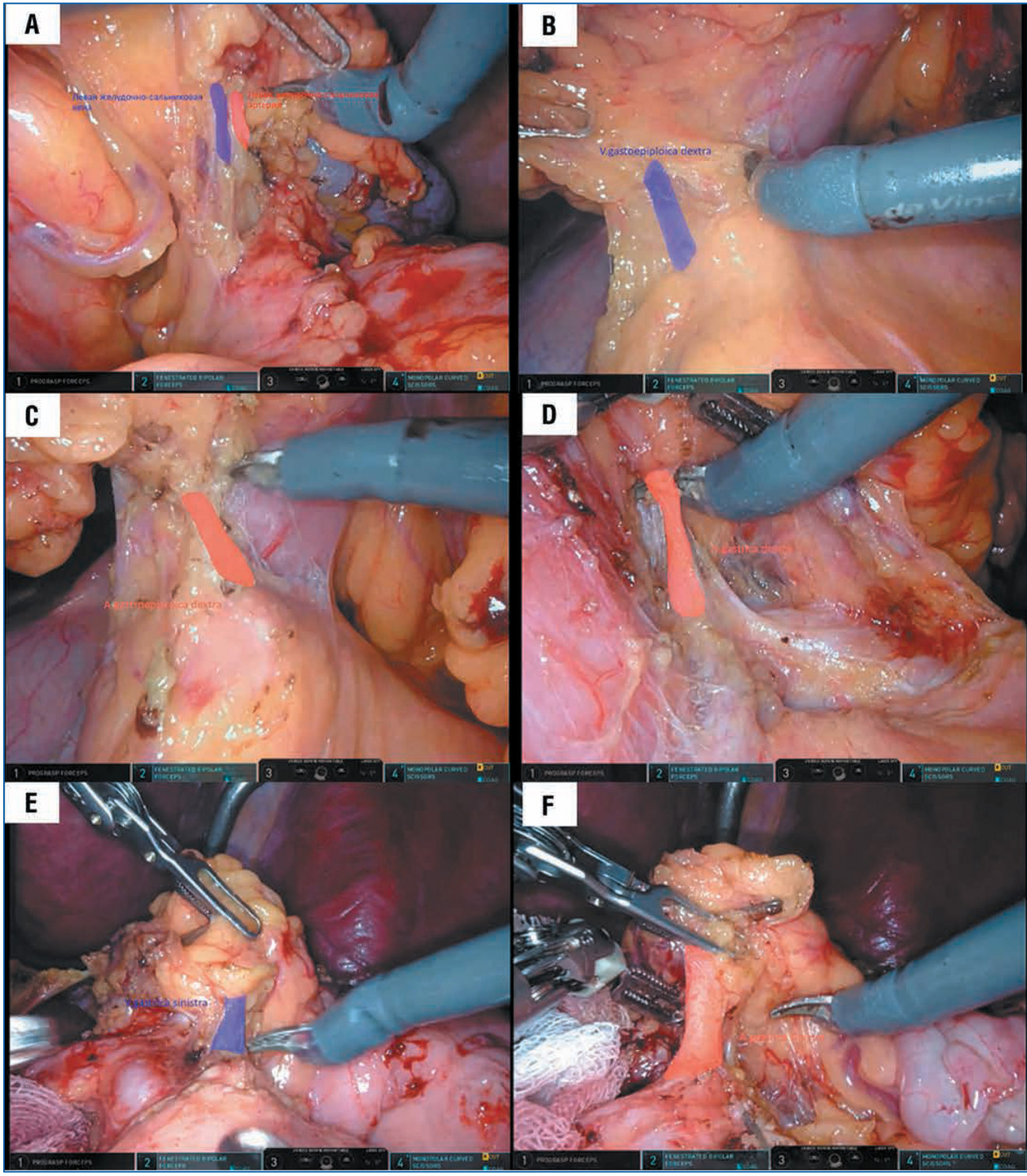
Рис. 2. Этапы робот-ассистированной дистальной субтотальной резекции желудка с D2-лимфаденэктомией:
A — клипирование и пересечение левых желудочно-сальниковых вены и артерии; B — выделение, клипирование и пересечение правой желудочносальниковой вены у места отхождения от желудочно-ободочного ствола Генле; C — выделение, клипирование и пересечение правой желудочносальниковой артерии дистальнее места ветвления a. gastroduodenalis; D — выделение и пересечение правой желудочной артерии у основания; E — выделение, клипирование и пересечение левой желудочной вены; F — скелетизирование чревного ствола с клипированием и пересечением у основания левой желудочной артерии
Дальнейшую мобилизацию осуществляли в медиальном направлении с рассечением фьюжн-фасции с обработкой 6-q группы лимфатических узлов, с выделением, клипированием и пересечением правой желудочно-сальниковой вены у места отхождения от желудочно-ободочного ствола Генле и правой желудочно-сальниковой артерии дистальнее места ветвления a. gastroduodenalis с выделением и визуализацией последней до уровня отхождения от общей печеночной артерии (рис. 2 В, С).
Следующим этапом выполняли мобилизацию задней и верхней стенки двенадцатиперстной кишки с дальнейшим прошиванием и пересечением при помощи линейного сшивающего аппарата. После этого проводили обработку желудочно-двенадцатиперстной связки с лимфаденэктомией 12а группы лимфатических узлов с выделением собственной печеночной артерии и пересечением правой желудочной артерии у основания с последующим отсечением малого сальника у края печени (рис. 2 D). В дальнейшем выполняли рассечение капсулы поджелудочной железы по верхнему краю, выделение общей печеночной артерии с лимфаденэктомией 8а группы лимфатических узлов, выделением, клипированием и пересечением левой желудочной вены и продолжением в латеральном направлении лимфаденэктомии 11р группы лимфатических узлов вдоль селезеночной артерии (рис. 2 E).
Следующим шагом выделяли правую ножку диафрагмы, скелетизировали чревный ствол с клипированием и пересечением у основания левой желудочной артерии с обработкой 9-й и 7-й групп лимфатических узлов (рис. 2 F). Клетчатку кардиоэзофагеальной зоны с удалением 1-й и 3-й групп лимфатических узлов мобилизовали при помощи монополярных ножниц и смещали в сторону препарата.
Желудок прошивали и пересекали при помощи линейного сшивающего аппарата проксимальнее на 5–10 см от опухоли по большой кривизне на уровне нижнего края селезенки, по малой — на уровне кардиального отдела.
Для выполнения реконструктивного этапа операции по Бильрот 2 выделяли петлю тощей кишки в 30 см от связки Трейца и формировали позади- или впереди-ободочный гастроэнтероанастомоз (в зависимости от длины брыжейки тонкой кишки) при помощи линейного сшивающего аппарата с ушиванием технологического отверстия однорядным швом.
Для извлечения препарата из брюшной полости проводили верхне-срединную или левобоковую (в области локализации 12-миллиметрового троакара) мини-лапаротомию с длиной разреза 7–8 см. Межкишечный анастомоз по Брауну формировали интракорпорально при помощи линейного сшивающего аппарата или экстракорпорально ручным однорядным швом.
В случае резекции желудка по Бильрот 1 пересечение желудка проводили на границе средней и нижней трети тела и формировали гастродуоденоанастомоз при помощи линейного сшивающего аппарата с ушиванием технологического отверстия однорядным швом или его закрытием путем прошивания аппаратом с формированием delta-shape-анастомоза. Операцию завершали дренированием подпеченочного пространства на 2–3 сут.
Робот-ассистированная гастрэктомия с D2-лимфаденэктомией
Первые этапы мобилизации осуществляли аналогичным образом. Следующим шагом выделяли селезеночную артерию до ворот селезенки с лимфаденэктомией 10-й группы лимфатических узлов, дальнейшим пересечением желудочно-селезеночной связки с коагуляцией и клипированием коротких желудочных сосудов.
Пищевод выделяли в пищеводном отверстии диафрагмы и пересекали выше кардии при помощи линейного сшивающего аппарата 45 мм (рис. 3 A, B). В ряде случаев проводили интраоперационное эндоскопическое исследование с целью определения оптимальной проксимальной границы резекции. Затем формировали позадиободочный эзофагоэнтероанастомоз на отключенной по Ру петле тонкой кишки с ушиванием технологического отверстия непрерывным однорядным швом или закрытием линейным сшивающим аппаратом с формированием delta shape-анастомоза (рис. 3 C, D). Ру-петлю тонкой кишки фиксировали в окне брыжейки ободочной кишки узловыми швами.
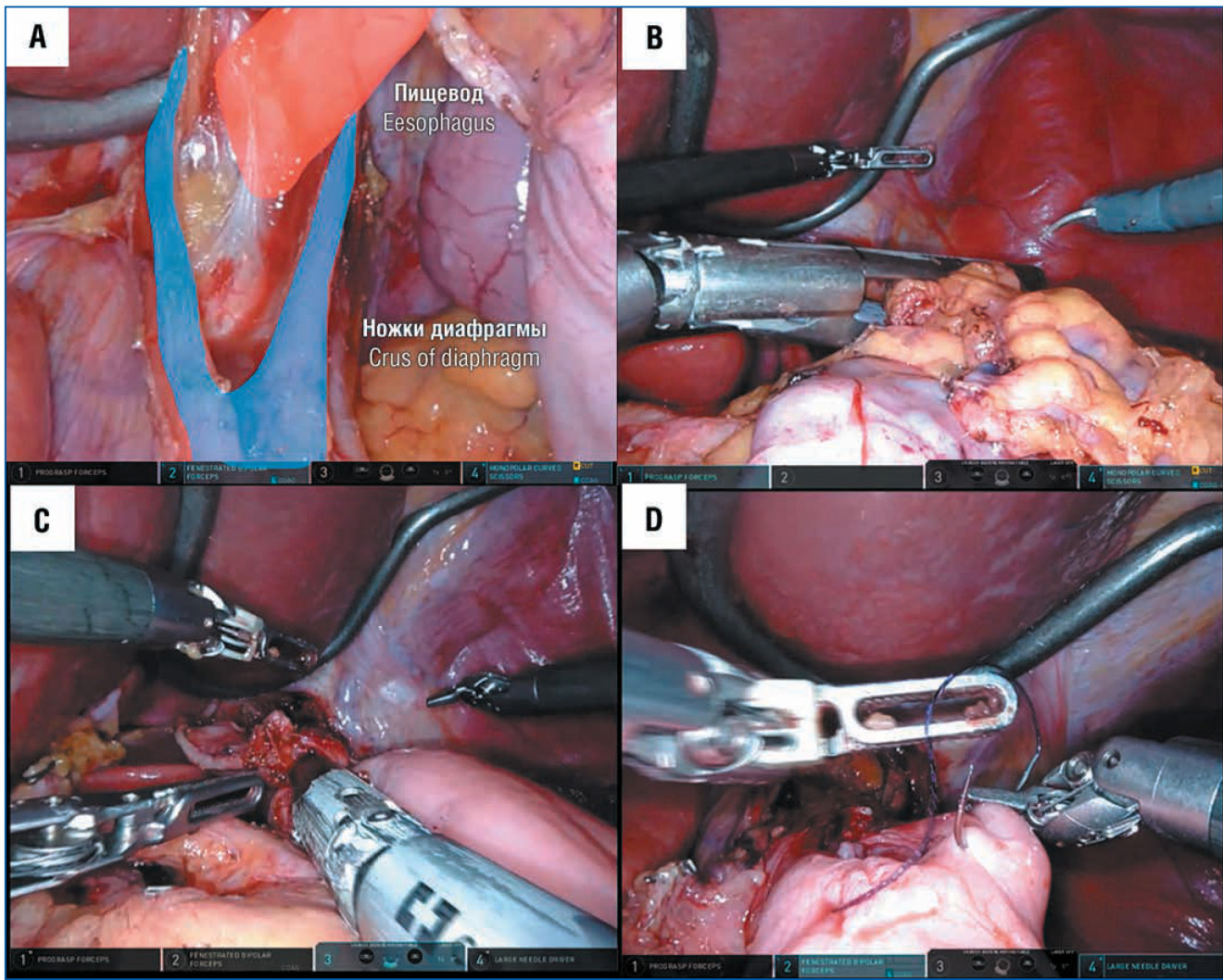 Рис. 3. Этапы робот-ассистированной гастрэктомии с D2-лимфаденэктомией:
Рис. 3. Этапы робот-ассистированной гастрэктомии с D2-лимфаденэктомией:
A — выделение пищевода в пищеводном отверстии диафрагмы; B — пересечение пищевода; C — формирование эзофагоэнтероанастомоза; D — ушивание технологического отверстия
Для извлечения препарата из брюшной полости проводили срединную мини-лапаротомию с длиной разреза 7 см. Операцию завершали дренированием поддиафрагмального пространства на 5 сут.
ICG -навигация, техника картирования лимфатических узлов
Роботический комплекс da Vinci Si не имеет встроенной системы флуоресцентной визуализации fire fly laser, а также нет данной системы и в базовой комплектации, что требует дополнительного оснащения в виде отдельной специальной видеокамеры. Комплекс da Vinci Xi имеет встроенную систему дополнительного инфракрасного лазерного источника излучения (ICG, от англ. Indocyanine green) с проникающей способностью 1,5–2,5 см. С целью контроля полноты D2-лимфаденэктомии использовали два способа введения красителя — индоцианина зеленого (ICG).
Способ № 1 — субмукозное введение: перед этапом докинга выполняли интраоперационную фиброгастроскопию, при помощи эндоскопического инъектора под проксимальную границу опухоли субмукозно вводили раствор ICG, предварительно приготовленный путем добавления 5 мл воды для инъекций во флакон с сухим веществом 25 мг. При таком введении происходит лимфогенное распределение данного препарата, который не является онкотропным, но обладает хорошими лимфотропными характеристиками, накапливаясь в лимфатических узлах, которые потенциально могут являться путями регионарного метастазирования. Данный препарат имеет четко выраженный максимум поглощения в инфракрасной области при 800 нм и максимум эмиссии при флуоресцентном измерении при 830 нм, что использовано производителями в разработке источника инфракрасного излучения. Распределение раствора по лимфатическим сосудам происходило на 15–20-й минуте после введения, прокрашивание регионарных лимфатических узлов — на 30–60-й минуте (рис. 4).
 Рис. 4. ICG-навигация лимфатических узлов
Рис. 4. ICG-навигация лимфатических узлов
Способ № 2 — субсерозное введение: проводили после докинга и установки роботических рабочих инструментов. Собирали инъектор, состоящий из иглы, шприца и капельной системы, который заводили в брюшную полость через 12-миллиметровый троакар. Осуществляли субсерозное введение 5 мл раствора ICG под дистальную или проксимальную границу опухоли при стадии Т4а или непосредственно в проекции опухоли при стадии Т2– Т3. Скорость распространения препарата была аналогичной первому способу.
ICG для оценки кровоснабжения резецируемых органов
При выполнении робот-ассистированной дистальной субтотальной резекции желудка при сомнительной визуализации задней артерии желудка (a. gastrica posterior), а также при слабовыраженных коротких артериях желудка (аа. gastricae breves) в ряде случаев требуется дополнительная оценка кровоснабжения остающейся культи желудка с целью профилактики ее некроза. Для этого внутривенно вводили 5 мл раствора ICG, приготовленного путем добавления 5 мл воды для инъекций во флакон с сухим веществом 25 мг, с дальнейшей оценкой адекватности кровоснабжения через 10–15 мин путем изменения режима визуализации на консоли хирурга.
Заключение
Наш опыт использования роботического хирургического комплекса доказывает возможность его применения в оперативном лечении такой сложной патологии, как рак желудка. По описанной методике нами было прооперировано 79 пациентов, непосредственные результаты оперативных вмешательств будут представлены в отдельной публикации.
Вызывает практический интерес применение ICG с возможностью визуализации в инфракрасном спектре его накопления в лимфатических узлах, являющихся путями лимфогенного метастазирования, особенно тех групп, которые выходят за границы стандартной лимфаденэктомии. По всей вероятности, удаление такой категории пораженных лимфатических узлов не улучшит непосредственное качество оперативного вмешательства с онкологической точки зрения, однако позволит повысить точность стадирования, определить прогнозы и провести коррекцию комбинированной терапии.
К преимуществам разработанной методики с использованием всего четырех роботических инструментов, несомненно, следует отнести возможность снизить финансовую нагрузку на медицинское учреждение.