Робот-ассистированная хирургия при лечении послеоперационных стриктур нижней трети мочеточника
Введение
Стриктуры мочеточника являются редкой патологией мочевыводящей системы. Однако частота встречаемости послеоперационных стриктур мочеточника имеет тенденцию к увеличению от 0,23 до 2,97 % [1]. По слеоперационные стриктуры верхних мочевыводящих путей возникают вследствие несвоевременно выявленных ятрогенных повреждений мочеточника. По статистике причинами интраоперационных уретеротравм в 64–82 % случаев являются гинекологические операции, в 15–26 % — колоректальные и в 11– 30 % — урологические оперативные вмешательства [2]. Стриктуры мочеточника приводят к обструкции верхних мочевыводящих путей и являются причиной развития ряда осложнений: гидронефроза, пиелонефрита, формирования свищей. Все эти осложнения в дальнейшем приводят к прогрессирующему снижению функции почек [3, 4]. В большинстве случаев посттравматические стриктуры мочеточника наблюдаются в нижней трети [2, 5, 6]. Радикальное лечение стриктур мочеточника требует проведения реконструктивных операций. На сегодняшний день существуют два вида хирургических вмешательств при лечении стриктур нижней трети мочеточника: операция Боари или уретероцистонеоанастомоз. Оба вида реконструктивных операций могут быть выполнены с использованием Hitch-psoas пластики [7–9]. Впервые А. Боари, итальянский хирург, описал технику формирования анастомоза мочеточника с лоскутом мочевого пузыря на собаке в 1896 году [10]. В эпоху, когда не были развиты эндоскопические методы лечения, применялись открытые реконструктивные операции мочеточника, в том числе и операция Боари. Впоследствии благодаря развитию эндовидеохирургии были разработаны и внедрены уретероцистонеоанастомоз и операция Боари лапароскопическим способом. Главными преимуществами эндовидеохирургического способа являются снижение продолжительности и интенсивности болевого синдрома в послеоперационном периоде, сокращение сроков госпитализации, а также улучшение косметических исходов [11]. Однако, несмотря на малоинвазивность лапароскопических реконструктивных операций при послеоперационных стриктурах нижней трети мочеточника, их выполнение остается технически сложным вследствие развития рубцового процесса, а также низкой степени свободы инструментов, что ограничивает их применение [12]. Появление роботической хирургии позволило преодолеть недостатки лапароскопической техники, сделав выполнение оперативных вмешательств при лечении стриктур нижней трети мочеточника более совершенным и эффективным [13].
Целью нашего исследования является определение исходов робот-ассистированных реконструктивных операций при лечении послеоперационных стриктур нижней трети мочеточника.
Методы и материалы
Ретроспективно оценивались результаты реконструктивных робот-ассистированных операций при лечении послеоперационных стриктур мочеточника. В ФГБУ «НМИЦ им В. А. Алмазова» за период с октября 2018 по сентябрь 2022 года были госпитализированы 5 пациенток с послеоперационными стриктурами нижней трети мочеточника, полученными в различных медицинских учреждениях страны. По механизму развития посттравматические стриктуры у 2-х пациенток возникли после гинекологических оперативных вмешательств и ещё у 3-х — после эндоскопических урологических операций. Среди них у одной пациентки помимо стриктуры мочеточника имелся посттравматический мочеточнико-влагалищный свищ. У 3-х пациенток до госпитализации в НМИЦ им В. А. Алмазова были установлены нефростомические дренажи вследствие перенесенного ранее обструктивного пиелонефрита. У одной пациентки, перенесшей гинекологическую операцию, нефростомы имелись с обеих сторон. Еще у одной пациентки из-за интраоперационной стриктуры мочеточника проводилось дренирование мочеточниковым стентом.
Предоперационная диагностика включала физикальные, лабораторные и инструментальные методы исследования. Из инструментальных методов диагностики выполнялись ультразвуковое исследование (УЗИ) почек, мультиспиральная компьютерная томография — урография (МСКТ-урография) и диагностическая цистоуретероскопия.
Всем пациенткам для устранения стриктуры нижней трети мочеточника выполнялись реконструктивные робот-ассистированные операции. В двух случаях проводились симультанные операции: робот-ассистированный уретероцистонеоанастомоз справа и операция Боари слева, робот-ассистированная операция Боари и разобщение посттравматического мочеточниково-влагалищного свища. В оставшихся трех случаях двум пациенткам выполнена робот-ассистированная операция Боари, а третьей — робот-ассистированный уретероцистонеоанастомоз с Psoas-hitch. Дренирование верхних мочевыводящих путей осуществлялось установкой мочеточникового JJ-стента во время операции. В ходе пластики применялась рассасывающаяся лигатура (викрил 4/0).
Во всех случаях оперативные вмешательства проводились на хирургической системе Da Vinci Si. Операции осуществлялись трансперитонеальным доступом в положении пациенток на спине. После индукции эндотрахеального наркоза выполнялся лапароцентез в верхней параумбиликальной точке и накладывался карбоксиперитонеум. Троакары da Vinci устанавливались в типичных местах.
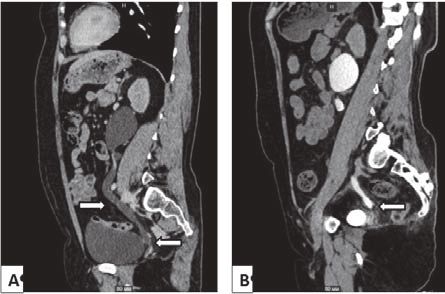
Рисунок 1. MСКТ-урография перед проведение м оперативного вмешательства: А — через 7 минут после введения рентгеноконтрастного вещества; B — через 85 минут после введения рентгеноконтрастного вещества
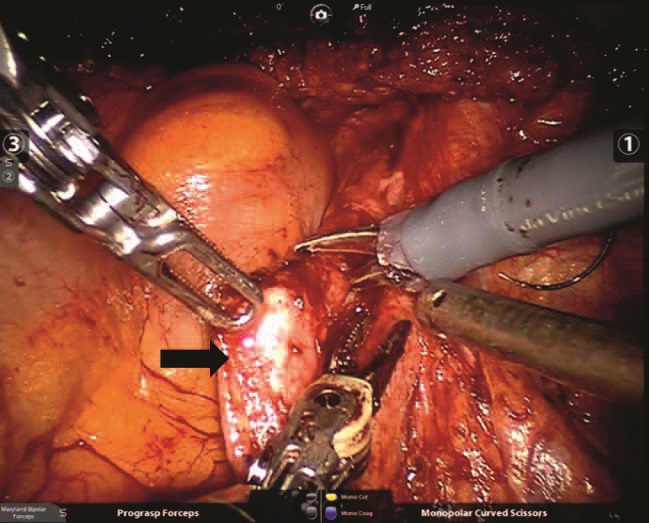
Рисунок 2. Выделение и иссечение рубцово измененной части мочеточника (указано черной стрелкой)
Результаты
В анамнезе у 5 пациенток наблюдался обструктивный пиелонефрит, потребовавший дренирования верхних мочевыводящих путей до госпитализации в НМИЦ им В. А. Алмазова. У пациентки с мочеточниково-влагалищным свищом отмечалось выделение мочи из влагалища. В ходе обследования по результатам МСКТ-урографии стриктуры нижней трети мочеточника были правосторонними у 2-х пациенток, левосторонними у 2-х (рис. 1) и двухсторонними у одной.
Оперативное лечение посттравматических стриктур во всех случаях начиналось с мобилизации нижней трети мочеточника. Рубцово измененная часть мочеточника иссекалась (рис. 2). Дистальный отдел мочеточника перевязывался рассасывающейся лигатурой (Викрил 4/0).
Дальнейший ход операции определялся протяженностью посттравматической стриктуры мочеточника. Так, двум пациенткам с непротяженными стриктурами нижней трети мочеточника выполнялся уретероцистонеоанастомоз. Для устранения возможного натяжения мочеточника дополнительно производилась мобилизация и тракция в краниальном направлении мочевого пузыря с последующей его фиксацией к поясничной мышце по методу Рsoas-hitch. Одной пациентке, у которой имелись стриктуры с двух сторон, выполнены уретероцистонеоанастомоз справа и операция Боари слева.
Еще трем пациенткам, которые имели протяженные стриктуры, проводилась операция по Боари. Для этого при помощи робота-ассистента осуществлялась мобилизация переднебоковой стенки мочевого пузыря с соответствующей стриктуре мочеточника стороны. Из мочевого пузыря выкраивался лоскут необходимых размеров (рис. 3).
Культя мочеточника подводилась к лоскуту мочевого пузыря, и формировался анастомоз (рис. 4).
Во всех случаях перед формированием анастомоза мочеточника с мочевым пузырем интраоперационно устанавливался мочеточниковый стент. После создания анастомоза герметичность мочевого пузыря определялась введением по уретральному катетеру 150 мл 0,9 % раствора NaCl. Операция заканчивалась установкой дренажа в малый таз. Ранее установленные нефростомические дренажи удалялись по окончании операции. Одной пациентке после этапа пластики по Боари выполнялась симультанная реконструктивная операция — разобщение мочеточниково-влагалищного свища.
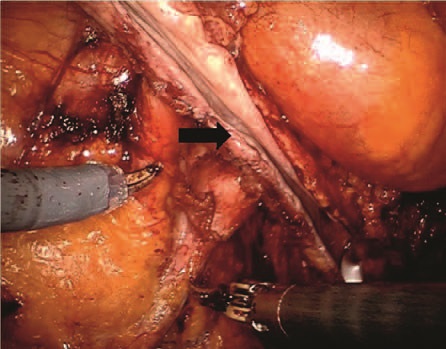
Рисунок 3. Формирование лоскута (черная стрелка) из переднебоковой стенки мочевого пузыря
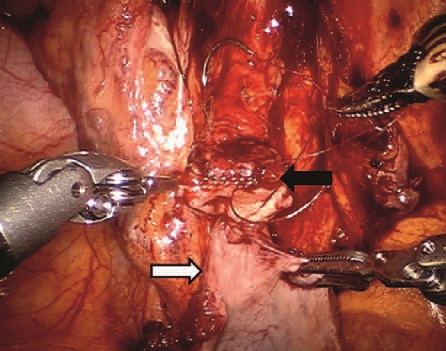
Рисунок 4. Формирование уретероцистонеоанастомоза между выкроенным лоскутом мочевого пузыря (белая стрелка) и здоровой тканью мочеточника (черная стрелка)
Время операций зависело от объема оперативного вмешательства. Так, выполнение одностороннего уретероцистонеоанастомоза заняло 80 мин. Время выполнения операции Боари составило 90 минут. Время проведения симультанной операции Боари, с одной стороны, и уретероцистонеоанастомоза, с другой — 150 минут. На проведение симультанной операции Боари с разобщением мочеточниково-влагалищного свища потребовалось 185 минут. Объем кровопотери в 4 операциях не превышал 150 мл, а в одном случае составил 250 мл. Интраоперационных осложнений не было. Послеоперационный период во всех случаях протекал без осложнений. Дренаж из брюшной полости удалялся на 2–3-и сутки. Удаление уретрального катетера производилось на 7-е сутки, после проведения цистографии с использованием контрастного вещества (рис. 5).
Сроки госпитализации составили от 8 до 12 суток. Спустя 1,5–2 месяца всем пациенткам производилось удаление мочеточникового стента, после чего клинических проявлений обструкции верхних мочевыводящих путей не наблюдалось. Через 3 месяца после оперативного вмешательства проводилась МСКТ-урография, по результатам которой во всех 5 случаях наблюдения данных за стриктуру мочеточника получено не было (рис. 6).
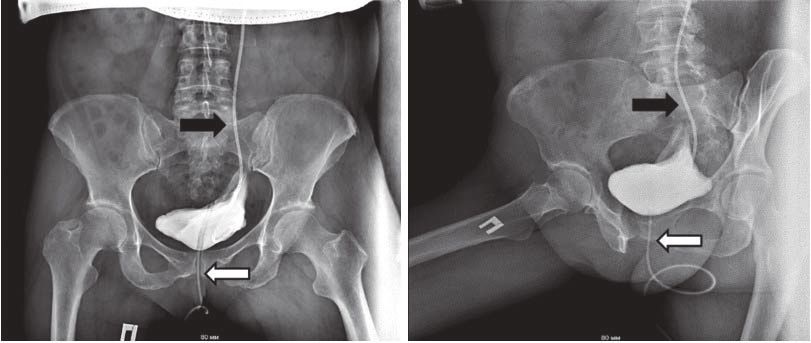
Рисунок 5. Цистография. В левом мочеточнике определяется мочеточниковый JJ-стент (черная стрелка), в мочевом пузыре — уретральный катетер (белая стрелка). Распространения контрастного вещества за пределы мочевого пузыря и области анастомоза не выявлено
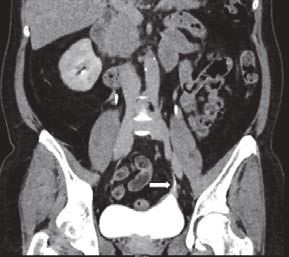
Рисунок 6. MСКТ-урография через 3 месяца после оперативного вмешательства (7-я минута)
Обсуждение
Лечение посттравматических стриктур мочеточника до последнего времени осуществлялось открытыми и лапароскопическими методами. Несмотря на эффективность открытых оперативных вмешательств, данная методика имеет ряд недостатков [14]. При проведении открытых реконструктивных операций в послеоперационном периоде требуется длительное применение обезболивающих препаратов, увеличиваются сроки пребывания пациента в стационаре. Большинство пациентов, особенно женского пола, испытывают психологический дискомфорт из-за протяженных послеоперационных рубцов. Лапароскопический метод, несмотря на преобладание над открытыми хирургическими вмешательствами, имеет ряд ограничений: сложность доступа к стриктуре мочеточника из-за рубцового процесса, ограниченность амплитуды эндоскопических инструментов, что затрудняет создание герметичного анастомоза [12].
Появление робот-ассистированной хирургии позволило объединить преимущества открытых и лапароскопических методик [15, 16], благодаря чему появилась возможность проводить сложные и симультанные реконструктивные оперативные вмешательства при стриктурах мочеточника. В нашей статье предоставлен опыт проведения робот-ассистированных реконструктивных оперативных вмешательств при стриктурах нижней трети мочеточника, где 2 пациенткам выполнялись симультанные операции.
Подводя итог, следует отметить, что робот-ассистированные операции имеют для пациентов хороший косметический эффект и незначительный болевой синдром в послеоперационном периоде вследствие малоинвазивного доступа. Для оперирующего хирурга неоспоримыми преимуществами робот-ассистированных реконструктивных операций при лечении стриктур мочеточника являются возможность 3D-визуализации, высокая степень свободы инструментов, возможность комфортно накладывать интракорпоральные швы и устанавливать мочеточниковые стенты. Дальнейшие исследования могут полностью раскрыть бесспорные преимущества выполнения робот-ассистированных реконструктивных операций. Требуется длительный период наблюдения отдаленных результатов и большая выборка пациентов.
Заключение
Робот-ассистированные реконструктивные хирургические вмешательства являются безопасным и эффективным способом лечения посттравматических стриктур нижней трети мочеточника, позволяющим проведение симультанных реконструктивных операций. Единственным недостатком робот-ассистированных операций являются дороговизна и дефицит роботических хирургических систем.