Робот-ассистированная цистэктомия в лечении больных с уротелиальной карциномой мочевого пузыря
Аннотация
В работе представлена оценка результатов хирургического лечения уротелиальной карциномы мочевого пузыря с помощью роботической системы Da Vinci Si. проанализирован опыт лечения 11 больных, которым была выполнена робот-ассистированная цистэктомия (РАЦЭ). данное исследование демонстрирует эффективность РАЦЭ благодаря минимальной травме, кровопотере, частоте трансфузии и срокам пребывания пациента в стационаре.
Ключевые слова: уротелиальная карцинома; цистэктомия; робот-ассистированная цистэктомия; интракопоральное отведение мочи; эктракорпоральное отведение мочи; операция Штудера; операция Брикера; уретерокутанеостома.
Введение
В настоящее время золотым стандартом хирургического лечения больных неметастатическим мышечно-инвазивным раком мочевого пузыря (МИРМп) и персистирующим неинвазивным раком мочевого пузыря (РМп) высокой степени злокачественности является радикальная цистэктомия (РЦЭ) с расширенной тазовой лимфаденэктомией (ТЛЭ) [1, 2]. учитывая травматичность и её высокую техническую сложность, возраст пациентов и наличие значимых сопутствующих заболеваний, выполнение РЦЭ ассоциировано с высоким риском развития осложнений как в раннем, так и в позднем послеоперационном периоде и отдалённой послеоперационной летальностью [3]. В связи с этим применение робот-ассистированного (РА) подхода в хирургическом лечении больных МИРМп обусловлено необходимостью снижения травматичности операции, улучшения хирургических исходов и обеспечения оптимального уровня качества жизни пациентов в послеоперационном периоде [4].
В 2003 году M. Menon впервые выполнил серию первых робот-ассистированных радикальных цистэктомий (РАЦЭ), доказав перспективность данного подхода в лечении больных МИРМп [5]. В том же году исследовательская группа под руководством W.D. Beecken опубликовала результаты первой в мире интракорпоральной РАЦЭ [6], которая позволила добиться уникальных результатов с позиции клинических исходов пациента и высокого уровня качества жизни в послеоперационном периоде.
Несмотря на отсутствие доказательств I уровня, достоверно подтверждающих преимущества РАЦЭ над РЦЭ, отмечается активное распространение РА подхода в клинической практике. Следует отметить, что ежегодное увеличение числа выполняемых РАЦЭ в мире вызвало многочисленные споры об оптимальном хирургическом подходе в лечении больных МИРМп [2]. технические преимущества РА хирургии в урологии хорошо описаны и доказаны [3]. тем не менее актуальным в настоящее время представляется определение степени влияния РАцЭ на улучшение непосредственных и отдалённых результатов лечения больных МИРМп.
Целью работы явилась оценка непосредственных исходов больных МИРМп после РАЦЭ.
Материалы и методы
В исследование включено 11 больных РМп, которые проходили плановое хирургическое лечение в урологическом отделении отдела онкоурологии ФгБу «нМИц хирургии им А.В. Вишневского» Минздрава России в период с 2020 по 2022 годы включительно. В исследование включены 10 (91%) мужчин и 1 (9%) женщина. Средний возраст пациентов составил 66 ± 6,5 лет. Средний возраст мужчин составил 66,9 ± 6,1 лет, возраст женщины — 57 лет. у одного из пациентов был первичномножественный метахронный рак (пММР) (локализация второй опухоли – предстательная железа). В соответствии с клиническими рекомендациями [4] всем пациентам перед оперативным лечением проводилось комплексное обследование, направленное на исключение других патологических процессов. обязательным являлась проведение компьютерной томографии (Кт) органов грудной клетки, брюшной полости и малого таза с контрастным усилением (Ку), магнитно-резонансная томография (МРт) органов малого таза, гастроскопия и оценка функциональной операбельности, учитывая планируемый высокий травматизм вмешательства.
Выбор метода деривации мочи зависел от возраста пациента, сопутствующей патологии, распространённости опухолевого процесса, а также функционального состояния верхних и нижних мочевыводящих путей. Соответственно, уретерокутанеостомия (уКС) была выполнена четырём (36,4%) пациентам, гетеротопическая пластика (операция Bricker) — четырём (36,4%) пациентам. троим (27,3%) пациентам выполнено формирование ортотопического резервуара по методике Studer. Клиникоанамнестические данные пациентов в предоперационном периоде представлены в таблице 1.
Таблица 1. Клинико-анамнестические данные пациентов в предоперационном периоде
| Показатель Parameter |
Общая выборка General sample (n = 11) |
Группа Studer Studer group (n = 3) |
Группа Bricker Bricker group (n = 4) |
Группа УКС UCS group (n = 4) |
|---|---|---|---|---|
| Пол (М), n Sex (male), n |
10 | 3 | 3 | 4 |
| Пол (Ж), n Sex (female), n |
1 | 0 | 1 | 0 |
| Соотношение мужчин и женщин Male/female ratio |
10 : 1 | 1 : 0 | 3 : 1 | 1 : 0 |
| Возраст, лет * Age, years * |
66,0 (53,0 – 75,0) |
63,3 (53,0 – 73,0) |
65,5 (57,0 – 71,0) |
68,5 (64,0 – 75,0) |
| ИМТ, кг/м² * BMI, kg/m² * |
26,7 (21,0 – 40,4) |
28,3 (27,7 – 29,4) |
27,4 (21 – 40,4) |
23,5 (21,3 – 29,4) |
| Сопутствующие заболевания, n (%) Comorbidity, n (%) |
7 (63,6) | 2 (66,7) | 3 (75,0) | 2 (50,0) |
| Сахарный диабет, n (%) Diabetes mellitus, n (%) |
4 (36,3) | 1 (33,3) | 2 (50,0) | 1 (25,0) |
| Ожирение, n (%) Obesity, n (%) |
1 (9,0) | 0 | 1 (25,0) | 0 |
| ИБС, n (%) Coronary disease, n (%) |
4 (36,3) | 1 (33,3) | 2 (50,0) | 1 (25,0) |
Примечание. ИМт — индекс массы тела; ИБС — ишемическая болезнь сердца; уКС — уретерокутанеостомия; * среднее (min – max)
У всех 11 пациентов наблюдался морфологически подтверждённый РМп. по системе TNM стадия варьировалась: pT1–3b, pN0–2, M0. по данным патоморфологического исследования у двух (18,2 %) пациентов выявлена pT1 стадия, у трёх (27,3 %) пациентов — pT2a, у одного (9,0%) — pT2b, у двух (18,2 %) пациентов — pT3a, у одного (9,0 %) — pT3b, у двух (18,2 %) пациентов — p4a. Метастазы в регионарные лимфоузлы выявлены у трёх пациентов: у одного (9,0 %) — pN1, у двух (18,2 %) — pN2. у всех пациентов при проведении гистологического исследования подтверждена мышечноинвазивная уротелиальная карцинома high-grade. Стадирование пациентов по системе TNM приведено в таблице 2.
Таблица 2. Стадирование пациентов по системе TNM
| Стадия TNM TNM stage |
N = 11 n (%) |
|---|---|
| pT1 | 2 (18,2) |
| pT2a | 3 (27,3) |
| pT2b | 1 (9,0) |
| pT3a | 2 (18,2) |
| pT3b | 1 (9,0) |
| pT4a | 2 (18,2) |
| pN1 | 1 (9,0) |
| pN2 | 2 (18,2) |
Методика выполнения РАЦЭ. Всем пациентам оперативное лечение выполнялось на роботической системе Da Vinci Si (“Intuitive Surgical, Inc.”, Sunnyvale, CA, USA). В положении пациента на спине со слегка опущенным ногами и валиком под крестцом (положение Trendelenburg 25° – 30°) после введения пациента в наркоз, антибиотикопрофилактики и трёхкратной обработки кожных покровов, выполняли разрез длиной 1 см выше пупка для установки первого роботического порта. после инсуффляции брюшной полости до 10 – 12 мм рт. ст. при помощи иглы Veress выполняли установку 12 мм порта для камеры. при выполнении РАцЭ использовали камеру 0°. после ревизии брюшной полости выполняли установку оставшихся портов под контролем камеры. первые два роботических порта 10 мм устанавливали на уровне параллельном пупку слева и справа от латеральных краев мышц живота на расстоянии около 5 см от камеры. третий роботический порт 10 мм располагали справа, на уровне правой подвздошной области на 1 см к внутри от гребня подвздошной кости. Ассистентский порт 12 мм устанавливали слева зеркально третьей роботической руке. Второй ассистентский порт 5 мм также устанавливали слева на уровне 1 см к внутри от середины между камерой и левой роботической рукой (рис. 1).
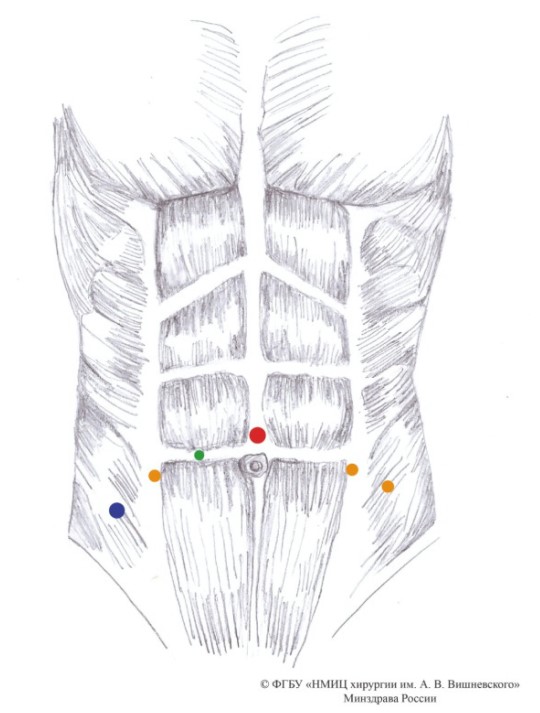 Рисунок 1. точки установки роботических портов (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России): синий цвет — 12 мм ассистентский порт, красный цвет — 12 мм порт камеры, желтый цвет — 8 мм порт роботических манипуляторов, зеленый цвет — 5 мм ассистентский порт
Рисунок 1. точки установки роботических портов (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России): синий цвет — 12 мм ассистентский порт, красный цвет — 12 мм порт камеры, желтый цвет — 8 мм порт роботических манипуляторов, зеленый цвет — 5 мм ассистентский порт
Одним из наиболее важных этапов РАЦЭ является выполнение подвздошнообтураторной лимфаденэктомии. проводили выделение наружной подвздошной артерии и вены справа, удаляли клетчатку и лимфоузлы, окружающие данные сосуды с использованием биполярной коагуляции. Выделена развилка подвздошных сосудов, удалена клетчатка из данной области, обработаны внутренняя подвздошная артерия и вена, а также обтураторная область с выделением обтураторного нерва, обтураторной артерии. после выполнения гемостаза выполняли аналогичные манипуляции с левой стороны. Выполнено выделение наружной подвздошной артерии и вены слева, удалена клетчатка и лимфоузлы, окружающие данные сосуды с использованием биполярной коагуляции. Выделена развилка подвздошных сосудов, удалена клетчатка из данной области, обработана внутренняя подвздошная артерия и вена, а также обтураторная область с выделением обтураторного нерва, обтураторной артерии (рис. 2).
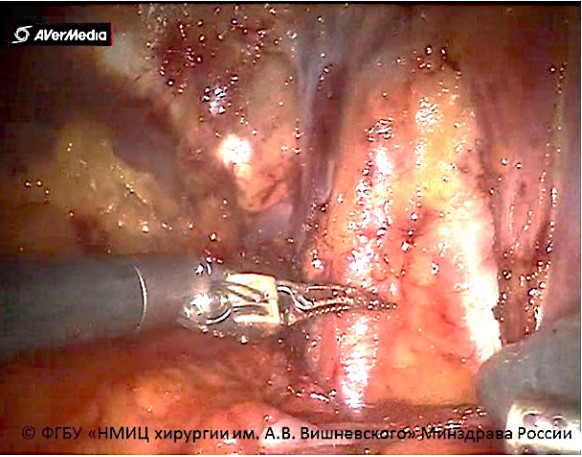 Рисунок 2. двухсторонняя подвздошнообтураторная лимфаденэктомия (© ФгБу «нМИц хирургии им. А.В. Вишневского»)
Рисунок 2. двухсторонняя подвздошнообтураторная лимфаденэктомия (© ФгБу «нМИц хирургии им. А.В. Вишневского»)
Следующий этап выполнения операции — мобилизация мочеточников. правый мочеточник выделяли в зоне перекрёста с подвздошными сосудами. левый мочеточник — в зоне перекрёста с подвздошными сосудами. В непосредственной близости от юкставезикального отдела на оба мочеточника накладывали по две клипсы, между которыми мочеточники пересекались. левый мочеточник проводился через сформированное окно в брыжейке сигмовидной кишки под нижней брыжеечной артерией в правую подвздошную область.
Далее непосредственно выполнялась мобилизация мочевого пузыря и предстательной железы. при помощи монополярной коагуляции вскрывали брюшину параллельно пупочным связкам, вход в предпузырное пространство осуществляли пересечением пупочной связки. Выполняли выделение мочевого пузыря и передней поверхности предстательной железы. тазовую фасцию вскрывали по бокам предстательной железы. Следующим шагом пересекали лобковопростатические связки с двух сторон. Важным этапом во избежание кровопотери являлась обработка сосудов дорзального венозного комплекса (сплетение Santorini) путём лигирования непрерывным обвивным викриловым швом 3/0. уретру пересекали острым путём. частично острым, частично тупым путём производили мобилизацию предстательной железы от передней стенки прямой кишки с последующим рассечением апоневроза Denonvilliers-Салищева и выделением семенных пузырьков. Семявыносящие протоки пересекали с использованием биполярной коагуляции. предстательную железу мобилизовали вместе с мочевым пузырём. дополнительно лигировали пузырные сосуды. Стоит отметить, что все клинические наблюдения проводились без нервосберегающей методики, максимально радикально. Единым блоком через продленный разрез установки камеры проводили удаление органокомплекса.
Уретерокутанеостомия. при формировании уКС производили стентирование мочеточников J-образными мочеточниковыми стентами. Формировали канал справа, проходящий через подкожную жировую клетчатку, брюшную стенку и брюшину. через образованный канал мочеточник выводили наружу без натяжения, подшивали 4 узловыми швами к коже. дистальный конец выступал над поверхностью кожи не менее чем на 2 см. Аналогичную процедуру выполняли слева.
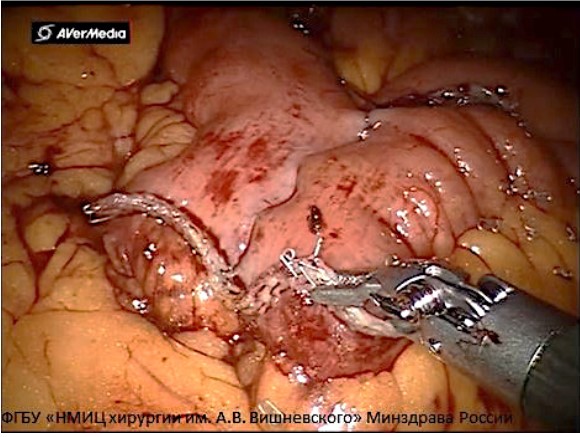 Рисунок 3. Формирование аппаратного антиперистальтического латеро-латерального анастомоза (© ФгБу «НМИц хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 3. Формирование аппаратного антиперистальтического латеро-латерального анастомоза (© ФгБу «НМИц хирургии им. А.В. Вишневского» Минздрава России)
Дистальные отрезки мочеточников спатулировали и сшивали между собой по Wallace 1. через разрез в правой околопупочной области производили вывод подвздошной кишки наружу с формированием уростомы. через ассистентский порт в брюшную полость вводили мочеточниковые J-стенты. Используя зажим Zenker (Шамли), стенты выводили наружу через уростому. Формировали непрерывным монокриловым швом 5\0 уретероилеоанастомоз (рис. 4 – 5).
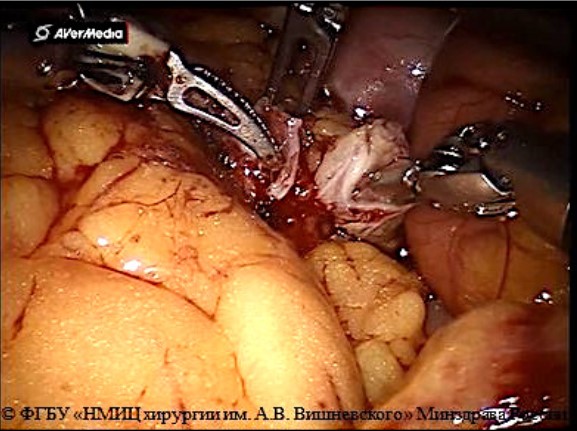 Рисунок 4. Формирование площадки из спатулированных мочеточников по Wallace 1 (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 4. Формирование площадки из спатулированных мочеточников по Wallace 1 (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
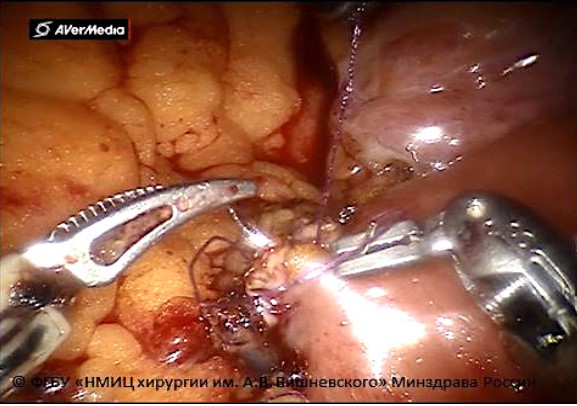
Рисунок 5. Формирование уретероилеоанастомоза непрерывным монокриловым швом 5/0 (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
В одном случае была выполнена конверсия в открытую операцию на этапе формирования энтеро-энтероанастомоза из-за непреодолимых анатомических и технических трудностей, из-за чего анастомоз и формирование илеум-кондуита были выполнены открытым способом.
Формирование необладера по методике Studer. При выполняли интракорпорального вмешательства выполнялось формирование артифициального мочевого пузыря из кишечного кондуита по методике Studer. Выделяли сегмент подвздошной кишки длиной 55 см (20 + 20 + 15) на расстоянии 25 см от илеоцекального перехода. Кишку пересекали с помощью линейного сшивающего аппарата. проходимость тонкой кишки восстанавливали аппаратным антиперистальтическим латеро-латеральным анастомозом (Endo GIA™ 45 мм (4) + 60 мм (1)). дистальные 40 см отрезка кишки детубуляризировали U-образно укладывали и сшивали непрерывным однорядным викриловым швом 3/0 (рис. 6).
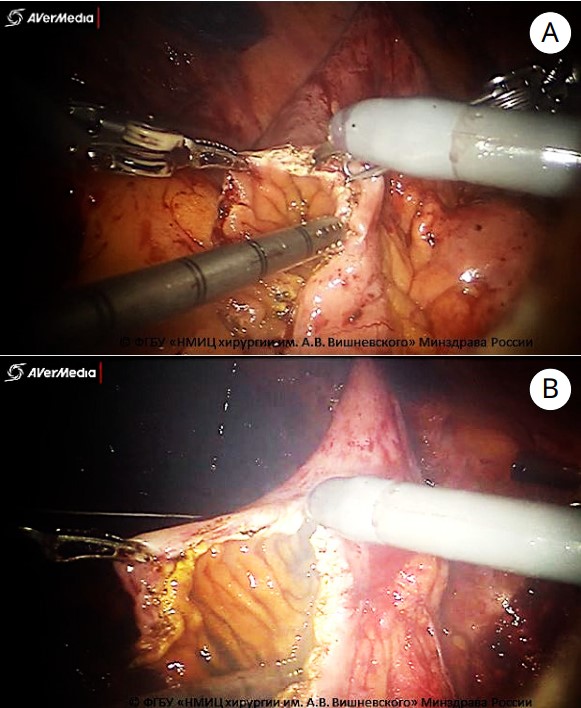 Рисунок 6. Этапы формирования необладера по методике Studer: A — детубуляризация изолированного проксимального сегмента подвздошной кишки; B — детубуляризация изолированного дистального сегмента подвздошной кишки (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 6. Этапы формирования необладера по методике Studer: A — детубуляризация изолированного проксимального сегмента подвздошной кишки; B — детубуляризация изолированного дистального сегмента подвздошной кишки (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
Заднюю стенку необладера складывали в поперечном направлении в соотношении 2/3 к 1/3. продольную часть передней стенки формировали непрерывным викриловым швом 3/0. В качестве технологического окна для манипуляций внутри необладера оставляли 1/3 передней стенки. дистальные части мочеточников отсекали от ранее наложенных клипс и отправляли на гистологическое исследование. Стентирование мочеточников выполняли при помощи наружных J-стентов (рис. 7).
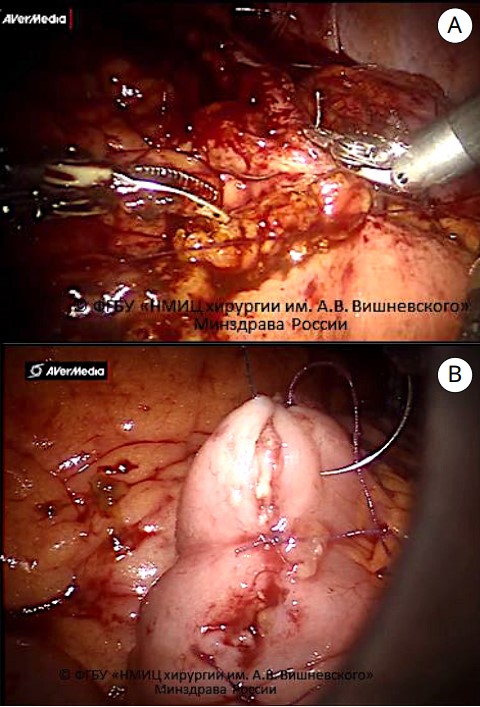 Рисунок 7. Этапы формирования необладера по методике Studer: А — формирование задней стенки необладера непрерывным викриловым швом 3/0; B — формирование передней стенки необладера непрерывным швом V-loc™ 3/0 (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 7. Этапы формирования необладера по методике Studer: А — формирование задней стенки необладера непрерывным викриловым швом 3/0; B — формирование передней стенки необладера непрерывным швом V-loc™ 3/0 (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
В недетубуляризированную проксимальную часть резервуара имплантировали оба мочеточника одиночными монокриловыми узловыми швами 5/0. В апикальной точке каудальной части необладера выполняли контрапертуру 2 – 3 мм (шейка необладера), через которую выводили оба мочеточниковых стента и далее через уретру наружу, и внутрь необладера вводили уретральный силиконовый катетер Foley 18 Ch (рис. 8А и 8B).
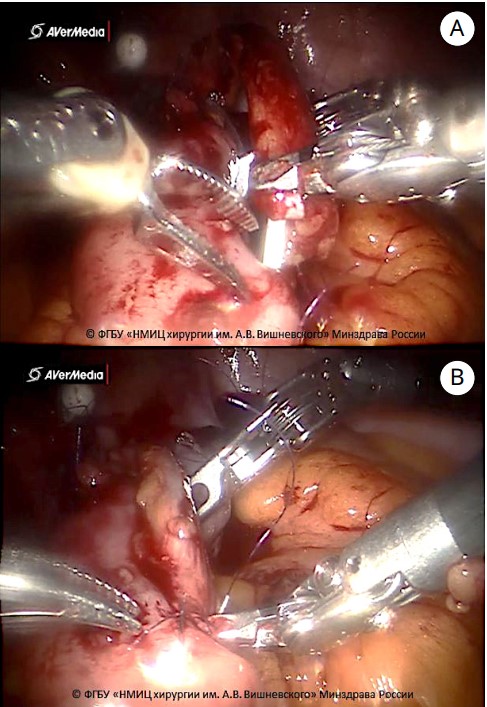 Рисунок 8. Имплантация мочеточников в необладер (А, В) (© ФГБУ «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 8. Имплантация мочеточников в необладер (А, В) (© ФГБУ «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Оставшуюся 1/3 неушитого необладера герметизировали непрерывным викриловым швом 3/0. накладывали анастомоз между уретрой и сформированной шейкой необладера монокриловой нитью 5/0. ортотопический резервуар низводили в малый таз. завязывали лигатуры (рисунок 9).
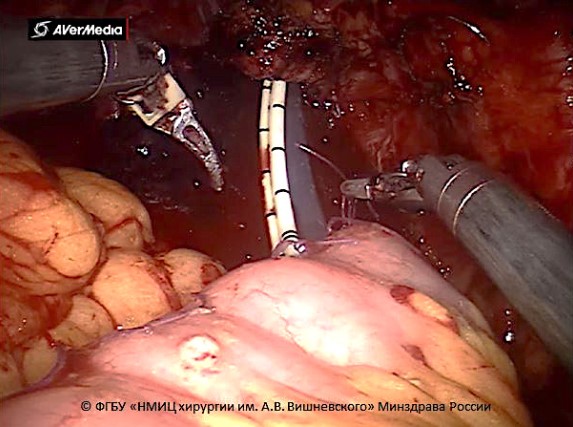 Рисунок 9. Низведение необладера в малый таз (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 9. Низведение необладера в малый таз (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
В одном случае из-за технических сложностей, связанных с невозможностью ретроградного стентирования мочеточника в связи со стриктурой нижней трети мочеточника, была выполнена конверсия, и реконструктивная часть операции была выполнена в открытой версии.
Результаты
Средняя продолжительность РАцЭ составила 381 минут. длительность проведения оперативного вмешательство зависела от методики отведения мочи. так, формирование артифициального мочевого пузыря по методике Studer было самым длительным по времени и в среднем составляло 558,0 + 142,2 минут, что почти в два раза больше, чем формирование уКС. наименьшая продолжительность операции зафиксирована при формировании уКС — 280 минут.
В среднем объём кровопотери при РАцЭ составил 195,5 мл. Максимальный объём кровопотери отмечен у пациентов с илеальным кондуитом, минимальный — при уКС. Интраоперационные характеристики представлены в таблице 3.
Таблица 3. Интраоперационные показатели пациентов, перенесших РАЦЭ
| Показатели Ratios |
Общая выборка General sample (n = 11) |
Группа Studer Studer group (n = 3) |
Группа Bricker Bricker group (n = 4) |
Группа УКС UCS group (n = 4) |
|---|---|---|---|---|
| М (min – max) | ||||
| Время операции, мин. Surgery duration, min |
381,8 (225,0 – 675,0) |
558 (400 – 675) |
351,2 (260,0 – 420,0) |
280 (225 – 355) |
| Кровопотеря, мл Blood loss, ml |
195,5 (100,0 – 300,0) |
200 (100 – 300) |
225 (200 – 250) |
162,5 (100,0 – 200,0) |
| Смерть на операционном столе, n Death during the surgery, n |
0 | 0 | 0 | 0 |
| Повторная операция, n Repeated surgery, n |
0 | 0 | 0 | 0 |
Примечание. УКС — уретерокутанеостомия
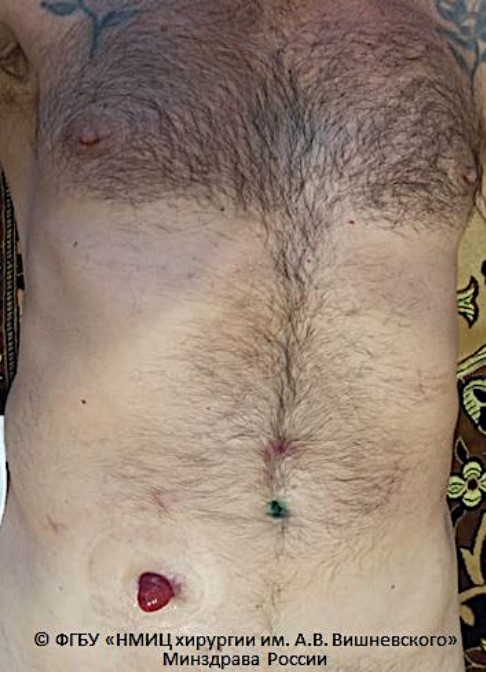 Рисунок 10. Вид передней брюшной стенки через 3 месяца после операции Брикера (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 10. Вид передней брюшной стенки через 3 месяца после операции Брикера (© ФгБу «нМИц хирургии им. А.В. Вишневского» Минздрава России)
Следует отметить, что в послеоперационном периоде отсутствовали случаи развития осложнений выше IIIA степени по Clavien-Dindo у пациентов РАцЭ. Среднее время пребывания пациентов в стационаре составило 24 ± 4 дней. В зависимости от метода хирургического лечения варьировалось время пребывания пациента в стационаре. так, после операции Studer среднее время пребывания пациента в стационаре составило 26,6 дней, после операции Bricker — 25 дней, после уретерокутанеостомии — 21 день. Вид передней брюшной стенки после роботассистированной операции Bricker через 3 месяца представлен на рисунке 10. 3-D Кт реконструкция мочевыводящих путей после робот-ассистированной операции Studer через 3 месяца представлена на рисунке 11.
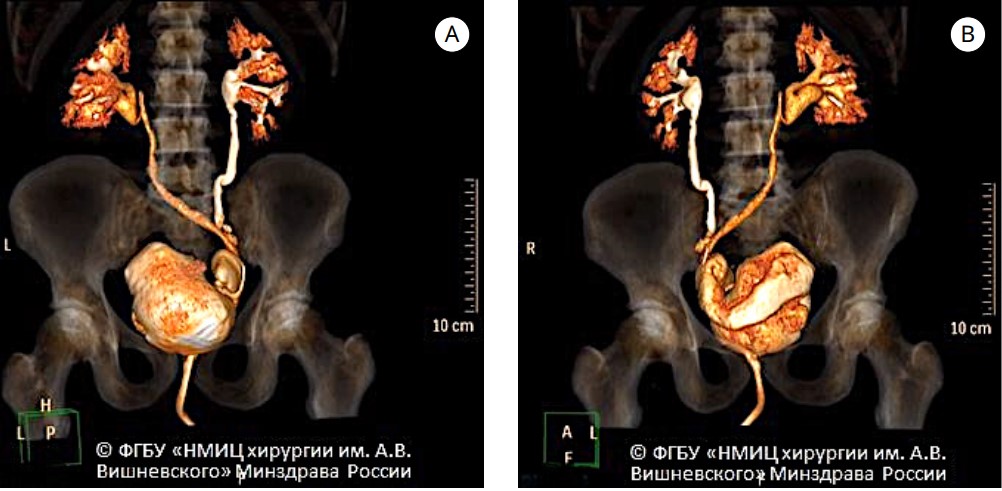 Рисунок 11. 3-D Кт реконструкция мочевыводящих путей после операции Штудера: А —прямая проекция; B — боковая проекция (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
Рисунок 11. 3-D Кт реконструкция мочевыводящих путей после операции Штудера: А —прямая проекция; B — боковая проекция (© ФгБу «НМИЦ хирургии им. А.В. Вишневского» Минздрава России)
Один пациент погиб от прогрессирования онкопроцесса через 1,5 года. Все пациенты ежегодно проходят Кт грудной клетки, брюшной полости и малого таза. Структура после операционных осложнений представлена в таблице 4.
Таблица 4. Структура осложнений в послеоперационном периоде
| Показатели Ratios |
Общая Выборка General sample (N = 11) |
Группа Studer Studer group (n = 3) |
Группа Bricker Bricker group (n = 4) |
Группа УКС UCS group (n = 4) |
|---|---|---|---|---|
| Послеоперационные осложнения, любые (по Clavien-Dindo) II-IIIA, n (%) Overall Clavien-Dindo II-IIIA complications, n (%) |
4 (36,4) | 2 (66,7) (консервативное лечение, conservative management) |
1 (25) (нефростомия, nephrostomy) |
1 (25) (рестентирование мочеточника, ureter restenting) |
| Пиелонефрит (обструктивный), n (%) Pyelonephritis (obstructive), n (%) |
2 (18,2) | 0 | 1 (25) (нефростомия, nephrostomy) |
1 (25) (рестентирование мочеточника, ureter restenting) |
| Пиелонефрит (необструктивный), п (%) Pyelonephritis (non-obstructive), n (%) |
1 (9) | 1 (33,3) (консервативное лечение, conservative management) |
0 | 0 |
| Clostridium difficile ассоциированная диарея, п (%) Clostridium difficile-associated diarrhea, n (%) |
1 (9) | 1 (33,3) (консервативное лечение, conservative management) |
0 | 0 |
Обсуждение
Развитие роботических технологий оказало значимое влияние на медикотехнологический ландшафт здравоохранения в целом и урологии в частности [7]. РАЦЭ в настоящее время рассматривается как перспективная альтернатива открытой РЦЭ ввиду своей минимальной инвазивности, низкой частоте периоперационных осложнений, благоприятных хирургических и онкологических исходов. Результаты, полученные в рамках настоящего исследования, в целом согласуются с ранее опубликованными данными непосредственных исходов больных МИРМп после РАЦЭ.
Частота осложнений в послеоперационный период составила 36,0%, что значимо ниже по сравнению с исходами пациентов после открытой РЦЭ. В исследовании M. Hirobe et al. частота осложнений по ≥ 3 степени тяжести в 90-дневный период после индексного вмешательства составила 22,2% из 80,5% в исследуемой когорте [8]. В исследовании C.U. lee et al. частота послеперационных осложнений после РАцЭ составила 61,9% [9]. при этом в структуре осложнений преобладали осложнения 2 степени тяжести (42,1%). Аналогичные цифры были получены B.H. Bochner et al. [10]. при этом частота развития послеоперационных осложнений 2 – 5 степени по классификации Clavien-Dindo составила 66% в группе РЦЭ против 62% в группе РАЦЭ.
Подобные высокие цифры в группе РАцЭ также имеют логическое объяснение. учитывая, что исследовательская группа под руководством В.н. Bochner проводила рандомизированное клиническое исследование одними из первых (период включения пациентов — 2010 – 2013 годы), высокая частота развития послеоперационных осложнений является ожидаемой при освоении центром новой медицинской технологии. Рабочей группой по роботической хирургии European Association of Urology сообщается, что выход на плато кривой обучения при проведении РАцЭ потребует проведения не менее 97 операций [11]. В свою очередь Международный консорциум роботической цистэктомии представил данные о сокращении частоты развития значимых осложнений по классификации Clavien-Dindo в 4 раза по мере внедрения РАцЭ в клиническую практику [12].
Основным преимуществом РАЦЭ, по данным многочисленных исследований, является минимальный объём кровопотери и низкая частота гемотрансфузий в периоперационном периоде [13, 14]. В целом, предварительные данные нашего исследования соответствуют общемировым результатам. Средний объём кровопотери при выполнении РАЦЭ составил 195,5 мл. при этом, по литературным данным, средний объём кровопотери при выполнении РЦЭ варьируется от 370,0 до 600,0 мл [4].
По данным нашего исследования, время выполнения РАЦЭ в среднем составляет 381,8 мин. и варьируется от выбранного метода деривации мочи. Следует отметить, что интракорпоральное формирование необладера является наиболее длительным по времени вмешательством (среднее время операции – 558,0 минут) по сравнению с другими методами. наши данные также соответствуют результатам ранее проведённых исследований [15].
Заключение
РАЦЭ на протяжении нескольких лет демонстрирует свою эффективность при лечении пациентов с МИРМп. Благодаря опыту выполнения данных операций в нашем центре можно убедиться, что РАЦЭ по сравнению с открытой ЦЭ, несмотря на высокую себестоимость и более длительное время интраоперационного этапа, имеет ряд более значимых преимуществ для пациента и онкологического прогноза, связанного с прецизионной работой, минимальным объёмом кровопотери, меньшим количеством послеоперационных осложнений и сроком пребывания пациента в стационаре.
Нужно отметить, что для получение значимых данных необходимо накопление большего опыта выполнения интракорпоральных операций с различными методами деривации мочи с помощью роботической системы Da Vinci. С ростом кривой обучения возможно усовершенствование техники операций, повышение её доступности в профильных центрах и улучшения качества роботической версии оперативного вмешательства в объёме РАЦЭ у данной категории больных.








