Результаты лапароскопических и робот-ассистированных антирефлюксных оперативных вмешательств при грыжах пищеводного отверстия диафрагмы и гастроэзофагеальной рефлюксной болезни
Лапароскопическая фундопликация является «золотым стандартом» в хирургическом лечении гастроэзофагеальной рефлюксной болезни (ГЭРБ) и грыж пищеводного отверстия диафрагмы (ГПОД). Робот-ассистированный вариант вмешательства является перспективным направлением развития стандартной лапароскопической методики.
Цель – сравнение результатов стандартного лапароскопического и робот-ассистированного подхода в лечении больных с ГПОД и рефлюкс-эзофагитом; оценка преимуществ роботизиро- ванной технологии с позиции эффективности лечения и удобства выполнения вмешательства со стороны хирургов.
Материал и методы. В период с октября 2016 г. по август 2022 г. на базе ГБУЗ «ГКБ им. С.И. Спасо- кукоцкого» прооперированы 512 больных с верифицированной ГЭРБ на фоне ГПОД. В группы исследования вошли пациенты, которым была выполнена робот-ассистированная лапароскопическая фундопликация (РАЛФН) на платформе DaVinci Si (Intuitive Surgical Inc., США) – основная группа (154 пациента, 30%) и лапароскопическая фундопликация (ЛФН) – группа контроля (358 пациентов, 70%). Всем пациентам выполнялась фундопликация по Ниссену с формированием свободной короткой манжеты (по типу short floppy Nissen). Группой авторов проведено сравнение интра- и послеоперационных результатов лечения, а также анкетирование специалистов с целью объективизации восприятия хирургами оперативных техник.
Результаты. Интраоперационные осложнения выявлены у 4 (2,6%) пациентов основной группы и 19 (5,3%) пациентов группы контроля. Медиана продолжительности операции составила 120 мин (70–150 мин) при выполнении РАЛФН и 90 мин (70–160 мин) при выполнении ЛФН, медиана интраоперационной кровопотери – 110 (50–300 мл) и 135 мл (80–600 мл) соответственно. Интраоперационных конверсий доступа и летальных исходов не было. Послеоперационные осложнения 3b степени по шкале Clavien–Dindo наблюдались у 1 пациента (0,6%) в основной группе и у 4 (1,1%) в группе контроля. Средние сроки стационарного лечения составили 3,8 сут в основной группе и 3,6 сут в контрольной группе, с медианой 3 сут в обеих группах. Все пациенты находились под диспансерным наблюдением в течение 1 года после хирургического вмешательства, оценка непосредственных результатов с положительной динамикой в обеих группах. Анализ качества жизни пациентов по GERD-Q демонстрировал средний балл 3,2 в обеих группах. Согласно опроснику GSRS, после операции пациенты не предъявляли жалоб на абдоминальную боль, диарею и обстипацию, что обеспечило средний балл по позициям равным 1,0. Результаты анкетирования оперирующих хирургов продемонстрировали наиболее высокую оценку робот-ассистированной техники, особенно по параметрам качества экспозиции и степени утомляемости во время операции. Медиана сроков наблюдения за пациентами основной группы составила 13 мес, за пациентами группы контроля – 19 мес. По данным на 2022 г., зафиксировано 6 рецидивов в основной группе и 17 рецидивов в группе контроля, обеспечив 4,5% общих рецидивов.
Заключение. Современные малоинвазивные технологии с использованием лапароскопического и робот-ассистированного подхода обеспечивают оптимальные результаты лечения больных ГПОД и ГЭРБ. Технические аспекты формирования фундопликационной манжеты должны быть стандартизированы независимо от вида доступа. Робот-ассистированная техника обеспечивает достоверные преимущества с позиции комфорта оператора.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) по распространенности занимает пер- вое место среди всех гастроэнтерологических заболеваний, на изжогу жалуются 18–46% населения развитых стран, в том числе России [1]. Среди пациентов с длительно текущей ГЭРБ воспалительные изменения в пищеводе (катаральный рефлюксэзофагит, эрозии и язвы пищевода) выявляются в 45–80% случаев, у 10–35% больных – тяжелый эзофагит [2].
Ввиду высокой частоты развития рецидива заболевания в ранние сроки после прекращения консервативной терапии, а также рефрактерности к антисекреторному лечению у ряда больных хирургические вмешательства являются востребованным методом лечения ГЭРБ и грыж пищеводного отверстия диафрагмы (ГПОД). Непосредственными показаниями к хирургическому лечению служат рефрактерное к антисекреторной терапии течение ГЭРБ, подтвержденное суточным внутрипросветнымpH-мониторингом[3,4], в первую очередь непереносимость ингибиторов протонной помпы (ИПП), а также низкий комплаенс пациентов[5,6]. Показаниямикоперативному лечению являются осложнения ГЭРБ (тяжелый эзофагит, пептическая стриктура пищевода, пищевод Барретта), а также, по мнению ряда авторов, внепищеводные проявления рефлюкса (хронический кашель, манифестация бронхиальной астмы, висцерокардиальный синдром) [7–9]. Возможна сочетанная коррекция ГЭРБ в случае выявления заболеваний верхних отделов желудочнокишечного тракта, требующих хирургического лечения [10]. Лапароскопическая фундопликация (ЛПФ) на протяжении многих лет является «золотым стандартом» в лечении ГПОД и ГЭРБ. В последние годы альтернативой этой методике все активнее выступает робот-ассистированная фундопликация с применением хирургического комплекса da Vinci. В настоящее время в мире накоплен небольшой опыт применения роботизированных хирургических комплексов в лечении этих пациентов, преимущества указанных методик неоднозначны и активно обсуждаются, что сделало актуальным настоящее исследование.
Материал и методы
В исследовании проведена ретроспективная оценка непосредственных и отдаленных результатов лечения 512 пациентов, оперированных с использованием малоинвазивных антирефлюксных технологий в период с октября 2016 по август 2022 г. на базе ГБУЗ ГКБ им. С.И. Спасокукоцкого ДЗМ. Диагноз был установлен на основании данных анамнеза, жалоб, данных лабораторных и инструментальных исследований. В исследование включены пациенты с верифицированной ГЭРБ на фоне ГПОД, не поддающейся консервативной медикаментозной терапии в течение длительного времени, при наличии показаний к плановому хирургическому вмешательству. Дополнительными критериями включения пациентов в исследование являлись высокая комплаентность пациента и наличие письменного информированного согласия на участие в исследовании. В исследование были включены пациенты с основным диагнозом скользящей ГПОД, т.е. грыжей 1-го типа по классификации SAGES (Society of American Gastrointestinal and Endoscopic Surgeons, 2013) [11]. Таким образом, в группы исследования вошли пациенты, которым была выполнена робот-ассистированная лапароскопическая фундопликация (РАЛФН) на платформе DaVinci Si (Intuitive Surgical Inc., США) – основная группа [154 (30,0%) пациента] и ЛФН – группа контроля [358 (70,0%) па- циентов] по поводу скользящей аксиальной ГПОД. Всем пациентам выполнялась фундопликация по Ниссену с формированием свободной короткой манжеты (по типу short floppy Nissen).
Характеристика групп исследования. Основные характеристики групп исследования подробно представлены в табл. 1. В обеих группах преобладали пациенты женского пола (в соотношении 1,5:1), в подавляющем большинстве трудоспособного возраста. Достоверных различий между группами по основным параметрам, таким как средний возраст, индекс массы тела (ИМТ), тяжесть сопутствующих заболеваний по шкале ASA, получено не было (p>0,05).
Таблица 1. Основные характеристики групп исследования
| Показатель | Основная группа (n=154) |
Группа контроля (n=358) |
| Возраст (M±SD), годы | 45,7±7,1 | 44,1±5,9 |
| Пол - мужской, n (%) - женский, n (%) |
63 (41,0%) 91 (59,0%) |
136 (38,0%) 222 (62,0%) |
| Индекс массы тела (M±SD), кг/м2 | 26,1±3,3 | 27,3±4,8 |
| Статус по ASA - 1, n (%) - 2, n (%) |
73 (47,4%) 81 (52,6%) |
143 (40,0%) 215 (60,0%) |
В клинической картине у пациентов обеих групп преобладали симптомы диспепсии, возникающие после употребления пищи, при наклоне и в ночное время. Боли различной интенсивности и локализации отмечали более 80% больных, симптомы дисфагии – более 10% (в том числе постоянного характера), более 40% больных предъявляли жалобы на потерю массы тела и появление ощущения слабости. Статистически достоверных различий по частоте встречаемости различных клинических проявлений в исследуемых группах не выявлено (p>0,05).
При анализе интеркуррентной патологии полиморбидное состояние было отмечено у 306 (59,8%) больных общей группы. Чаще всего в обеих группах регистрировались заболевания сердечно-сосудистой и дыхательной систем [хроническая обструктивная болезнь легких (ХОБЛ), хронический бронхит, бронхиальная астма]. По данным анамнеза, четверть больных в обеих группах лечились консервативно, без положительной динамики, в сроки от 3 до 10 лет и более, при этом у части пациентов в указанные сроки сформировались осложнения ГЭРБ и рефлюкс-эзофагита, включая развитие метаплазии нижней трети пищевода (пищевода Барретта) у 10 (6,5%) пациентов основной группы и 30 (8,4%) пациентов контрольной группы (p>0,05). Больные исследуемых групп с целью объективизации диагноза были обследованы по единому протоколу предоперационного диагностического обследования, направленного на уточнение вида ГПОД, характеристики ГЭРБ и рефлюкс-эзофагита, а также наличия и степени тяжести осложнений [рентгенографическое исследование пищевода и желудка с пероральным контрастированием, диагностическая эзогастродуоденоскопия (ЭГДС), 24-часовой рН-мониторинг, при необходимости – компьютерная томография органов брюшной полости и грудной клетки]. На основании результатов обследования показаниями к выполнению антирефлюксных вмешательств в группах исследования явились аксиальные и гигантские субтотальные ГПОД, а также выраженные воспалительные изменения пищевода (эрозивный, эрозивно-фибринозный и эрозивно-геморрагический эзофагит) как следствие рефлюксэзофагита.
Хирургическая техника. Хирургическое вмешательство, направленное на формирование свободной короткой манжеты (по типу short floppy Nissen) выполнялось в обеих группах по единой схеме. Схема расположения троакаров при лапароскопической операции представлена на рис. 1, для робот-ассистированной операции – на рис. 2. Малый сальник мобилизовали до ПОД с дальнейшим выделением ножек ПОД и абдоминального отдела пищевода (рис. 3). Грыжевой мешок отсекали по контуру ножек ПОД с одновременным выделением его из средостения вместе с жировой тканью. При диссекции передней стенки пищевода в средостении важным этапом считали визуализацию блуждающих нервов.
Далее пересекали диафрагмально-фундальную связку до верхнего полюса селезенки. Заднюю крурорафию Z-образными швами выполняли на тонком назогастральном зонде (при необходимости дополняли передней крурорафией), ушивая ПОД до диаметра пищевода и фиксируя его к правой и левой ножкам диафрагмы (рис. 4). Формировали свободную короткую фундопликационную манжету по типу short floppy Nissen протяженностью не более 20 мм (рис. 5). При формировании манжеты ее фиксировали к пищеводу во избежание ее соскальзывания в по- слеоперационном периоде (рис. 6). При необходимости дренаж в поддиафрагмальное пространство устанавливается через троакар в левом подреберье, дренаж в средостение – через эпигастральный доступ. В конце операции назогастральный зонд удаляли. В послеоперационном периоде прием жидкости per os начинали с 1-х суток после операции, полноценное питание возобновлялось на 2-е сутки после операции.
Критерии оценки. Для реализации целей и задач исследования была проведена оценка непосредственных и отдаленных результатов лечения больных. Оценивались частота и характер интраоперационных осложнений, летальных исходов и конверсий доступа, продолжительность оперативного вмешательства, интраоперационная кровопотеря (количество жидкости в аспираторе с учетом использованного раствора). Для оценки течения раннего послеоперационного периода изучали частоту развития и характер ранних после- операционных осложнений по унифицированной шкале Clavien–Dindo [12], частоту развития и степень тяжести послеоперационной дисфагии по градации G. Wetscher, сроки госпитализации. Отдаленные результаты оперативного лечения оценивали через 1, 3, 6 и 12 мес после операции. В качестве критериев оценки были использованы клинические параметры, данные инструментального обследования, показатели качества жизни. Контроль течения послеоперационного периода осуществлялся посредством проведения рН-метрии, ЭГДС, рентгенологического исследования пищевода и желудка, а также анкетирования с использованием специальных опросников.
Для объективизации периоперационного статуса был использован опросник GSRS (Gastroin- testinal Symptom Rating Scale) в русскоязычной версии. С целью более детальной оценки проявлений рефлюкса в послеоперационном периоде был использован опросник GERD-Q (GastroEsophageal Reflux Disease) в русскоязычной версии. Послеоперационное инструментальное исследование включало в себя выполнение диагностической ЭГДС (через 2, 6 и 12 мес) с оценкой состояния слизистой оболочки пищевода по классификации Savary–Miller (1978), рентгенологического исследования пищевода и желудка с пероральным контрастированием (через 3, 6 и 12 мес), а также 24-часового рН-мониторинга (в сроки от 6 до 12 мес). В качестве второго направления исследования с целью объективизации восприятия хирургами различных оперативных техник при выполнении антирефлюксных хирургических вмешательств было проведено их анкетирование с использованием специального теста с выставлением балльной оценки.
Статистический анализ. Полученные данные обработаны методами вариационной статистики с использованием пакета статистических программ Microsoft Office Excel 2007 (Microsoft Corporation, США) и прикладных программ Statistica 13.2 (Dell inc., США). При сравнении групп по анализируемым параметрам проверялась нулевая статистическая гипотеза об отсутствии различий между ними. Пороговый уровень статистической значимости при сравнении результатов равнялся 0,05 (при р<0,05 результат является статистически достоверным). При статистической обработке результаты лечения пациентов оценивали по количественным и качественным признакам (где количественные переменные – средние величины c расчетом стандартных отклонений или минимумов и максимумов; качественные переменные – абсолютные и относительные частоты в %). Для сравнения категориальных данных был использован точный критерий Фишера, непрерывные переменные сравнивались с помощью критерия Стьюдента.
Результаты
Всем пациентам была выполнена фундопликация по Ниссену: робот-ассистированная – 154 (30,0%) пациентам, лапароскопическая – 358 (70,0%) пациентам. Медиана кровопотери при робот-ассистированном вмешательстве была меньше, чем при выполнении стандартной лапароскопической операции (110 против 135 мл соответственно). Средняя продолжительность лапароскопических операций составила 90 мин (70–160 мин), робот-ассистированных – 120 мин (70–150 мин), при этом этап докинга и настройки консоли робота da Vinci занимал в среднем 10 мин.
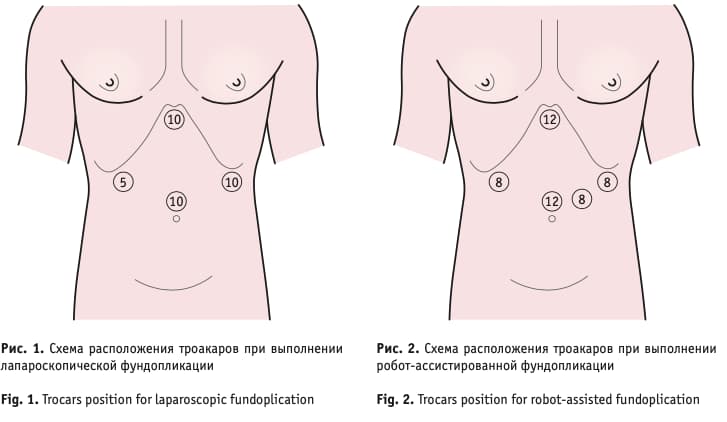
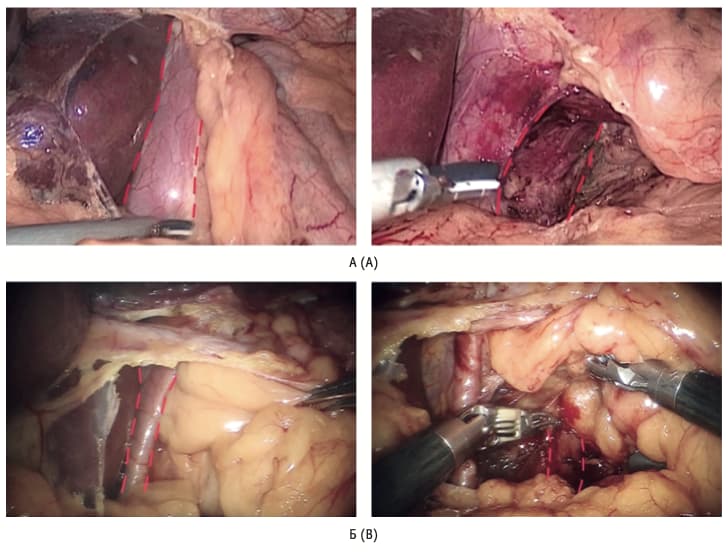 Рис. 3. Выделение основания правой и левой ножек пищеводного отверстия диафрагмы: А – при лапароскопической фундопликации; Б – при робот- ассистированной фундопликации Fig. 3. Exposure of the right and left crus of the diaphragm: A – for laparoscopic fundoplication; B – for robot-assisted fundoplication
Рис. 3. Выделение основания правой и левой ножек пищеводного отверстия диафрагмы: А – при лапароскопической фундопликации; Б – при робот- ассистированной фундопликации Fig. 3. Exposure of the right and left crus of the diaphragm: A – for laparoscopic fundoplication; B – for robot-assisted fundoplication
Интраоперационные осложнения выявлены у 4 (2,6%) пациентов основной группы и у 19 (5,3%) пациентов группы контроля. Среди интраоперационных осложнений отмечались ранение селезенки (гемостаз достигнут с помощью коагуляции и механического гемостаза), десерозирование стенки желудка (ушито интраоперационно), ранение печени (выполнена установка гемостатической губки в месте повреждения, интраоперационно достигнут полный гемостаз), ранение плевральной полости при работе с гигантскими грыжами ПОД (дефект плевры ушит интраоперационно, установлен дренаж плевральной полости). Таким образом, все осложнения были устранены интраоперационно, что не повлияло на дальнейшую оперативную тактику. Конверсий доступа в обеих изучаемых группах не было. Подробное описание интраоперационных параметров отображено в табл. 2.
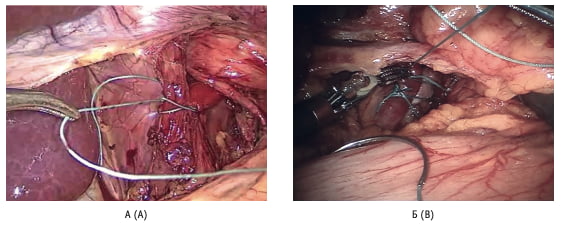 Рис. 4. Задняя крурорафия Z-образными швами: А – при лапароскопической фундопликации; Б – при робот-ассистированной фундопликации Fig. 4. Posterior crurorrhaphy with Z-shaped sutures: А – for laparoscopic fundoplication; B – for robot-assisted fundoplication.
Рис. 4. Задняя крурорафия Z-образными швами: А – при лапароскопической фундопликации; Б – при робот-ассистированной фундопликации Fig. 4. Posterior crurorrhaphy with Z-shaped sutures: А – for laparoscopic fundoplication; B – for robot-assisted fundoplication.
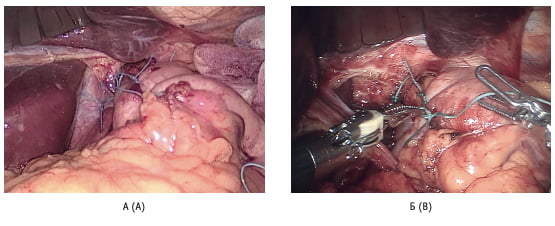 Рис. 5. Вид фундопликационной манжеты: А – после выполнения лапароскопической фундопликации; Б – после выполнения робот-ассистированной фундопликации Fig. 5. View of the fundoplication wrap: А – after laparoscopic fundoplication; В – wrap after robot- assisted fundoplication
Рис. 5. Вид фундопликационной манжеты: А – после выполнения лапароскопической фундопликации; Б – после выполнения робот-ассистированной фундопликации Fig. 5. View of the fundoplication wrap: А – after laparoscopic fundoplication; В – wrap after robot- assisted fundoplication
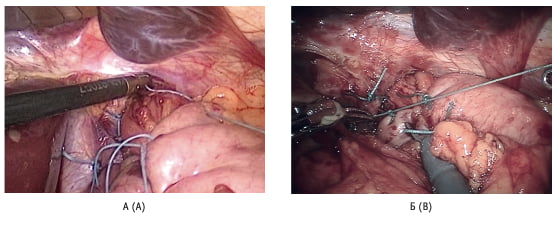 Рис. 6. Фиксация манжеты к пищеводу отдельными узловыми швами: А – при лапароскопической фундопликации; Б – при робот- ассистированной фундопликации Fig. 6. Fixation of the wrap to the esophagus with separate interrupted sutures: А – for laparoscopic fundoplication; B – for robot-assisted fundoplication
Рис. 6. Фиксация манжеты к пищеводу отдельными узловыми швами: А – при лапароскопической фундопликации; Б – при робот- ассистированной фундопликации Fig. 6. Fixation of the wrap to the esophagus with separate interrupted sutures: А – for laparoscopic fundoplication; B – for robot-assisted fundoplication
Послеоперационные осложнения 3b степени по шкале Clavien–Dindo наблюдались у 1 (0,6%) пациента в основной группе (кровотечение из коротких желудочных артерий) и у 4 (1,1%) пациентов в группе контроля (кровотечение из троакарной раны в 2 случаях, острая стресс-язва желудка, формирование пищеводного свища), обеспечив общее число послеоперационных осложнений 0,97%, при этом различия были статистически недостоверны (p>0,05). Выявленные осложнения потребовали релапароскопии и были купированы. Осложнения IV степени и летальные исходы, связанные с оперативным вмешательством, отсутствовали. Средние сроки стационарного лечения составили 3,8 сут в 1-й группе и 3,6 сут во 2-й группе, с медианой 3 сут в обеих группах; полученные различия не были статистически достоверны. Дальнейшее наблюдение за больными и снятие швов с кожной раны проводились в амбулаторных условиях, во всех случаях отмечено заживление первичным натяжением.
Таблица 2. Интраоперационные параметры
| Критерий оценки | Основная группа (n=154) | Группа контроля (n=358) |
р |
|---|---|---|---|
| Переменные |
Переменные | Переменные |
Переменные |
| Кровопотеря, мл: медиана (диапазон) |
110 (50–300) | 135 (80–600) |
0,084 |
| Продолжительность операции, мин: медиана (диапазон) |
120 (70–150) | 90 (70–160) | 0,033 |
| Интраоперационные осложнения |
Интраоперационные осложнения |
Интраоперационные осложнения |
Интраоперационные осложнения |
| Ранение селезенки, абс. (%) |
1 (0,6) | 5 (1,4) | 0,216 |
| Ранение печени, абс. (%) | 2 (1,2) | 9 (2,5) | 0,081 |
| Повреждение медиастинальной плевры, абс. (%) |
1 (0,6) | 3 (0,8) | 0,523 |
| Десерозирование стенки желудка, абс. (%) |
0 (0,0) |
2 (0,5) | 0,321 |
Оценка непосредственных результатов хирургического вмешательства была проведена на основании выраженности и частоты послеоперационной дисфагии по градации G. Wetscher. Дисфагии тяжелой степени в основной и контрольной группах в раннем послеоперационном периоде не отмечалось. Все пациенты находились под диспансерным наблюдением в течение 1 года после хирургического вмешательства. Оценка эффективности оперативного лечения с использованием 24-часовой рН-метрии продемонстрировала положительную динамику в отдаленные сроки у пациентов обеих групп, показатели были в пределах нормы. Статистических различий между группами не выявлено, кроме параметра самого продолжительного рефлюкса. Результаты послеоперационной диагностической ЭГДС с оценкой наличия и степени тяжести рефлюкс-эзофагита по классификации Savary– Miller продемонстрировали отсутствие пациентов с эзофагитом III–IV степени в обеих группах; помимо этого, была отмечена тенденция к уменьшению числа больных эзофагитом I и II степени со временем, а также к увеличению числа пациентов без эндоскопических признаков воспаления слизистой пищевода. Более подробно отдаленные результаты хирургического лечения ГПОД спустя 6 мес после оперативного вмешательства отображены в табл. 3 (контрольная ЭГДС была выполнена у 142 пациента в обеих группах). На основании данных рентгенологического исследования на момент контрольного осмотра в указанные выше сроки не было выявлено признаков рецидива ГПОД, рефлюкса или нарушения проходимости пищеводно-желудочного перехода.
Медиана сроков наблюдения за пациентами основной группы составила 13 мес (1–41 мес), за пациентами группы контроля – 19 мес (1–53 мес). По данным за 2022 г., зафиксировано 6 клинических рецидивов в основной группе и 17 клинических рецидивов в группе контроля, обеспечив 4,5% клинических рецидивов. Всем пациентам было выполнена рефундопликация. Анализ качества жизни пациентов по GERD-Q выявил отсутствие статистически значимых различий в основной и контрольной группах, демонстрируя средний балл 3,2. Таким образом, выбор малоинвазивного хирургического метода, использованного в лечении больных ГПОД, достоверно не повлиял на выраженность симптомов рефлюкса в отдаленном послеоперационном периоде. Согласно опроснику GSRS, в отдаленном послеоперационном периоде пациенты обеих групп не предъявляли жалоб на абдоминальную боль, диарею и обстипацию, что обеспечило средний балл по позициям 1,0. Анализ динамики рефлюкс-синдрома продемонстрировал более быстрое исчезновение жалоб у пациентов основной группы в сравнении с группой контроля, хотя различия были недостоверны. Выраженность диспептического синдрома (урчание в животе, чувство переполнения, от- рыжка воздухом и метеоризм) была зафиксирована чаще среди пациентов группы контроля через 1 мес после операции (2,4±0,5 против 2,1±0,2 в основной группе). Эти симптомы легко контролировались поддерживающей терапией, и, как следствие, через 3, 6 и 12 мес после операции подобных жалоб пациенты не предъявляли ни в одной из групп.
Таблица 3. Отдаленные результаты хирургического лечения грыж пищеводного отверстия диафрагмы через 6 мес после оперативного вмешательства
| Показатель | Основная группа (n=154) | Группа контроля (n=358) |
р |
|---|---|---|---|
| Показатели pH при 24-часовом мониторинге | Показатели pH при 24-часовом мониторинге | Показатели pH при 24-часовом мониторинге | Показатели pH при 24-часовом мониторинге |
| Время при рН<4, общее, % (N<4,5) |
3,9±0,2 | 3,7±0,4 | 0,471 |
| Общее число рефлюксов (N<46,9) |
41±0,3 | 39±0,4 | 0,175 |
| Число рефлюксов длительностью >5 мин (N<3,5) | 1,4±0,3 | 1,6±0,3 | 0,098 |
| Самый длительный рефлюкс, мин (N<20) | 10,2±0,4 | 13,5±1,2 | 0,296 |
| Тяжесть эзофагита по данным ЭГДС (Savary–Miller classification, 1978) |
Тяжесть эзофагита по данным ЭГДС (Savary–Miller classification, 1978) |
Тяжесть эзофагита по данным ЭГДС (Savary–Miller classification, 1978) |
Тяжесть эзофагита по данным ЭГДС (Savary–Miller classification, 1978) |
| Эзофагит степени 0, абс. (%) | 110 (71,4) | 0 (0,0) | 0,112 |
| Эзофагит степени I, абс. (%) | 3 (1,9) | 29 (8,1) | 0,248 |
| Эзофагит степени II, абс. (%) |
0 (0,0) | 0 (0,0) | 0,153 |
Таблица 4. Результаты анкетирования оперирующих хирургов
| Показатель | Основная группа (n=154) | Группа контроля (n=358) |
р |
|---|---|---|---|
| Качество визуализации | 9,3±0,4 | 8,6±0,2 | 0,579 |
| Разнообразие высокоэнергетического оборудования (качество диссекции/коагуляции/резания) |
8,4±0,2 | 8,6±0,3 | 0,428 |
| Качество экспозиции в узких анатомических пространствах | 9,1±0,3 | 7,9±0,4 | 0,047 |
| Эргономика оперативного пространства | 8,7±0,1 | 8,6±0,3 | 0,127 |
| Степень утомляемости хирурга (общее состояние хирурга после операции) | 9,7±0,1 | 8,6±0,5 | 0,010 |
Результаты анкетирования оперирующих хирургов (табл. 4) продемонстрировали наиболее высокую оценку робот-ассистированной методики по характеристикам технических аспектов вмешательства, а также эргометрии рабочего места, особенно по параметрам качества экспозиции и степени утомляемости во время операции. Особое внимание специалисты уделяли преимуществам работы на платформе Da Vinci в случае клинических ситуаций высокой сложности (работа в узких анатомических пространствах, диссекция вблизи аберрантных со- судов в случаях вариабельного кровоснабжения в зоне кардиоэзофагеального перехода), что было также учтено при анализе результатов анкетирования. Несмотря на то что данные показатели не являются статистически достоверными в связи с небольшим количеством операций, выявленная тенденция позволяет с уверенностью говорить об эффективности использования роботизированной хирургической системы в лечении больных ГПОД.
Обсуждение
Современные подходы к выполнению малоин- вазивных антирефлюксных операций основаны на базовых принципах, разработанных и получивших широкое распространение в первой половине XX в. Сообщение о первой ЛПФ датируется 1991 г. [13]. В дальнейшем основной тенденцией в хирургии кардиоэзофагеального перехода стало применение эндовидеохирургических технологий, что ожидаемо привело к прогрессивному увеличению числа антирефлюксных операций во всем мире. В дальнейшем активное развитие малоинвазивных антирефлюксных технологий было продолжено интеграцией в хирургическую практику роботизированного комплекса Da Vinci. Уже к 2001 г. было опубликовано более 49 исследований, посвященных сравнительному анализу стандартного лапароскопического и робот-ассистированного подхода к выполнению антирефлюксных вмешательств у пациентов с ГЭРБ и ГПОД, в том числе 10 обзоров литературы, 4 метаанализа, 5 рандомизированных клинических исследований, 17 когортных исследований. В то же время большинство этих работ отличает небольшое число наблюдений, в том числе пациентов с гигантскими и осложненными ГПОД, а также ограничение периода послеоперационного наблюдения несколькими годами.
О технических преимуществах, безопасности и эффективности робот-ассистированных антирефлюксных операций впервые заявили W.S. Melvin и соавт. в 2002 г., предоставив статистически сравнимые результаты лечения 40 пациентов с рефлюкс-эзофагитом, оперированных с использованием стандартного лапароскопического и роботизированного подхода [14]. Авторы отмечали достоверную разницу в длительности операции, связывая данный факт с этапом освоения методики и прохождения хирургами кривой обучения. Сходное рандомизированное клиническое исследование M. Morino и соавт. в 2006 г. выявило отсутствие конверсий доступа и летальности, сопоставимую продолжительность послеоперационного пребывания в стационаре, однако в группе робот-ассистированного вмешательства были отмечены более длительное время операции и значительно более высокие финансовые затраты [15]. В том же году W.A. Draaisma и соавт. продемонстрировали аналогичные результаты, в связи с чем применение роботических технологий в лечении ГПОД и ГЭРБ было признано нецелесообразным для осуществления рутинных вмешательств ввиду высоких финансовых затрат и увеличенной длительности операций, однако авторы не отрицали перспективу переоценки эффективности метода в будущем [16].
Одним из наиболее ценных исследований является работа C.A. Galvani и соавт., представляющая собой ретроспективную оценку безопасности роботизированной хирургии при лечении ГПОД. Ис- следование проводилось с 2010 по 2015 г. и включало 61 наблюдение [17]. Отмечено отсутствие летальных исходов и конверсий доступа, при этом в отдаленном периоде у 42% диагностирован анатомический рецидив ГПОД, у 23% – рецидив симптомов гастроэзофагеального рефлюкса. Идентичные результаты получены Z. Wang и соавт. в 2012 г., где авторы отмечали статистическое подтверждение сопоставимости робот-ассистированного и лапароскопического подходов по клиническим параметрам. На основании полученных результатов авторы сделали вывод о целесообразности рутин- ного применения лапароскопической методики ввиду меньших финансовых затрат [18].
В пользу робот-ассистированной методики при выполнении рефундопликации при рецидиве ГПОД и ГЭРБ в 2016 г. выступили R.C. Tolboom и соавт. [19]. Авторы пришли к выводу, что робот-ассистированный метод технически более удобен при работе в условиях массивного спаечного процесса. Концепция авторов была подтверждена в 2018 г. A.C. Mertens и соавт., которые продемонстрировали 7-летний опыт 221 робот-ассистированной фундопликации, заключив, что данная методика является целесообразной при технически сложных больших, гигантских и рецидивных ГПОД, при сопоставимом риске послеоперационных осложнений [20]. Настоящее исследование продемонстрировало клинически схожие результаты лечения пациентов с ГЭРБ и ГПОД, показав, что выбор малоинвазивной методики не влияет на качество жизни пациентов в отдаленном послеоперационном периоде. При этом данные анкетирования выявили тенденцию к более высоким темпам улучшения этих параметров после робот-ассистированной операции, повидимому, за счет улучшенной техники интракорпорального шва при формировании антирефлюксной манжеты, прецизионной диссекции тканей (грыжевого мешка, рубцовых сращений) в узком анатомическом пространстве заднего средостения с минимизацией риска повреждения медиастинальной плевры, перикарда и блуждающих нервов.
Актуален вопрос об эргометрическом преимуществе робот-ассистированной методики, в то время как недостатки в этом ключе стандартной лапароскопической методики обсуждались многократно. Одно из наиболее значимых обсервационных исследований, направленных на оценку комфорта хирурга-оператора при проведении традиционных лапароскопических абдоминальных вмешательств, было проведено целевой группой по решению эргометрических вопросов SAGES в 1999 г. Были проанализированы электромиограммы 149 оперирующих хирургов при выполнении симулированных хирургических манипуляций на эргометрической станции [21]. В 8–12% случаев хирурги предъявляли жалобы на боли и онемение в руках, запястьях или плечах. В 2018 г. T. Catanzarite и соавт. опубликовали систематический обзор, где сообщали что хирурги, практикующие традиционные лапароскопические вмешательства, подвержены развитию заболеваний опорно-двигательного аппарата в 73–100% случаев, в то время как выполняющие роботизированные операции – в 23–80% [22]. В пользу улучшенной эргометрии при выполнении робот-ассистированных операций выступили I. Wee и соавт., опубликовав в 2020 г. исследование, включающее анализ 29 статей и 3074 участников [23]. Результаты исследования показали, что робототехника обеспечивает достоверные эргономические преимущества и снижает позиционную нагрузку на хирургов по сравнению с традиционной лапароскопической техникой, хотя уровень физического напряжения при выполнении робот-ассистированных операций остается значительным. Наше исследование продемонстрировало достоверные преимущества роботизированной хирургической системы по техническим и эргономическим параметрам, что особо актуально при работе со сложными (в том числе гигантскими) ГПОД, предъявляющими особые требования к качеству интраоперационной визуализации и манев- ренности. Это связано с тем, что робот-ассистированная техника обеспечивает лучшее качество экспозиции и меньшую степень утомляемости, что повышает комфорт оператора и, как следствие, безопасность и эффективность оперативного вмешательства. Таким образом, ретроспективный анализ проведенных наблюдений позволяет сделать выводы о безопасности робот-ассистированных операций и целесообразности их выполнения преимущественно у больных с кардиофундальными, субтотальными и тотальными ГПОД, в то время как использование роботизированных комплексов в хирургическом лечении пациентов с рефлюксэзофагитом и/или кардиальной ГПОД остается спорным вопросом в связи с отсутствием доказанных преимуществ перед аналогичными лапароскопическими операциями. Ввиду этого наиболее актуальным направлением развития малоинвазивной антирефлюксной хирургии представляется разработка единого алгоритма хирургического лечения пациентов данной группы с учетом показаний к выбору того или иного оперативного доступа.
Заключение
Главным вопросом в тактике ведения пациентов с ГЭРБ и ГПОД по-прежнему остается стандартизация подхода к хирургическому лечению пациентов с рефрактерным течением заболевания. Пациенты с верифицированным диагнозом ГПОД при наличии сопутствующей симптоматики должны рассматриваться в качестве целевой группы для выполнения оперативного вмешательства. Современные малоинвазивные технологии с использованием лапароскопического и робот-ассистированного подходов обеспечивают оптимальные результаты лечения больных ГПОД и ГЭРБ.