Ретциус-сберегающая робот-ассистированная радикальная простатэктомия: первый опыт и техника выполнения
Введение
Рассечение париетальной брюшины в проекции верхушки мочевого пузыря и диссекция ретциева пространства является наиболее распространенным доступом к предстательной железе при выполнении трансперитонеальной робот-ассистированной радикальной простатэктомии (РАРП) 1–3. Существует боковой доступ, впервые описанный R. Gaston в 2007 г. При данном доступе ретциево пространство вскрывается ограниченно по правому флангу мочевого пузыря и через сформированный таким образом латеральный канал выполняются дальнейшие этапы операции 4. В 2012 г. A. Galfano et al. впервые представили результаты ретциус-сберегающей (задней) робот-ассистированной радикальной простатэктомии (РС-РАРП), в ходе которой доступ к предстательной железе осуществлялся через разрез на брюшине в проекции шейки мочевого пузыря из пузырно-прямокишечного (дугласова) пространства 5. Основным трендом в хирургии рака простаты остается совершенствование техники выполнения операции с целью улучшения функциональных результатов лечения. Ввиду своей анатомичности РС-РАРП может быть рассмотрена как один из перспективных способов достижения этой цели.
Пациенты и методы
В октябре–ноябре 2019 г. на базе урологического отделения и Центра роботической хирургии СПбГБУЗ «Городская Мариинская больница» пяти пациентам, страдающим раком предстательной железы клинической стадии T1c-T2bN0M0, была выполнена ретциус-сберегающая радикальная простатэктомия на роботизированном хирургическом комплексе «DaVinci Si». Возраст пациентов составил от 61 до 65 лет. Объем предстательной железы колебался от 31 до 65 см3, уровень общего простатического специфического антигена — от 7,5 до 10,9 нг/мл, сумма баллов по шкале Глисона — от 6 (3 + 3) до 7 (4 + 3). Клиническая стадия заболевания была определена на основании данных мультипараметрической МРТ, остеосцинтиграфии или позитронно-эмиссионной (ПЭТ) и компьютерной (КТ) томографий, рентгенографии или мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки.
Техника радикальной простатэктомии через дугласово пространство значительно отличается от стандартного подхода к выполнению РАРП. Последний последовательностью основных этапов повторяет технику открытой позадилонной радикальной простатэктомии, описанной P. Walsh в 1983 г. 6. Принципиальным отличием РС-РАРП является отсутствие этапа диссекции ретциева пространства, мобилизации мочевого пузыря и рассечения связочно-фасциального комплекса малого таза.
Этапы операции
Вскрытие париетальной брюшины в проекции шейки мочевого пузыря. Операция выполняется трансперитонеально, расположение роботических троакаров повторяет таковое при традиционном доступе. Ассистентские 12- или 5-миллиметровые порты также устанавливаются стандартно: параректально справа на 2–3 см выше оптического порта и на 6–8 см латерально от правого роботического порта соответственно. На первом этапе происходит вскрытие париетальной брюшины. В отличие от традиционного доступа, инцизия производится в проекции шейки мочевого пузыря, а не его верхушки. Для лучшей визуализации третьим роботическим инструментом осуществляется тракция задней стенки мочевого пузыря вверх.
Выделение семявыносящих протоков и семенных пузырьков (рис. 1). Этот этап операции выполняется сразу после вскрытия париетальной брюшины. Техника диссекции семявыносящих протоков и семенных пузырьков не отличается от стандартной. Основным фактором, обеспечивающим техническую сложность этого этапа, является небольшой объем операционного поля и невозможность выполнения широких тракций семенных пузырьков и самой предстательной железы, которая на данном этапе остается выделенной лишь на небольшой поверхности ее основания.
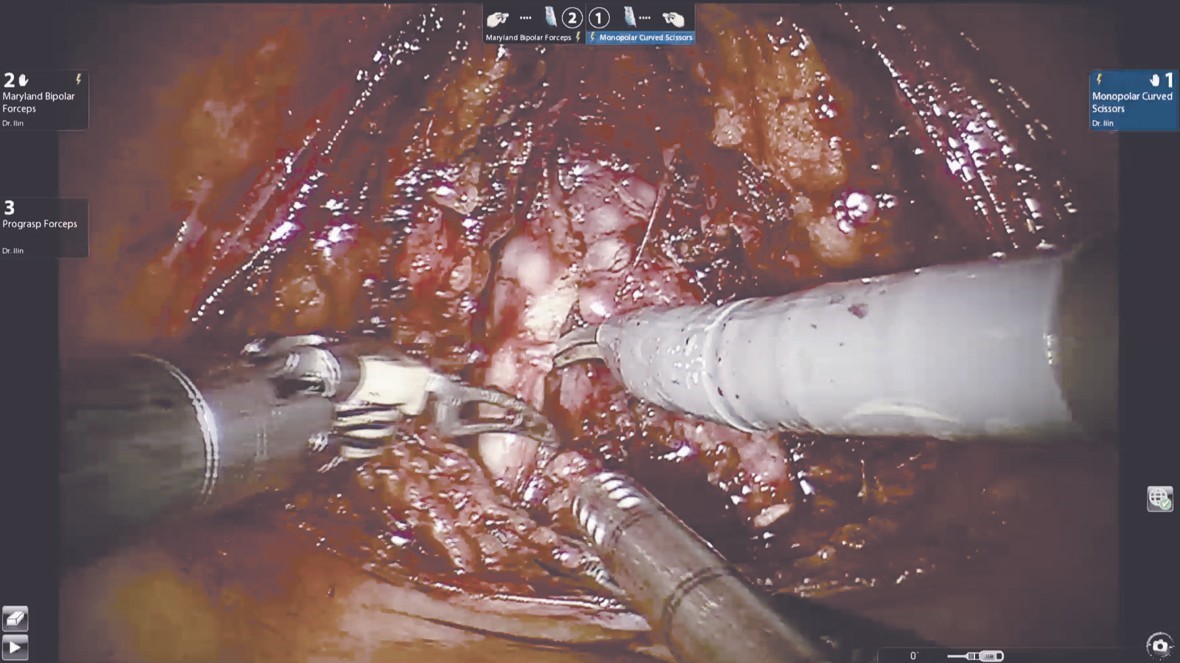 Рис. 1. Выделение семявыносящих протоков и семенных пузырьков
Рис. 1. Выделение семявыносящих протоков и семенных пузырьковВыделение задней поверхности простаты и сосудисто-нервных пучков (рис. 2), как и при традиционном доступе, происходит после этапа выделения семенных пузырьков.
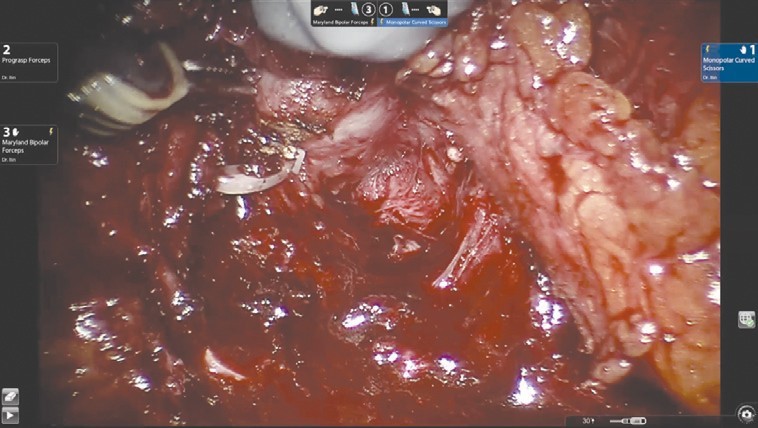 Рис. 2. Выделение задней поверхности предстательной железы и сосудисто-нервных пучков
Рис. 2. Выделение задней поверхности предстательной железы и сосудисто-нервных пучковУровень нервосбережения определяется на основании стадии опухолевого процесса. Для доступа к заднелатеральным отделам предстательной железы выполняется частичная латеральная диссекция пузырно-простатических мышечных волокон.
Диссекция шейки мочевого пузыря (рис. 3) выполняется в направлении снизу вверх и является одним из самых сложных шагов этой операции.
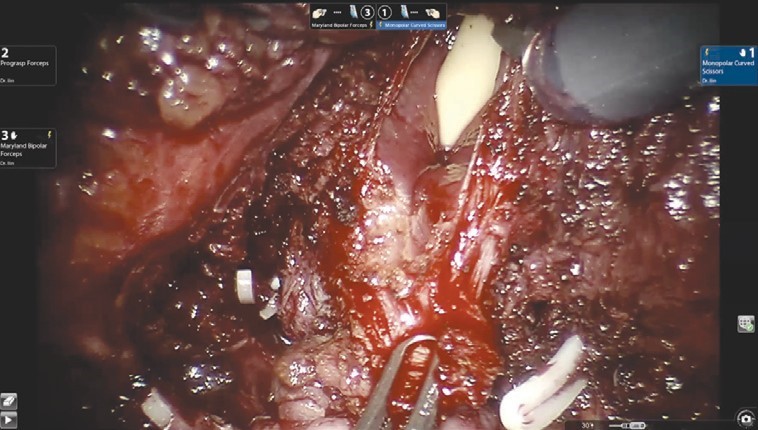 Рис. 3. Диссекция шейки мочевого пузыря
Рис. 3. Диссекция шейки мочевого пузыряНа этом этапе в наибольшей степени проявляется преимущество свободно изгибающихся на концах роботических инструментов. Для лучшей визуализации используется развернутая наверх (30°) оптика. Шейка мочевого пузыря вскрывается по задней поверхности, уретральный катетер извлекается, после чего рассекается передняя ее поверхность. На этом этапе в наибольшей степени проявляется преимущество свободно изгибающихся на концах роботических инструментов. Для лучшей визуализации используется развернутая наверх (30°) оптика. Шейка мочевого пузыря вскрывается по задней поверхности, уретральный катетер извлекается, после чего рассекается передняя ее поверхность.
Диссекция дорзального сосудистого комплекса производится тупым и острым путем без предварительного прошивания и перевязывания. После выделения верхушки простаты железа отсекается от уретры. На этом этапе при необходимости производится прошивание элементов дорзального комплекса. На рис. 4 представлено ложе удаленной предстательной железы.
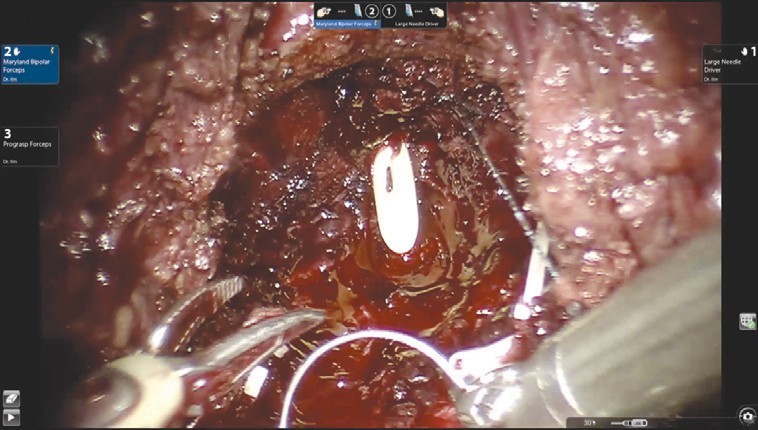 Рис. 4. Ложе удаленной предстательной железы
Рис. 4. Ложе удаленной предстательной железыНаложение пузырно-уретрального анастомоза (рис. 5) начинается с передней его стенки на 12 ч условного циферблата.
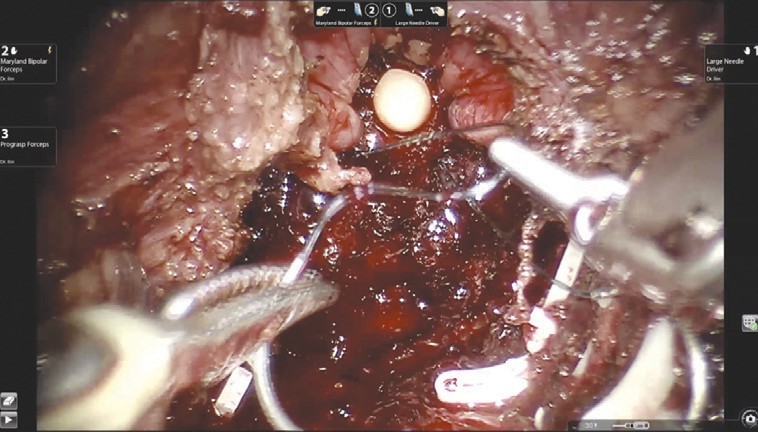 Рис. 5. Наложение пузырно-уретрального анастомоза
Рис. 5. Наложение пузырно-уретрального анастомозаАнастомоз выполняется с использованием самозатягивающихся нитей. Сложность этого этапа обусловлена, в основном, непривычной визуализацией. Ввиду того, что мобилизация мочевого пузыря не производилась, сопоставление слизистой уретры и мочевого пузыря происходит без видимого натяжения, поэтому усиления соустья с помощью дополнительной реконструкции не требуется. При необходимости выполняется задняя пластика шейки мочевого пузыря. Последним этапом производится установка дренажа к зоне анастомоза и ушивание париетальной брюшины.
Результаты
Время операции составило от 140 до 205 мин. Объем кровопотери — от 50 до 250 мл. Конверсий, в том числе в традиционный доступ через ретциево пространство, а также интраоперационных осложнений зафиксировано не было. Нервосберегающая РС-РАРП была выполнена трем пациентам. Гемотрансфузий не проводилось. Все больные находились под наблюдением в отделении реанимации и интенсивной терапии в течение первых 12–24 ч после операции. Дренаж у пациентов был удален на 1–2-е послеоперационные сутки. У двух больных отмечались осложнения класса I по Clavien. Длительность установки уретрального катетера составила 6–7 дней. Перед удалением уретрального катетера всем пациентам выполняли цистографию. Сразу после удаления уретрального катетера полное удержание мочи (отсутствие необходимости использовать страховочную прокладку) отметили 3 из 5 пациентов. Одному пациенту использование страховочной прокладки требовалось в течение 6 дней, еще одному — в течение 2 нед.
Пациентам после нервосберегающих вмешательств после удаления уретрального катетера была начата пенильная реабилитация препаратами ингибиторов фосфодиэстеразы 5-го типа. Повторных вмешательств и повторной госпитализации не проводилось. Общая длительность нахождения в стационаре составила от 4 до 8 койко-дней. При гистологическом исследовании препаратов простаты экстрапростатический положительный хирургический край был зафиксирован у одного больного. У этого же больного отмечена миграция стадии заболевания из cT2b в pT3a.
Обсуждение
Улучшению функциональных исходов радикальной простатэктомии посвящено множество исследований в России и за рубежом. Авторами предлагаются разные способы усиления пузырно-уретрального анастомоза, а также сохранения и реконструкции соединительнотканного каркаса тазового дна при выполнении РАРП традиционным доступом через предпузырное пространство 1, 7–9. Так, проф. М.С. Мосоян и др. впервые в нашей стране начали выполнять РАРП предпузырным доступом с максимальным сохранением окружающих предстательную железу анатомических структур и реконструкцией тазовой фасции и пубопростатических связок, что привело к значимому увеличению частоты ранней континенции в этой группе больных по сравнению с контрольной, в которой выполнялась более широкая диссекция простаты и не выполнялась реконструкция 1.
A.D. Asimakopoulos et al. 10 представили стандартизированную технику выполнения РАРП боковым доступом, при котором мобилизация мочевого пузыря происходит по латеральной и частично по антеролатеральной стороне, что позволяет уменьшить объем диссекции ретциева пространства по сравнению с традиционным подходом. Этот доступ позволяет максимально сохранить шейку мочевого пузыря, что, по мнению авторов, значимо улучшает вероятность раннего восстановления удержания мочи.
Для выполнения РАРП также применяется доступ через промежность. Первым этапом при таких операциях выполняется открытая диссекция диафрагмы таза, после чего начинается роботический этап, в ходе которого удаляется предстательная железа и накладывается анастомоз. V. Tugcu et al. В сравнительном исследовании традиционного и промежностного доступов продемонстрировали преимущество второго в длительности операции и частоте восстановления нормального удержания мочи 11.
В мировой литературе встречается все больше публикаций, демонстрирующих результаты начальных серий РС-РАРП. Эти результаты подтверждают перспективность такого минимально травматичного доступа к предстательной железе.
A. Galfano et al. 12, впервые предложившие этот доступ для выполнения радикальной простатэктомии, продемонстрировали в своей серии из 200 случаев, что частота позитивного хирургического края составила 10,1 %, а безрецидивная выживаемость в течение одного года — 92 %. Немедленное удержание мочи было отмечено у 90 % пациентов. Половой акт через 1 мес. после операции совершили 40 % пациентов с сохраненными сосудисто-нервными пучками. В отечественной научной литературе нам не встретилось ранее описанного опыта проведения РАРП через дугласово пространство. К моменту первых вмешательств новым доступом мы выполнили 102 РАРП традиционным трансперитонеальным способом.
В первых результатах РС-РАРП отмечается значительный разброс во времени вмешательства, что объясняется нахождением хирургической бригады на кривой обучения указанному доступу. Большого объема кровопотери не было зафиксировано ни у одного пациента. В целом, нами были получены удовлетворительные интраоперационные и ранние послеоперационные результаты лечения. В течение недели 4 из 5 пациентов перестали использовать страховочную урологическую прокладку. Несмотря на технические особенности доступа, осложняющие визуализацию границ предстательной железы на ранних этапах ее выделения, по результатам гистологического исследования препаратов удаленной железы интрапростатический позитивный хирургический край не был зарегистрирован ни у одного больного. Пациент с экстрапростатическим позитивным хирургическим краем, выявленным на фоне клинически неопределяемого экстракапсулярного распространения опухоли, в настоящее время получает адъювантное лечение в условиях онкологического стационара. Трое пациентов, перенесших нервосберегающую РС-РАРП, проходят пенильную реабилитацию. Оценка восстановления эректильной функции планируется на более позднем этапе наблюдения.
В настоящее время существует несколько способов добиться раннего восстановления удержания мочи у пациентов после радикального хирургического лечения рака простаты. Основными преимуществами техники РАРП с сохранением предпузырного пространства, на наш взгляд, является минимальная травма окружающих предстательную железу и мочевой пузырь тканей в ходе оперативного приема, что приводит к высоким ранним функциональным результатам без ущерба онкологическим исходам.
Выводы
РАРП с сохранением предпузырного пространства является доступным для освоения способом выполнения минимально-травматического вмешательства при локализованном раке предстательной железы, позволяющим добиться высоких ранних функциональных результатов лечения. Необходимо накопление большего опыта таких операций для оценки отдаленных исходов и сравнения их с данными РАРП, выполненными другими доступами.
Для цитирования: Ильин Д.М., Гулиев Б.Г. Ретциус-сберегающая робот-ассистированная радикальная простатэктомия: первый опыт и техника выполнения // Урологические ведомости. – 2019. – Т. 9. – № 4. – С. 19–24. https://doi.org/10.17816/ uroved9419-24