Особенности робот-ассистированной простатэктомии при выраженной средней доле предстательной железы
Резюме. Представлено клиническое наблюдение оперативного лечения пациента со злокачественным онкопроцессом в предстательной железе, с пролабирующей её средней долей в мочевой пузырь и объёмом железы 88 см3. Особенность данного клинического случая заключается в интраоперационной картине при оперативном вмешательстве, поэтапной сложности, ввиду выраженной средней доли предстательной железы. Мультидисциплинарный и радикальный подход к решению данной ситуации помог в дальнейшем максимально избежать онкорецидива и сохранить сосудисто-нервные пучки предстательной железы. Благодаря этому пациент в кратчайшие сроки прошел реабилитационный курс и вернулся к привычному образу жизни.
Обоснование
В структуре заболеваемости злокачественными новообразованиями мужского населения РФ в 2019 г. рак предстательной железы (РПЖ) занимал 2-е место [1]. По данным Европейской [2] и Американской [3] урологических ассоциаций на сегодняшний день общепризнанной хирургической методикой лечения РПЖ является радикальная простатэктомия, которую возможно выполнить открытым, лапароскопическим (робот-ассистированным) доступами. При этом радикальная робот-ассистированная простатэктомия ассоциируется с низкими показателями кровопотери и сроком госпитализации в условиях стационара [4]. С момента зарождения робот-ассистированных операций на предстательной железе (ПЖ) наличие средней доли ассоциировалось с возникновением дополнительных трудностей для хирурга. Альтернативные радикальные методы лечения — дистанционная лучевая терапия и брахитерапия у пациентов с большой средней долей связаны с высокой долей осложнений, одним из которых является острая задержка мочеиспускания [5; 6]. В 2005 г. Sarle R., et al. впервые описали «подводные камни» выполнения радикальной робот-ассистированной простатэктомии у пациента с выраженной средней долей: возможное повреждение дистальных отделов мочеточников, наличие положительного хирургического края и послеоперационное недержание мочи [7]. Labanaris A.P., et al. в своем исследовании делают акцент на опыте хирурга и относят робот-ассистированную радикальную простатэктомию с большой средней долей к операциям повышенной сложности [8].
Пациент Д., 64 лет, 24.04.2022 г. в плановом порядке поступил в НМХЦ им. Н.И. Пирогова с основным диагнозом: РПЖ (аденокарцинома) Т2аN0M0 I стадия.
Из анамнеза: перенес аппендэктомию в 1970 г. 20.01.2022 г. отмечено повышение уровня общего ПСА крови до 5,2 нг/мл. По данным МРТ органов малого таза от 10.02.2022 г.: ПЖ размерами 57×42×71 мм, приблизительным объемом 88 см3. Транзиторная зона ПЖ увеличена в размерах за счет стромальной и железистой гиперплазии, с наличием многочисленных инкапсулированных узлов в правой и левой долях. За счет гиперплазии ретроуретральной зоны ПЖ пролабирует в полость мочевого пузыря на 25 мм. Изменения в периферической зоне ПЖ могут соответствовать PI-RADS 5 (Рис. 1–3).
 Рис. 1. МРТ органов малого таза (коронарная
проекция).
Рис. 1. МРТ органов малого таза (коронарная
проекция).
 Рис. 2. МРТ органов малого таза
(сагиттальная проекция).
Рис. 2. МРТ органов малого таза
(сагиттальная проекция).
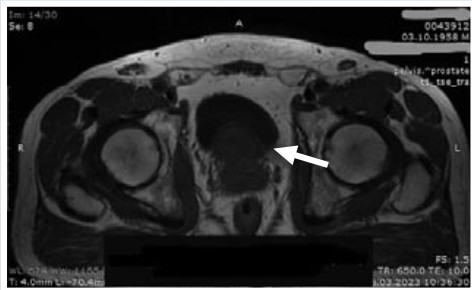 Рис. 3. МРТ органов малого таза
(аксиальная проекция).
Рис. 3. МРТ органов малого таза
(аксиальная проекция).С целью верификации диагноза, 21.02.2022 г. выполнена трансректальная мультифокальная биопсия ПЖ, выявлен РПЖ (аденокарцинома) 7 баллов по Глисону (3+4).
Жалобы на момент поступления на затрудненное мочеиспускание вялой струей, ночное мочеиспускание до 4 раз.
25.04.2022 г. выполнена роботассистированная нервосберегающая простатвезикулэктомия. Операция выполнялась опытным роботическим хирургом (опыт — более 800 операций, в том числе опыт проведения робот-ассистированных радикальных простатэктомий — более 500 операций). Интраоперационно: при осмотре органов брюшной полости отмечен спаечный процесс в правой подвздошной области (аппендэктомия в анамнезе). Произведено иссечение спаек с мобилизацией слепой кишки для возможности бестраматичного функционирования троакара, установленного в данной области. Произведено рассечение париетальной брюшины по полукружной линии, соединяющей передние подвздошные ости. С выраженными техническими сложностями в виду значительно увеличенной «средней доли» простаты, пролабирующей в полость мочевого пузыря, шейка мочевого пузыря отсечена от основания ПЖ. Средняя доля полностью выделена, выведена из просвета мочевого пузыря, визуализированы устья мочеточников (Рис. 4).
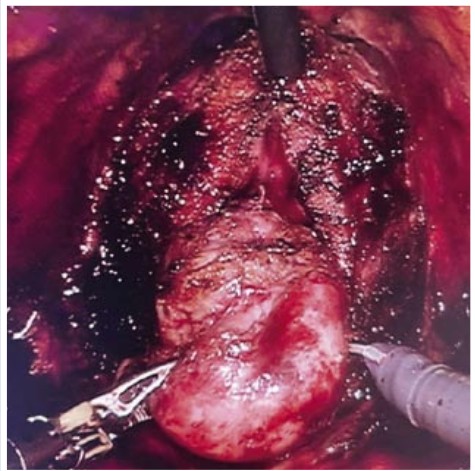 Рис. 4. Интраоперационная картина ПЖ с
выраженной средней долей.
Рис. 4. Интраоперационная картина ПЖ с
выраженной средней долей.
Следует отметить, что в некоторых случаях устья могут прилежать к средней доле, это может увеличить риск их повреждения. С другой стороны, «неадекватная» резекция может привести к наличию положительного хирургического края. В связи с этим крайне важным моментом является проведение тщательной и прецизионной диссекции в области устьев обоих мочеточников. Произведена прецизионная мобилизация ПЖ с сохранением латеральных сосудистонервных пучков. Макропрепараты (ПЖ с семенными пузырьками) отправлены на гистологическое исследование (Рис. 5).
 Рис. 5. Макропрепарат (ПЖ).
Рис. 5. Макропрепарат (ПЖ).
Длительность операции составила около 200 мин. Консольное время — 135 мин. Объем кровопотери не превысил 120 мл.
Результаты
Послеоперационный период протекал без особенностей. Проводилась противовоспалительная, гемостатическая и симптоматическая терапия в послеоперационном периоде. С целью противовоспалительной и противоотечной терапии проведен курс инстилляций мочевого пузыря раствором гидрокортизона. На фоне проводимой терапии состояние пациента с положительной динамикой. При цистографии на обзорных снимках после введения водорастворимого контраста через катетер, контраст заполняет мочевой пузырь, контуры которого четкие, ровные. Достоверные признаки затеков в малый таз не определяются (Рис. 6).
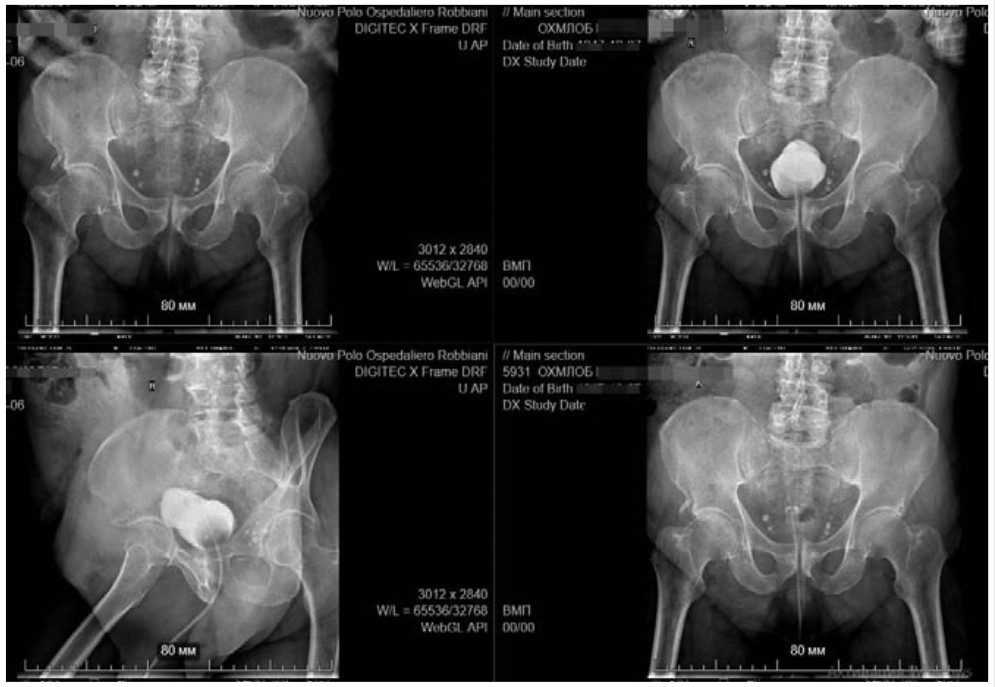 Рис. 6. Цистография.
Рис. 6. Цистография.
На 7-е сутки уретральный катетер удален, восстановлено самостоятельное мочеиспускание. Проводилось динамическое наблюдение в период восстановления самостоятельного мочеиспускания. После удаления катетера наблюдалось частичное удержание мочи. По данным урофлоуметрии на следующие сутки после удаления катетера наблюдалась максимальная скорость — 24,1 мл/с, средняя скорость — 14,9 мл/с (Рис. 7, 8).
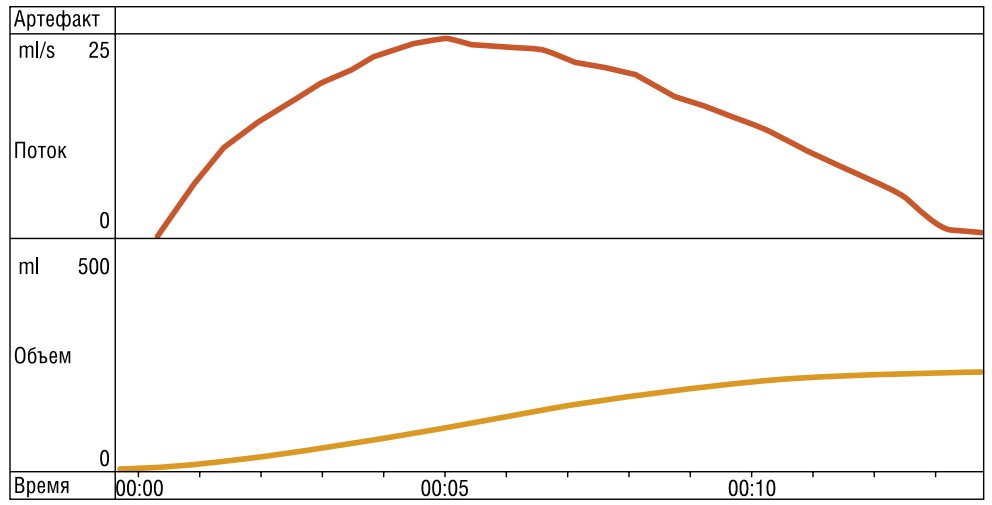 Подпись к изображениюРис. 7. График
урофлоуметрии (после удаления катетера).
Подпись к изображениюРис. 7. График
урофлоуметрии (после удаления катетера).
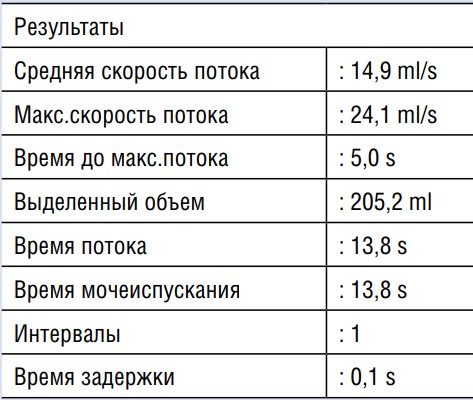 Рис. 8. Результаты урофлоуметрии (после удаления катетера).
Рис. 8. Результаты урофлоуметрии (после удаления катетера).
По результатам гистологического исследования установлен диагноз: РПЖ (аденокарцинома) pТ2сN0M0 R0 GG2 II стадия. В удовлетворительном состоянии выписан под наблюдение уролога и онколога по месту жительства. Через 3 месяца после оперативного вмешательства проведен опросник «международный индекс эректильной функции» (МИЭФ-5), по результатам которого пациент отметил полное восстановление эректильной функции.
Заключение
Клиническое наблюдение показывает, что проведение робот-ассистированной простатэктомии у пациентов с выраженной средней долей может столкнуть хирурга с проблемами, которые не характерны при стандартных операциях. При данной клинической картине возможно повреждение мочеточников при достаточно обширной резекции шейки мочевого пузыря и большой размер ПЖ изменяет анатомию малого таза, затрудняя проведение резекции, что, в свою очередь, может привести к наличию положительного хирургического края.
Авторы заявляют об отсутствии конфликта интересов.

-2x.jpg)







