Особенности респираторной поддержки у пациентов с различным индексом массы тела во время робот-ассистированной радикальной простатэктомии
Для цитирования: А. С. Казаков, О. А. Гребенчиков, А. В. Ершов. Особенности респираторной поддержки у пациентов с различным индексом массы тела во время робот-ассистированной радикальной простатэктомии. Общая реаниматология. 2023; 19 (4): 20–28. https://doi.org/10.15360/1813-9779-2023-4-2341 [На русск. и англ.]
Резюме
Цель исследования. Оценка влияния карбоксиперитонеума и положения Тренделенбурга на биомеханику дыхания и показатели газообмена пациентов с различным индексом массы тела во время робот-ассистированной радикальной простатэктомии (РРП) и разработка алгоритма выбора оптимального режима респираторной поддержки.
Материалы и методы. В исследование включили 141 пациента с верифицированным раком предстательной железы, которым предстояло выполнение РРП. В зависимости от индекса массы тела (ИМТ) пациентов разделили на 2 группы: в группу I вошли 88 человек с ИМТ<30, в группу II — 53 человека с ИМТ≥30. В каждой группе изучили показатели биомеханики дыхания и газообмена при ИВЛ в различных режимах (Volume Control Ventilation (VCV), Pressure Control Ventilation (PCV), Pressure Control Ventilation — Inverse Ratio Ventilation (PCV-IRV)). Данные показатели анализировали на 5 этапах операции.
Результаты. Основные параметры эффективности и безопасности респираторной поддержки при РРП в группе пациентов с ИМТ<30 при любом использованном режиме ИВЛ значимо не отличались. У пациентов с ожирением использование режима VCV, начиная с этапа приведения в 35° положение Тренделенбурга, привело к значимому росту величины пикового давления в дыхательных путях Ppeak, угрожая развитием бароповреждения легких, а также сопровождалось значимо меньшими значениями SpO₂, начиная с этапа наложения карбоксиперитонеума и до окончания оперативного вмешательства.
Заключение. У пациентов без ожирения выбор какого-либо конкретного режима ИВЛ не имеет решающего значения в достижении безопасности и эффективности анестезиологического обеспечения РРП. Оптимальным методом ИВЛ при проведении анестезии у пациентов с РРП и ИМТ≥30 можно считать вентиляцию с управляемым давлением (PCV) и ее вариант с инверсией времени вдоха-выдоха (PCV-IRV), с соотношением вдох/выдох 1,5:1.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Введение
Сегодня радикальная простатэктомия является «золотым стандартом» лечения локализованной формы рака предстательной железы. В течение последних нескольких лет подобная операция, выполняемая с помощью робот-ассистированной методики, стала серьезной альтернативой в лечении данных пациентов [1].
Одним из неотъемлемых условий оптимальной визуализации операционного поля при робот-ассистированной простатэктомии, является выполнение карбоксиперитонеума. Оптимальное «рабочее» давление углекислого газа, с точки зрения безопасности пациента и удобства работы хирурга в брюшной полости, составляет не более 12 см вод. ст. В момент установки портов и прошивания дорсального венозного комплекса допустимо кратковременное увеличение до 15 см вод. ст. Вторым условием является приведение пациента в положение Тренделенбурга (угол наклона головного конца операционного стола до 40°) [2–4]. Каждый их этих факторов по отдельности, а также их сочетание, вызывают серьезные изменения со стороны различных органов и систем (прежде всего дыхательной, сердечно-сосудистой и экскреторной), а также требуют наличия своевременной обратной связи для предотвращения развития жизнеугрожающих состояний [4, 5]. К настоящему времени доступно лишь небольшое число клинических исследований влияния длительно сохраняющегося пневмоперитонеума и положения Тренделенбурга на физиологические показатели пациента [6, 7].
Воздействие позиции Тренделенбурга на дыхательную систему может быть результатом краниального смещения диафрагмы при наклоне головного конца стола на угол от 30° до 45°, используемом в операционных. Это уменьшает податливость легких. Положение Тренделенбурга также оказывает негативное влияние на механизмы вентиляции, уменьшая функциональную остаточную емкость [8].
В процессе длительной вентиляции, независимо от изначального состояния легочной ткани, постепенно проявляется отрицательное влияние ИВЛ на состояние легких, что в итоге приводит к серьезному нарушению вентиляционно-перфузионных соотношений. Наибольшее негативное влияние ИВЛ на легкие обусловлено высоким пиковым давлением на вдохе [9–11].
Существует два способа проведения управляемой вентиляции легких во время РРП: либо в режиме контролируемого давления (Pressure Control Ventilation — PCV), либо в режиме контролируемого объема (Volume Control Ventilation — VCV), вентиляционная поддержка в этих режимах может осуществляться с инвертированным соотношением времени вдоха-выдоха [12, 13].
Оба способа компенсируют последствия пневмоперитонеума и аномального позиционирования, что позволяет поддерживать механизм дыхания пациента и гемодинамику в пределах нормального диапазона во время операции. C. C. Balick-Weber и соавт. исследовали влияние PCV-режима по сравнению с VCV-режимом вентиляции во время простатэктомии и не выявили гемодинамических преимуществ одного метода перед другим. Тем не менее, вентиляция с контролем давления снижала пиковое давление и увеличивала среднее давление в дыхательных путях во время операции. Кроме того, у пациентов, которым проводилась вентиляция с контролем давления, имелось значительное увеличение динамической податливости легких, по сравнению с пациентами, которым выполнялась вентиляция с контролем объема [14].
Это исследование было воспроизведено E. M. Choi с соавторами во время РРП. Они сообщили, что режим PCV не имел преимуществ по сравнению с режимом VCV в отношении механики дыхания или гемодинамики, за исключением более строгого соблюдения параметров режима и нижнего пика давления в дыхательных путях. В этом исследовании развитие гипоксемии при позиции Тренделенбурга с пневмоперитонеумом было связано с увеличением мертвого дыхательного пространства [15]. Применение режима PCV рекомендовано тучным пациентам и пациентам с легочной патологией, так как у них показатели пикового давления в положении Тренделенбурга во время пневоперитонеума очень часто достигают критического значения (40 см вод. ст. и более). Опасное увеличение пикового давления (>40 см вод. ст.) может приводить к баротравме легких, что чревато разрушением структуры альвеол, высвобождением медиаторов воспаления, пневмотораксом, увеличением проницаемости легочных капилляров, микрокровоизлияниями в интерстиций легких [16–19].
Часто выбранный режим ИВЛ оказывается неэффективным и не обеспечивает достаточной оксигенации артериальной крови. При этом попытка дальнейшего увеличения управляемого давления (Pcontrol), положительного давления конца выдоха (PEEP), концентрации кислорода в дыхательной смеси (FiO₂) либо не приводит к улучшению оксигенации крови, либо требует достижения очень высоких цифр (Pcontrol>35 см вод. ст., PEEP=10–12 см вод. ст., FiO₂>60%). Некоторые авторы в таких ситуациях рекомендуют использовать ИВЛ с инвертированным соотношением времени вдоха к выдоху [18]. Наш опыт в совокупности с результатами последних крупных рандомизированных исследований показывает, что оптимальное значение PEEP при ИВЛ во время РРП составляет 5 см вод. ст. [20, 21].
Одной из наиболее сложных групп пациентов (особенно на начальных этапах освоения роботассистированной хирургии) являются тучные пациенты с ИМТ более 30, что приводит к дополнительным трудностям во время проведения анестезии. В исследовании A. L. Wiltz у тучных пациентов, по сравнению с пациентами без ожирения, выявлена повышенная частота оперативной конверсии (2,3 и 0,9% соответственно), что в 80% случаев было связано с повышенным давлением в дыхательных путях. В целом, у таких пациентов часто снижена дыхательная функция легких, и они склонны к развитию послеоперационных респираторных осложнений [22]. Согласно исследованию D. Meininger, во время лапароскопической операции в положении Тренделенбурга у больных с избыточной массой тела (ИМТ больше 25–30) существенно нарушается артериальная оксигенации [23]. Развитие подобной картины может ожидать и должен предупреждать анестезиолог в ходе проведения анестезии у больных с ожирением во время выполнения РРП.
Цель исследования — оценка влияния карбоксиперитонеума и положения Тренделенбурга на биомеханику дыхания и показатели газообмена пациентов с различным индексом массы тела во время робот-ассистированной радикальной простатэктомии (РРП) и разработка алгоритма выбора оптимального режима респираторной поддержки.
Материал и методы
После одобрения этическим комитетом (решение этического комитета Федерального научно-клинического центра Реаниматологии и реабилитологии №5/20/6 от 23.12.2020) и получения письменного информированного согласия в проспективное обсервационное исследование включили 141 пациента с верифицированным раком предстательной железы, которым предстояло выполнение РРП в течение 2022 г.
Схему исследования представили на рисунке.
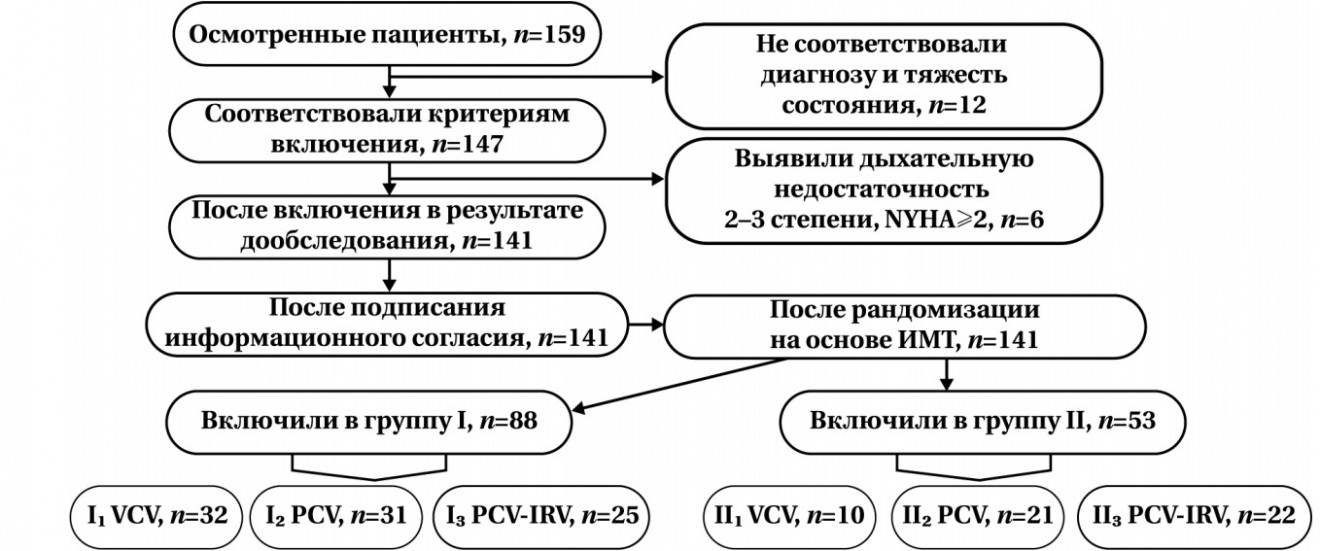 Рис. Схема исследования.
Рис. Схема исследования.
Критерии включения в исследование:
- диагноз рак простаты, верифицированный на основании клинических, лабораторных, инструментальных и патогистологических методов исследования;
- планируемое оперативное вмешательство — РРП;
- риск анестезии по классификации ASA 1–2 (American Society of Anesthesiologists — Американское общество анестезиологов);
- подписание информированного добровольного согласия пациента на участие в исследовании.
Критерии исключения:
- отказ от участия в исследовании /подписания формы согласия;
- оценка анестезиологического риска ASA≥3;
- хронические неспецифические заболевания легких и/или дыхательная недостаточность 2–3-й степени;
- хроническая сердечная недостаточность — NYHA≥2 (New York Heart Association Functional — классификация Нью-Йоркской кардиологической ассоциации).
В зависимости от индекса массы тела (ИМТ) пациентов разделили на 2 группы: в группу I вошли 88 человек с ИМТ<30, в группу II — 53 человека с ИМТ≥30. В каждой группе изучили показатели биомеханики дыхания и газообмена. В зависимости от применяемого метода ИВЛ (режимы ИВЛ: VCV, PCV, PCV-IRV) пациентов каждой группы разделили на 3 подгруппы.
Анализ показателей биомеханики дыхания и параметров газообмена выполняли на следующих ключевых этапах операции:
- 1 этап: вводный наркоз, горизонтальное положение;
- 2 этап: создание карбоксиперитонеума, установка троакаров;
- 3 этап: приведение в 35° положение Тренделенбурга, 5 мин после начала операции;
- 4 этап: 45 мин от момента приведения в максимальное положение Тренделенбурга;
- 5 этап: горизонтальное положение, конец операции, десуффляция СО₂.
На каждом из ключевых этапов регистрировали следующие параметры:
- концентрацию углекислого газа на выдохе (EtCO₂), мм рт. ст.,
- частоту дыхания (ЧД), мин-1,
- дыхательный объем (ДО), мл,
- пиковое давление в дыхательных путях (Ppeak), см вод. ст.,
- среднее давление в дыхательных путях (Pmean), см вод. ст.,
- насыщение крови кислородом (SpO₂), %.
После транспортировки пациента в операционную начинали стандартный мониторинг (электрокардиограмма, неинвазивное артериальное давление, пульсоксиметрия).
Расчет дозировки препаратов для проведения комбинированного эндотрахеального наркоза проводили на основе идеальной массы тела. Всем пациентам выполняли стандартную медикаментозную премедикацию на операционном столе на фоне инсуффляции 100% кислорода через лицевую маску с потоком 6–8 л/мин: атропина сульфат 0,1% — 0,01–0,02 мг/кг, клемастин 0,2% — 0,03–0,05 мг/кг, мидазолам 0,02–0,06 мг/кг, фентанил 0,005% — 1–3 мкг/кг. Вводный наркоз индуцировали введением гипнотика пропофола 1,5–2,5 мг/кг до достижения целевых цифр BIS 30–40.
На фоне угнетенного сознания вводили расчетную дозировку недеполяризующего миорелаксанта рокурония бромид 0,5 мг/кг и выполняли интубацию трахеи эндотрахеальной трубкой №8,0–9,0. В связи с возможностью смещения дистального конца эндотрахеальной трубки в сторону карины и развития однолегочной вентиляции после приведения в положение Тренделенбурга осуществляли обязательный аускультативный контроль на всех этапах позиционирования пациента. После интубации трахеи устанавливали назогастральный зонд с целью минимизации риска травматического повреждения желудка во время установки троакаров, а также для профилактики развития послеоперационной тошноты и рвоты. Поддержание анестезии проводили ингаляционным анестетиком севофлуран (Севоран®), поддерживая BIS = 40–50. Миорелаксации достигали болюсным введением расчетных доз рокурония бромида. Искусственную вентиляцию легких проводили аппаратом Drager Primus (Dragerwerk, Германия), кислородно-воздушной смесью в соотношении 0,4/0,6, с потоком 1 л/мин в режимах, различных для каждой подгруппы пациентов. Аппаратные установки частоты дыхания в процессе анестезии корректировали с целью достижения оптимального парциального давления углекислого газа на выдохе 4,9–6,4 об%. Для поддержания нормокапнии учитывали постоянную инсуффляцию СО₂ через порт роботического троакара и неизбежное его попадании в сосудистое русло, с последующей динамической коррекцией выставляемых параметров аппарата искусственной вентиляции легких [24].
После окончания операции у всех пациентов осуществили экстубацию трахеи и перевод в стабильном состоянии в послеоперационную палату для проведения симптоматической терапии и клинико-лабораторного мониторинга.
РАРП выполняли при помощи сиcтемы da-Vinci Si (Intuitive Surgical, Mountain View, CШA). После интубации трахеи пациента укладывали в литотомическое положение, под плечи пациента устанавливали специальные мягкие фиксаторы, ограничивающие его смещение во время операции относительно операционного стола. В брюшную полость устанавливали 5 портов, для чего в брюшной полости создавали карбоксиперитонеум с исходным давлением СО₂ 15 мм рт. ст., после окончания этого этапа и перемещения пациента в положение Тренделенбурга давление газа в брюшной полости снижали до безопасных 12 мм рт. ст.
Объем выборки определяли достижением минимальной статистической мощности 80% и ошибки первого рода 5% по формуле (Lopez-Jimenez F. et al., 1998). Исследование в группе II (подгруппа I) было досрочно прекращено после получения результатов, свидетельствовавших о высоком риске развития бароповреждения легких. Статистическую обработку данных производили с использованием прикладного программного обеспечения Excel 2016 (Microsoft, США), SPSS Statistica v. 24 (IBM, США). Для проверки распределения количественных переменных на нормальность применяли критерий Колмогорова–Смирнова с коррекцией Лильефорса. Показатели с нормальным распределением описывали в виде средней и стандартного отклонения в формате «M±SD». Показатели с распределением, отличным от нормального, описывали медианой и интерквартильным размахом в формате «Me [Q25; Q75]». Качественные показатели представили в виде абсолютного и относительного значения — n (%). Значимость различия между изучаемыми группами для количественных переменных с нормальным распределением оценивали с помощью t-критерия Стьюдента для независимых выборок, при распределении, отличном от нормального — с помощью критерия Манна–Уитни. Достоверность различий внутри группы для повторных измерений показателей с нормальным распределением оценивали с помощью t-критерия Стьюдента для связанных выборок. Для сравнения нормально распределенных данных между тремя и более группами использовали однофакторный дисперсионный анализ (ANOVA), при распределении, отличающимся от нормального — дисперсионный анализ Краскелла–Уоллиса. Для сравнения групп по качественным признакам использовали критерий χ²-квадрат Пирсона или точный двусторонний критерий Фишера для малых выборок. Статистически значимыми считали различия при p<0,05, где p — вероятность ошибки первого рода при проверке нулевой гипотезы. Для контроля вероятности ошибки первого рода (ошибка отвержения верной нулевой гипотезы) при множественных сравнениях применяли поправку Бонферрони.
Результаты и обсуждение
Средний возраст пациентов подгруппы I₁ составил 57,44±5,09 лет, подгруппы I₂ — 57,35±5,40 лет, подгруппы I₃ — 56,60±4,35 лет (p=0,84). Средний возраст пациентов подгруппы II₁ составил 56,60±4,04 лет, подгруппы II₂ — 57,48±6,00 лет, подгруппы II₃ — 57,86±5,09 лет (p=0,39). Распределение больных по возрасту в группах представили в табл. 1.
Таблица 1. Распределение по возрасту, n (%).
| Возраст, лет | Значения показателя в группах | p | |||||||
|---|---|---|---|---|---|---|---|---|---|
| I, подгруппы | II, подгруппы | ||||||||
| I₁, n=32 | I₂, n=31 | I₃, n=25 | Всего, n=88 | II₁, n=10 | II₂, n=21 | II₃, n=22 | Всего, n=53 | ||
| 45–50 | — | 2 (6,7) | 3 (12,0) | 5 (5,7) | 1 (10,0) | 2 (9,5) | 1 (4,5) | 4 (7,5) | 0,73 |
| 51–55 | 13 (43,3) | 11 (36,7) | 7 (28,0) | 31 (35,2) | 2 (20,0) | 7 (33,3) | 9 (40,9) | 18 (34) | 0,88 |
| 56–60 | 14 (46,7) | 12 (40,0) | 11 (44,0) | 37 (42,0) | 6 (60,0) | 8 (38,1) | 8 (36,4) | 22 (41,5) | 0,95 |
| 61–65 | 3 (10,0) | 3 (10,0) | 4 (16,0) | 10 (11,4) | 1 (10,0) | — | 3 (13,6) | 4 (7,5) | 0,57 |
| 66–70 | — | 2 (6,7) | — | 2 (2,3) | — | 4 (19,0) | 1 (4,5) | 5 (9,4) | 0,1 |
| 71–75 | 2 (6,7) | 1 (3,3) | — | 3 (3,4) | — | — | — | — | 0,29 |
ИМТ пациентов в подгруппах обеих групп также был сопоставим. Так, для подгруппы I₁ медиана этого показателя составляла 27,0 [24,5; 29,0], для подгруппы I₂ — 28,5 [24,25; 29,45], для подгруппы I₃ — 28,2 [25,15; 29,0] (p=0,12).
В подгруппе II₁ медиана составила 34,5 [31,25; 35,15], подгруппе II₂ — 33,25 [30,5; 35,0], подгруппе II₃ — 34,0 [31,2; 36,0] (p=0,20).
Распределение пациентов согласно классификации ASA показали в табл. 2. Степень анестезиологического риска 2 по классификации ASA имели 2/3 включенных больных, различия между группами были статистически не значимыми.
Таблица 2. Распределение больных по степени анестезиологического риска, n (%).
| ASA |
|
p | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| I, подгруппы | II, подгруппы | |||||||||
| I₁, n=32 | I₂, n=31 | I₃, n=25 | Всего, n=88 | II₁, n=10 | II₂, n=21 | II₃, n=22 | Всего, n=53 | |||
| 1 | 6 (18,8) | 9 (29,0) | 5 (20,0) | 20 (22,7) | 2 (20,0) | 4 (19,0) | 6 (27,3) | 12 (22,6) | 0,84 | |
| 2 | 26 (81,3) | 22 (71,0) | 20 (80,0) | 68 (77,3) | 8 (80,0) | 17 (81,0) | 16 (72,7) | 41 (77,4) | 0,84 | |
При исследовании биомеханики дыхания и параметров газообмена у пациентов с нормальным ИМТ (табл. 3), применяя режим ИВЛ с управляемым объемом (VCV), пришли к выводу, что его использование в условиях нормовентиляции можно считать достаточно безопасным (максимальное значение Ppeak, отмеченное на 4 этапе исследования составило 30,4±3,1 см вод. ст.) и полностью удовлетворяющим физиологические потребности организма в обеспечении адекватного дыхания (минимальное зафиксированное значение SpO₂ — 96,2±3,0%). Режим ИВЛ с заданным давлением (PCV), примененный у пациентов с нормальным индексом массы тела, также позволил обеспечить адекватную оксигенацию (минимальное зафиксированное значение SpO₂ 96,0±1,3%) и желаемую безопасность (максимальное значение Ppeak на 4 этапе исследования составило 28,5±5,6 см вод. ст.). Респираторная поддержка с управлением по давлению, но с инвертированным соотношением вдохвыдох (PCV-IRV), также создавало условия для предотвращения бароторавмы легких (максимальное значение P peak на 4 этапе исследования составило 29,1±2,3 см вод. ст.) Это свидетельствовало о возможности его применения у пациентов без ожирения, что также подтверждает исследование, проведенное L. Ashworth [25].
Таблица 3. Респираторные показатели пациентов с нормальным индексом массы тела (n=88) на протяжении операции при разных режимах ИВЛ (M±SD).
| Режим ИВЛ | Этапы | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Концентрация углекислого газа на выдохе (EtCO₂), мм рт. ст. | |||||
| VCV | 31,1±8,4 | 34,3±8,1 | 38,2±8,4 | 37,7±9,2 | 40,1±8,9 |
| PCV | 32,3±1,2 | 35,1±1,1 | 36,7±1,3 | 36,8±2,5 | 39,2±4,3 |
| PCV-IRV | 33,1±3,2 | 35,3±1,6 | 35,2±3,4 | 36,4±2,1 | 39,5±3,2 |
| Частота дыхания (ЧД), мин⁻¹ | |||||
| VCV | 9,1±1,7 | 10,3±1,2 | 12,5±1,3 | 12,1±1,1 | 13,0±1,2 |
| PCV | 9,1±0,5 | 10,2±1,4 | 12,1±1,6 | 12,2±1,1 | 13,6±1,9 |
| PCV-IRV | 9,4±1,3 | 10,3±1,6 | 11,7±1,2 | 12,5±1,6 | 12,6±2,4 |
| Дыхательный объем (ДО), мл | |||||
| VCV | 630,1±25,4 | 640,5±37,2 | 645,0±32,1 | 658,3±38,5 | 690,0±57,2 |
| PCV | 615,9±45,7 | 625,5±52,4 | 637,2±36,3 | 690,4±42,1 | 636,5±54,6 |
| PCV-IRV | 620,8±18,3 | 636,7±31,5 | 656,2±37,1 | 649,9±41,4 | 678,2±37,8 |
| Пиковое давление дыхательных путей (Ppeak), см вод. ст. | |||||
| VCV | 14,2±3,6 | 23,8±3,2 | 29,4±5,3 | 30,4±3,1 | 15,7±3,2 |
| PCV | 14,4±5,2 | 22,0±2,1 | 27,4±6,8 | 28,5±5,6 | 14,3±6,8 |
| PCV-IRV | 12,2±4,1 | 21,4±4,5 | 27,7±4,5 | 29,1±2,3 | 13,7±5,1 |
| Среднее давление дыхательных путей (Pmean), см вод. ст. | |||||
| VCV | 9,8±1,1 | 13,1±2,4 | 15,1±4,7 | 16,4±4,1 | 8,3±3,1 |
| PCV | 10,1±1,1 | 16,3±3,4 | 19,5±4,2 | 20,7±8,2 | 11,0±4,4 |
| PCV-IRV | 8,7±1,1 | 11,2±3,6 | 13,1±5,2 | 14,3±4,5 | 7,7±5,2 |
| Насыщение крови кислородом (SpO₂), % | |||||
| VCV | 97,1±1,3 | 96,2±3,0 | 97,2±6,4 | 97,1±1,0 | 98,5±2,6 |
| PCV | 97,5±1,2 | 96,3±1,3 | 97,7±0,8 | 97,4±1,1 | 99,5±2,0 |
| PCV-IRV | 98,4±1,1 | 97,2±3,0 | 97,5±4,1 | 98,8±3,3 | 98,4±3,1 |
Примечание. Значения p для попарных сравнений респираторных показателей на различных этапах операции указаны в табл. 5 и 7.
Таким образом, стабильность показателей дыхания у пациентов без ожирения, вне зависимости от выбранного режима ИВЛ в условиях повышенной нагрузки со стороны пневмоперитонеума и положения Тренделенбурга, демонстрировала адекватность и безопасность проведенного анестезиологического обеспечения РРП с поправкой на своевременную коррекцию параметров ИВЛ на различных этапах операции. У всех пациентов с нормальным индексом массы тела вне зависимости от выбранного режима респираторной поддержки для предотвращения гиповентиляции на этапах от выполнения пневмоперитонеума до экстубации трахеи требовалось корректировать ЧД и ДО в сторону увеличения. Показатели EtCO₂ оставались на протяжении всей операции в пределах допустимого физиологического диапазона, но к концу операции отмечали их закономерное, значимое увеличение, которое также требовало незначительной коррекции параметров вентиляции в сторону гипервентиляции: увеличения аппаратных значений ЧД и ДО.
Выбор режима ИВЛ у данной группы пациентов не имел принципиального значения, т. к. каждый из них позволял обеспечить приемлемую оксигенацию крови без использования высоких токсических концентраций кислорода и предупреждал риск развития баротравмы. Наибольшее значение имело непрерывное динамическое наблюдение за показателями дыхательного гомеостаза и своевременная коррекция параметров ИВЛ в зависимости от этапа операции и ответа со стороны организма пациента.
Выбор режима ИВЛ для пациентов с ИМТ≥30 имел огромное значение при проведении безопасной анестезии. В связи с чрезмерным повышением пикового давления в дыхательных путях (табл. 4) — максимальное значение P peak на 4 этапе исследования составило 38,2±3,1 см вод. ст. при использовании режима ИВЛ с управляемым объемом, возникала реальная угроза развития баротравмы легких, что является недопустимым в концепции проведения безопасной анестезии. Полученные результаты способствовали прекращению ислледования в данной подгруппе. Данный режим ИВЛ нельзя считать достаточно безопасным и полностью удовлетворяющим физиологические потребности организма в обеспечении адекватного дыхания пациентов с избыточной массой тела.
Таблица 4. Респираторные показатели пациентов с ожирением (n=53) на протяжении операции при разных режимах ИВЛ (M±SD).
| Режим ИВЛ | Этапы | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Концентрация углекислого газа на выдохе (EtCO₂), мм рт. ст. | |||||
| VCV | 34,4±3,2 | 37,3±1,8 | 40,2±1,8 | 42,3±2,6 | 44,3±2,4 |
| PCV | 33,6±2,5 | 34,4±1,4 | 42,1±2,3 | 41,5±2,9 | 43,3±1,6 |
| PCV-IRV | 32,7±1,6 | 33,8±0,8 | 41,6±1,7 | 42,1±2,1 | 42,6±1,4 |
| Частота дыхания (ЧД), мин⁻¹ | |||||
| VCV | 12,6±0,5 | 14,0±1,2 | 15,0±1,1 | 16,4±1,3 | 16,2±1,6 |
| PCV | 12,1±2,3 | 13,5±0,8 | 16,3±1,3 | 17,0±2,2 | 16,2±0,8 |
| PCV-IRV | 13,7±1,8 | 13,1±1,3 | 16,2±2,2 | 16,3±3,3 | 15,2±0,8 |
| Дыхательный объем (ДО), мл | |||||
| VCV | 610,8±9,1 | 600,3±13,4 | 605,9±21,5 | 565,7±23,4 | 629,1±34,3 |
| PCV | 600,7±18,4 | 580,7±31,8 | 608,7±24,5 | 595,9±29,1 | 646,3±26,4 |
| PCV-IRV | 616,5±27,7 | 591,7±39,2 | 589,5±45,1 | 596,2±47,3 | 637,7±37,9 |
| Пиковое давление дыхательных путей (Ppeak), см вод. ст. | |||||
| VCV | 16,3±2,2 | 31,1±2,1 | 37,0±4,5 | 38,2±3,1 | 16,7±4,2 |
| PCV | 15,2±1,1 | 33,5±1,1 | 32,2±2,1 | 33,7±2,1 | 16,5±3,0 |
| PCV-IRV | 14,4±1,1 | 30,2±1,3 | 30,5±2,1 | 31,7±3,1 | 15,5±3,0 |
| Среднее давление дыхательных путей (Pmean), см вод. ст. | |||||
| VCV | 11,1±2,1 | 18,4±2,1 | 22,6±3,3 | 23,2±4,3 | 10,2±5,1 |
| PCV | 10,4±2,3 | 21,1±3,3 | 22,4±2,4 | 23,5±3,1 | 9,7±3,4 |
| PCV-IRV | 11,4±1,2 | 22,1±4,4 | 19,8±1,5 | 21,7±4,1 | 11,1±3,4 |
| Насыщение крови кислородом (SpO₂), % | |||||
| VCV | 96,8±1,2 | 94,7±1,1 | 93,7±2,0 | 93,8±1,4 | 96,9±2,1 |
| PCV | 96,8±1,1 | 95,7±2,5 | 96,8±3,6 | 96,7±2,2 | 97,5±1,3 |
| PCV-IRV | 96,4±1,1 | 96,5±1,2 | 96,4±1,2 | 97,6±3,7 | 97,8±3,1 |
Примечание. Значения p для попарных сравнений респираторных показателей на различных этапах операции указаны в табл. 6 и 7.
Режим ИВЛ с управляемым давлением у пациентов с ожирением отвечал критериям адекватности и безопасности (максимальное значение P peak на 4 этапе исследования составило 33,7±2,10 см вод. ст., минимальное зафиксированное значение SpO₂ — 95,7±2,2%), однако необходимо помнить, что после окончания хирургического этапа операции в целях полной элиминации накопившейся углекислоты, не следует торопиться с ранней экстубацией трахеи и переводом на самостоятельное дыхание. В сравнении с обычным режимом вентиляции PCV, режим PCV с обратным соотношением вдоха к выдоху у пациентов с избыточной массой тела позволял получить меньшие значения пикового давления (максимальное значение P peak на 4 этапе исследования составило 31,7±3,1 см вод. ст.), а, значит, и уменьшал вероятность развития баротравмы, при этом показатели оксигенации крови оставались не ниже, а на 2 и 4 этапах операции значения SpO₂ были даже выше. Средняя длительность нахождения стационаре для пациентов обеих групп статистически не отличалась и составляла 7±1 сут.
Заключение
У пациентов без ожирения выбор какоголибо конкретного режима ИВЛ не имеет решающего значения в достижении безопасности и эффективности анестезиологического обеспечения РРП. Оптимальным методом ИВЛ при проведении анестезии РРП у пациентов с ИМТ ≥30 можно считать вентиляцию с управляемым давлением и ее вариант с инверсией вдоха-выдоха с соотношением вдох/выдох 1,5:1.
Приложение
Таблица 5. Значения p-value для попарных сравнений респираторных показателей на различных этапах операции у пациентов с нормальным индексом массы тела (n=88) при разных режимах ИВЛ (M±SD).
| Режим ИВЛ | Этапы | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1-2 | 1-3 | 1-4 | 1-5 | 2-3 | 2-4 | 2-5 | 3-4 | 3-5 | 4-5 | |
| Концентрация углекислого газа на выдохе (EtCO2), мм рт. ст. | ||||||||||
| VCV | 0,06 | <0,001 | <0,001 | <0,001 | 0,08 | 0,02 | 0,01 | 0,41 | 0,14 | 0,21 |
| PCV | 0,37 | 0,03 | 0,004 | <0,001 | 0,19 | 0,12 | 0,04 | 0,84 | 0,02 | 0,03 |
| PCV-IRV | 0,19 | 0,05 | 0,06 | <0,001 | 0,74 | 0,17 | 0,09 | 0,34 | 0,03 | <0,001 |
| Частота дыхания (ЧД), мин-1 | ||||||||||
| VCV | 0,11 | <0,001 | <0,001 | <0,001 | <0,001 | 0,01 | <0,001 | 0,52 | 0,06 | 0,01 |
| PCV | 0,02 | <0,001 | <0,001 | <0,001 | 0,002 | 0,001 | <0,001 | 0,89 | 0,03 | 0,003 |
| PCV-IRV | 0,06 | <0,001 | <0,001 | <0,001 | 0,03 | <0,001 | <0,001 | 0,26 | 0,02 | 0,83 |
| Дыхательный объем (ДО), мл | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | <0,001 | 0,83 | 0,02 | <0,001 | <0,001 | <0,001 | <0,001 |
| PCV | 0,43 | 0,02 | <0,001 | <0,001 | <0,001 | 0,001 | <0,001 | <0,001 | <0,001 | <0,001 |
| PCV-IRV | 0,02 | <0,001 | <0,001 | <0,001 | <0,001 | 0,001 | <0,001 | 0,71 | <0,001 | <0,001 |
| Пиковое давление дыхательных путей (Ppeak), см вод. ст. | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | 0,89 | <0,001 | <0,001 | <0,001 | 0,34 | <0,001 | <0,001 |
| PCV | <0,001 | <0,001 | <0,001 | 0,98 | 0,06 | <0,001 | <0,001 | 0,42 | <0,001 | <0,001 |
| PCV-IRV | 0,003 | <0,001 | <0,001 | 0,71 | <0,001 | <0,001 | <0,001 | 0,12 | <0,001 | <0,001 |
| Среднее давление дыхательных путей (Pmean), см вод. ст. | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | 0,13 | 0,01 | <0,001 | <0,001 | 0,5 | <0,001 | <0,001 |
| PCV | <0,001 | <0,001 | <0,001 | 0,87 | 0,004 | 0,01 | <0,001 | 0,83 | <0,001 | 0,047 |
| PCV-IRV | <0,001 | <0,001 | <0,001 | 0,58 | 0,01 | <0,001 | <0,001 | 0,34 | 0,003 | <0,001 |
| Насыщение крови кислородом (SpO2), % | ||||||||||
| VCV | <0,001 | 0,91 | 0,98 | <0,001 | 0,63 | 0,03 | <0,001 | 0,93 | <0,001 | <0,001 |
| PCV | <0,001 | 0,07 | 0,68 | <0,001 | <0,001 | 0,01 | <0,001 | 0,24 | <0,001 | <0,001 |
| PCV-IRV | 0,10 | 0,48 | 0,44 | 0,99 | 0,82 | 0,24 | 0,19 | 0,36 | 0,76 | 0,85 |
Таблица 6. Значения p-value для попарных сравнений респираторных показателей на различных этапах операции у пациентов с ожирением (n=53) при разных режимах ИВЛ (M±SD).
| Режим ИВЛ | Этапы | |||||||||
| 1-2 | 1-3 | 1-4 | 1-5 | 2-3 | 2-4 | 2-5 | 3-4 | 3-5 | 4-5 | |
| Концентрация углекислого газа на выдохе (EtCO2), мм рт. ст. | ||||||||||
| VCV | 0,002 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,001 | <0,001 | 0,01 | 0,21 |
| PCV | 0,4 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,2 | <0,001 | <0,001 | 0,03 |
| PCV-IRV | 0,17 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,62 | <0,001 | 0,5 | <0,001 |
| Частота дыхания (ЧД), мин-1 | ||||||||||
| VCV | 0,02 | <0,001 | <0,001 | <0,001 | 0,04 | <0,001 | <0,001 | 0,003 | 0,003 | 0,67 |
| PCV | 0,03 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,19 | <0,001 | 0,41 |
| PCV-IRV | 0,67 | 0,13 | 0,09 | 0,01 | 0,01 | 0,01 | 0,001 | 0,9 | 0,4 | 0,13 |
| Дыхательный объем (ДО), мл | ||||||||||
| VCV | 0,69 | 0,01 | 0,03 | 0,08 | 0,004 | 0,009 | 0,05 | 0,95 | 0,14 | 0,53 |
| PCV | 0,01 | 0,42 | 0,21 | <0,001 | 0,04 | 0,28 | <0,001 | 0,21 | <0,001 | <0,001 |
| PCV-IRV | 0,01 | 0,001 | 0,001 | <0,001 | 0,93 | 0,79 | <0,001 | 0,83 | <0,001 | <0,001 |
| Пиковое давление дыхательных путей (Ppeak), см вод. ст. | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | 0,98 | <0,001 | <0,001 | <0,001 | 0,79 | <0,001 | <0,001 |
| PCV | <0,001 | <0,001 | <0,001 | 0,78 | <0,001 | 0,53 | <0,001 | 0,2 | <0,001 | <0,001 |
| PCV-IRV | <0,001 | <0,001 | <0,001 | 0,99 | 0,4 | 0,001 | <0,001 | 0,13 | <0,001 | <0,001 |
| Среднее давление дыхательных путей (Pmean), см вод. ст. | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | 0,79 | <0,001 | <0,001 | <0,001 | 0,66 | <0,001 | <0,001 |
| PCV | <0,001 | <0,001 | <0,001 | 0,64 | 0,03 | <0,001 | <0,001 | 0,32 | <0,001 | <0,001 |
| PCV-IRV | <0,001 | 0,001 | <0,001 | 0,91 | 0,12 | 0,61 | <0,001 | 0,14 | <0,001 | 0,005 |
| Насыщение крови кислородом (SpO2), % | ||||||||||
| VCV | <0,001 | <0,001 | <0,001 | 0,84 | <0,001 | <0,001 | <0,001 | 0,88 | <0,001 | <0,001 |
| PCV | 0,09 | 0,7 | 0,18 | 0,34 | 0,79 | 0,98 | 0,03 | 0,69 | 0,19 | 0,07 |
| PCV-IRV | 0,96 | 0,99 | 0,48 | 0,61 | 0,98 | 0,06 | 0,26 | 0,19 | 0,34 | 0,96 |
Таблица 7. Значения p-value для попарных сравнений респираторных показателей при различных режимов ИВЛ на протяжении операции у пациентов нормальным индексом массы тела и ожирением.
| Режимы ИВЛ | С нормальным индексом массы тела (n=88) | С ожирением (n=53) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Этапы | Этапы | |||||||||
| 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 | |
| Концентрация углекислого газа на выдохе (EtCO2), мм рт. ст. | ||||||||||
| VCV-PCV | 0,74 | 0,71 | 0,53 | 0,72 | 0,83 | 0,53 | <0,001 | 0,05 | 0,40 | 0,32 |
| VCV-IRV | 0,39 | 0,67 | 0,08 | 0,70 | 0,63 | 0,20 | <0,001 | 0,005 | 0,94 | 0,09 |
| PCV-IRV | 0,68 | 0,88 | 0,42 | 0,79 | 0,76 | 0,27 | 0,14 | 0,45 | 0,60 | 0,04 |
| Частота дыхания (ЧД), мин-1 | ||||||||||
| VCV-PCV | 0,96 | 0,88 | 0,58 | 0,88 | 0,40 | 0,55 | 0,41 | 0,09 | 0,49 | 0,98 |
| VCV-IRV | 0,71 | 0,97 | 0,23 | 0,61 | 0,69 | 0,18 | 0,13 | 0,18 | 0,99 | 0,06 |
| PCV-IRV | 0,36 | 0,90 | 0,57 | 0,45 | 0,38 | 0,03 | 0,60 | 0,95 | 0,77 | 0,03 |
| Дыхательный объем (ДО), мл | ||||||||||
| VCV-PCV | 0,68 | 0,49 | 0,46 | 0,26 | <0,001 | 0,30 | 0,42 | 0,88 | 0,06 | 0,19 |
| VCV-IRV | 0,26 | 0,89 | 0,53 | 0,76 | 0,50 | 0,66 | 0,77 | 0,26 | 0,04 | 0,86 |
| PCV-IRV | 0,64 | 0,62 | 0,14 | 0,13 | 0,23 | 0,23 | 0,66 | 0,43 | 0,98 | 0,77 |
| Пиковое давление дыхательных путей (Ppeak), см вод. ст. | ||||||||||
| VCV-PCV | 0,92 | 0,27 | 0,66 | 0,56 | 0,67 | 0,43 | 0,04 | 0,03 | 0,003 | 0,88 |
| VCV-IRV | 0,37 | 0,18 | 0,55 | 0,37 | 0,36 | 0,07 | 0,65 | 0,001 | <0,001 | 0,57 |
| PCV-IRV | 0,16 | 0,80 | 0,96 | 0,84 | 0,90 | 0,28 | 0,001 | 0,36 | 0,18 | 0,64 |
| Среднее давление дыхательных путей (Pmean), см вод. ст. | ||||||||||
| VCV-PCV | 0,84 | 0,11 | 0,15 | 0,45 | 0,37 | 0,46 | 0,11 | 0,89 | 0,77 | 0,67 |
| VCV-IRV | 0,19 | 0,38 | 0,75 | 0,39 | 0,89 | 0,73 | 0,02 | 0,05 | 0,37 | 0,69 |
| PCV-IRV | 0,09 | 0,04 | 0,01 | 0,19 | 0,46 | 0,27 | 0,47 | 0,04 | 0,14 | 0,55 |
| Насыщение крови кислородом (SpO2), % | ||||||||||
| VCV-PCV | 0,32 | 0,88 | 0,60 | 0,46 | 0,26 | 0,99 | 0,36 | 0,03 | 0,25 | 0,52 |
| VCV-IRV | 0,05 | 0,47 | 0,96 | 0,002 | 0,88 | 0,72 | <0,001 | 0,02 | <0,001 | 0,35 |
| PCV-IRV | 0,05 | 0,19 | 0,88 | 0,003 | 0,19 | 0,53 | 0,14 | 0,93 | 0,01 | 0,83 |








