Новый метод задней реконструкции малого таза аутотканью при робот-ассистированной радикальной простатэктомии
Актуальность. Несмотря на совершенствование хирургических методик и значительное улучшение функциональных результатов оперативных вмешательств по поводу рака предстательной железы недержание мочи после радикальной простатэктомии остается наиболее важным фактором, отрицательно влияющим на качество жизни пациентов.
Цель — оценка эффективности и безопасности новой методики задней реконструкции малого таза с использованием аутоткани — лоскута внутритазовой фасции — при выполнении робот-ассистированной радикальной простатэктомии.
Материалы и методы. В исследование включены 28 пациентов с локализованным раком предстательной железы, которым проведена робот-ассистированная радикальная простатэктомия по модифицированной методике. Во время операции после удаления предстательной железы выполняли заднюю реконструкцию малого таза путем иссечения лоскута внутритазовой фасции с одной стороны, помещения его сзади шейки мочевого пузыря и уретроцистоанастомоза с последующей фиксацией данного лоскута к аналогичной структуре с противоположной стороны в форме петли, укрепляющей анастомоз сзади. Оценивали основные интраоперационные показатели, онкологические и функциональные результаты.
Результаты. Анализ результатов исследования подтвердил высокую эффективность предложенной хирургической методики. Средняя длительность операции составила 145 мин (120–170 мин), среднее консольное время — 68 мин (55–102 мин), средняя длительность этапа задней реконструкции — 6 мин (3,5–8,5 мин). Интраоперационная кровопотеря составила в среднем 55 мл (25–175 мл). У всех пациентов уретральный катетер был удален на 7-е сутки после операции. Во время оперативных вмешательств ни в одном случае не было конверсий и осложнений III–V групп по классификации Clavien – Dindo. Немедленное удержание мочи наблюдали у 23 (82,1 %) пациентов, раннее удержание мочи отмечали у 26 (92,8 %) пациентов.
Выводы. Результаты проведенного исследования показали, что применение новой техники задней реконструкции при робот-ассистированной радикальной простатэктомии при помощи лоскутов внутритазовой фасции является эффективным и безопасным, демонстрирует хорошие ранние функциональные результаты, в частности, немедленное удержание мочи, без ущерба онкологическим исходам. Ключевые слова: рак предстательной железы; робот-ассистированная радикальная простатэктомия; реконструкция малого таза; недержание мочи.
Актуальность
Рак предстательной железы (РПЖ) — одно из наиболее часто диагностируемых онкологических заболеваний у мужчин и пятая по значимости причина смерти от злокачественных новообразований [1–3]. Для большинства больных локализованным РПЖ радикальная простатэктомия (РПЭ) обеспечивает хорошие онкологические результаты [4]. В настоящее время результаты РПЭ оценивают по так называемой трифекте, которая включает в себя онкологический контроль, удержание мочи и эректильную функцию [5] и достигается только у 62–70 % пациентов [5, 6]. Несмотря на постоянное улучшение и совершенствование техники выполнения РПЭ, недержание мочи все еще остается основным фактором, влияющим на качество жизни у большинства мужчин после РПЭ [7, 8]. Через 12 мес. после операции недержание мочи отмечают в среднем у 16 % пациентов [9]. Робот-ассистированная радикальная простатэктомия (РАРП) демонстрирует лучшие показатели удержания мочи по сравнению с лапароскопическим и открытым методами при сопоставимых онкологических результатах [10–12]. Для улучшения функциональных результатов, в частности, немедленного и раннего удержания мочи, предлагаются различные модификации методики оперативного вмешательства. Перспективным представляется усовершенствование тех- ники операции, направленное на сохранение анатомических структур малого таза [13–15].
Цель исследования — оценка эффективности и без- опасности новой методики задней реконструкции с использованием аутоткани — лоскута внутритазовой фасции при выполнении РАРП.
Материалы и методы
В данное проспективное исследование были включены 28 пациентов с локализованным РПЖ, которым за период с апреля 2020 г. по январь 2021 г. была выполнена РАРП. Пациенты были проинформированы о проведении исследования и подписали соответствующие формы согласия. Все операции были выполнены одним опытным роботическим хирургом (опыт более 1000 робот-ассистированных вмешательств). Анамнестические данные у наблюдаемых пациентов были сопоставимы: средний возраст составил 65,5 лет (от 57 до 74), средний индекс массы тела — 26,3 кг/м2 (от 22,7 до 29,4), средний пре- доперационный уровень простатического специфического антигена — 7,6 нг/мл (5,4–13 нг/мл). Первичная (предоперационная) сумма баллов по шкале Глисона составляла в среднем 6,8 (от 6 до 9 баллов), в том числе сумма баллов 3 + 3 = 6 (группа 1 по классификации International Society of Uropatologists — ISUP 1) — у 12 (42,9%) человек, 3+4=7 (ISUP 2) — у 8 (28,6%), 3+4=7 (ISUP 3) — у 5 (17,8%), сумма баллов по шкале Глисона ≥8 (ISUP 4, 5) — у 3 (10,7 %) пациентов.
Средний объем предстательной железы составлял 46,5 см3 (от 23 до 96 см3). Средняя сумма баллов по опроснику IPSS (International Prostate Symptom Score) составляла 8,3 балла (от 3 до 17 баллов), по опрос- нику IIEF-5 (International Index of Erectile Function) — 20,5 баллов (от 15 до 24 баллов). Распределение пациентов по клиническим стадиям cT: сT1c — 5 (17,8 %) пациентов, cT2a — 8 (28,6 %), cT2b — 7 (25 %), cT2c — 8 (28,6 %) человек. Все оперативные вмешательства были выполнены трансперитонеальным доступом с использованием анатомо-сберегающей техники, заключающейся в сохранении внутритазовой фасции, пубопростатических связок и ректоуретральных мышц. Средний период наблюдения составил 6,5 мес. (минимальный — 3 мес., максимальный — 11 мес.). В настоящем исследовании оценивали периоперационные показатели (длительность операции, консольное время, длительность этапа задней реконструкции, объем интраоперационной кровопотери), длительность госпитализации (послеоперационный койко-день), продолжительность нахождения уретрального катетера, оценивали периоперационные осложнения по классификации Clavien – Dindo, основные онкологические результаты (сумма баллов по Глисону и стадия pT по данным патогистологического исследования операционного материала, положительный хирургический край, биохимический рецидив), а также показатели удержания мочи. Немедленное удержание мочи определяли как отсутствие подтекания мочи в первые сутки после удаления уретрального катетера на основании субъективной оценки пациента, подтвержденное результатами кашлевой пробы; раннее удержание мочи определяли как отсутствие подтекания мочи в покое, а также при кашле, смехе, физической нагрузке, ходьбе и другой физической активности, подтвержденное результатами анкетирования с использованием опросника по оценке качества жизни больных РПЖ EPIC-26 Short Form (Expanded Prostate Cancer Index Composite — 26) не позже 3 мес. после операции. Отсутствие удержания мочи определяли как наличие подтекания мочи при кашле, смехе, физической нагрузке и/или другой физической активности, кашлевой пробе, указание на недержание мочи по данным опросника EPIC-26 Short Form, а также необходимость использования более одной урологической прокладки в день.
Описание методики операции
После осуществления доступа в предпузырное (ретциево) пространство выделяют вентральную поверхность предстательной железы и мочевого пузыря, при этом не вскрывают внутритазовую фасцию и не пересекают пубопростатические связки. Следующим этапом производят отсечение предстательной железы от шейки мочевого пузыря, после чего выделяют заднюю поверхность предстательной железы, семенных пузырьков и семявыносящих протоков. Семявыносящие протоки коагулируют проксимально и пересекают, семенные пузырьки выделяют полностью. Предстательную железу выделяют от окружающих тканей вдоль ее собственной капсулы (псевдокапсулы) с задней (дорзальной) и боковых поверхностей с сохранением фасции Денонвилье. Сосудистые ножки предстательной железы клипируют и пересекают. Затем производят дальнейшую диссекцию латеральных поверхностей простаты с сохранением сосудисто-нервных пучков. Далее выполняют апикальную диссекцию, в ходе которой при выраженной геморрагии возможна перевязка дорзального сосудистого комплекса для минимизации кровопотери. Затем предстательную железу отсекают от уретры и погружают в специальный лапароскопический эвакуатор. После тщательного гемостаза ложа удаленной предстательной железы выполняют заднюю реконструкцию малого таза с использованием надсеченного лоскута внутритазовой фасции с одной стороны и расположения его сзади шейки мочевого пузыря с последующей фиксацией данного лоскута рассасывающимся шовным материалом к аналогичной структуре с противоположной стороны [16]. Следующим этапом на катетере Фолея 18 Ch формируют мочепузырно-уретральный анастомоз непрерывным швом с использованием рассасывающегося шовного материала. Таким образом, сформированная петля из лоскутов внутритазовой фасции укрепляет анастомоз сзади по типу слинга, минимизируя вероятность заднего пролапса мочевого пузыря и стрессового неудержания мочи в послеооперационном периоде. Уретральный катетер заменяют на аналогичный, производят контроль герметичности анастомоза путем введения по катетеру в мочевой пузырь 100 мл физиологического раствора. В малый таз к зоне мочепузырно-уретрального анастомоза подводят силиконовую дренажную трубку. Основные этапы реконструкции показаны на рис. 1–3.
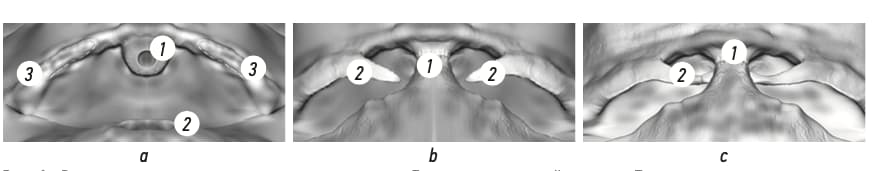 Рис. 1. Реконструкция основных этапов операции. а — Ложе предстательной железы. Предстательная железа удалена.
1 — уретра, 2 — шейка мочевого пузыря, 3 — внутритазовая фасция. Пунктиром с двух сторон отмечена линия резекции вну- тритазовой фасции, из которой будет сформирован лоскут; b — уретроцистоанастомоз (1), с двух сторон сформированы лоскуты из внутритазовой фасции (2); c — лоскут внутритазовой фасции (2) проведен под уретроцистоанастомозом (а), фиксирован к ана- логичному лоскуту внутритазовой фасции с противоположной стороны в виде петли, укрепляющей уретроцистоанастомоз сзади
Fig. 1. Reconstruction of the main stages of the operation. а – The prostate bed. The prostate gland has been removed. 1 – urethra,
2 – bladder neck, 3 – intrapelvic fascia. The dotted line on both sides marks the line of resection of the intrapelvic fascia, from which the flap will be formed; b – urethrocystoanastomosis (1), flaps from the intrapelvic fascia are formed on both sides (2); c – a flap of the intrapelvic fascia (2) was passed under the urethrocystoanastomosis (1), fixed to a similar flap of the intrapelvic fascia on the opposite side in the form of a loop reinforcing the urethrocystoanastomosis from behind
Рис. 1. Реконструкция основных этапов операции. а — Ложе предстательной железы. Предстательная железа удалена.
1 — уретра, 2 — шейка мочевого пузыря, 3 — внутритазовая фасция. Пунктиром с двух сторон отмечена линия резекции вну- тритазовой фасции, из которой будет сформирован лоскут; b — уретроцистоанастомоз (1), с двух сторон сформированы лоскуты из внутритазовой фасции (2); c — лоскут внутритазовой фасции (2) проведен под уретроцистоанастомозом (а), фиксирован к ана- логичному лоскуту внутритазовой фасции с противоположной стороны в виде петли, укрепляющей уретроцистоанастомоз сзади
Fig. 1. Reconstruction of the main stages of the operation. а – The prostate bed. The prostate gland has been removed. 1 – urethra,
2 – bladder neck, 3 – intrapelvic fascia. The dotted line on both sides marks the line of resection of the intrapelvic fascia, from which the flap will be formed; b – urethrocystoanastomosis (1), flaps from the intrapelvic fascia are formed on both sides (2); c – a flap of the intrapelvic fascia (2) was passed under the urethrocystoanastomosis (1), fixed to a similar flap of the intrapelvic fascia on the opposite side in the form of a loop reinforcing the urethrocystoanastomosis from behind
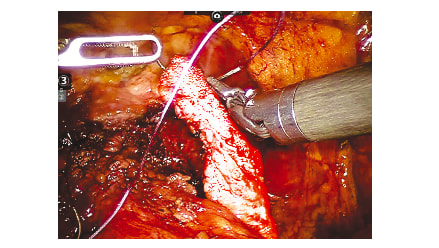 Рис. 2. Этап операции. Прошивание сформированного лоскута из внутритазовой фасции справа рассасывающимся шовным материалом Fig. 2. Sewing of the formed flap from the intrapelvic fascia on the right with absorbable suture material
Рис. 2. Этап операции. Прошивание сформированного лоскута из внутритазовой фасции справа рассасывающимся шовным материалом Fig. 2. Sewing of the formed flap from the intrapelvic fascia on the right with absorbable suture material
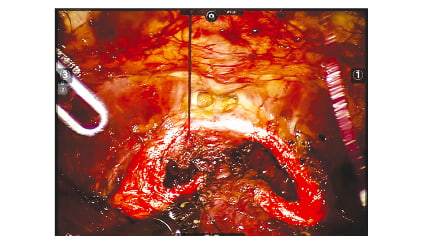 Рис. 3. Этап операции. Лоскут внутритазовой фасции проведен под уретроцистоанстомозом, выполнена фиксация лоскута к ана- логичной структуре с противоположной стороны в виде петли Fig. 3. A flap of the intrapelvic fascia was placed under urethro- cystostomosis, the flap was fixed to a similar structure from the opposite side in the form of a loop
Рис. 3. Этап операции. Лоскут внутритазовой фасции проведен под уретроцистоанстомозом, выполнена фиксация лоскута к ана- логичной структуре с противоположной стороны в виде петли Fig. 3. A flap of the intrapelvic fascia was placed under urethro- cystostomosis, the flap was fixed to a similar structure from the opposite side in the form of a loop
Результаты
Анализ результатов исследования подтвердил высокую эффективность предложенной хирургической методики. Основные периоперационные показатели представлены в табл. 1. Среднее консольное время составило 68 мин, а средняя длительность этапа задней реконструкции оказалась равной 6 мин. Оперативное вмешательство сопровождалось низкой кровопотерей, в среднем составившей 55 мл. У всех оперированных пациентов длительность госпитализации составила 4 койко-дня, включая один предоперационный койко-день и одни сутки в реанимационном отделении в день операции. На третьи сутки послеоперационного периода всех пациентов выписывали для наблюдения в условиях дневного стационара, где они находились еще 5 дней до удаления уретрального катетера и в течение одних суток после его удаления. Во всех случаях уретральный катетер был удален на 7-е сутки после операции. Во время оперативных вмешательств ни в одном случае не было конверсий и осложнений III–V групп по классификации Clavien – Dindo.
По данным патогистологического исследования операционного материала средняя сумма баллов по шкале Глисона составила 7,2, до операции средняя величина данного показателя по результатам исследования биоптатов предстательной железы была несколько меньше — 6,8 балла. Миграция суммы баллов по шкале Глисона отмечалась в 46,4 % случаев. Миграция стадии Т — в 28,6 % случаев. Положительный хирургический край был выявлен в одном случае и связан с миграцией стадии заболевания, при этом не было выявлено ни одного случая ятрогенного положительного края. За период наблюдения не зафиксировано ни одного случая возникновения биохимического рецидива. Основные онкологические показатели оперированных пациентов представлены в табл. 2. В послеоперационном периоде немедленное удержание мочи отмечали у 23 (82,1 %) оперированных пациентов, раннее удержание мочи — у 26 (92,8 %). У остальных пациентов сохранялось подтекание мочи при физических нагрузках, кашле, смехе, в связи с чем они использовали более одной урологической прокладки в день, при этом свое качество жизни они оценивали как «хорошее».
Таблица 1. Основные периоперационные показатели пациентов после робот-ассистированной радикальной простатэктомиии (n = 28) /Table 1. Main perioperative parameters of patients after robot-assisted radical prostatectomy (n = 28)
| Показатель | Значение |
| Длительность операции, мин (мин.–макс.) | 145 (120–170) |
| Консольное время, мин (мин.–макс.) | 68 (55–102) |
| Длительность этапа задней реконструкции, мин (мин.–макс.) | 6 (3,5–8,5) |
| Объем интраоперационной кровопотери, мл (мин.–макс.) | 55 (25–175) |
| Длительность госпитализации, койко-дни | 4 (во всех случаях) |
| Длительность реабилитации в условиях дневного стационара, сут | 5 (во всех случаях) |
| Удаление уретрального катетера после операции, сут | 7 (во всех случаях) |
| Периоперационные осложнения по классификации Clavien – Dindo, n (%) | |
| I группа | 7 (25,0) |
| II группа | 2 (7,1) |
| III–V группы | 0 |
Таблица 2. Основные онкологические показатели оперированных пациентов с раком предстательной железы (n = 28) /Table 2. Main oncological indicators of operated patients with prostate cancer (n = 28)
| Показатель | Значение |
| Сумма баллов по шкале Глисона, (мин.–макс.) в том числе, n (%): | 7,2 (6–9) |
| 6 | 6 (21,4) |
| 7 (3+4) | 7 (25,0) |
| 7 (4+3) | 8 (28,6) |
| 8 | 5 (17,9) |
| 9 | 2 (7,1) |
| Патологическая стадия T (pT), n (%): | |
| pT2 | 25 (89,3) |
| pT3a | 2 (7,1) |
| pT3b | 1 (3,6) |
| Положительный хирургический край, n (%): | 1 (3,6) |
| Биохимический рецидив | 0 |
Обсуждение
Наиболее известные технические модификации, направленные на улучшение удержания мочи, следующие: задняя реконструкция — шов Rocco [17], периуретральная суспензия — шов Patel [18], комбинация передней суспензии и задней реконструкции [19], расширенная реконструкция фиксирующего аппарата мочевого пузыря и уретры (Advanced Reconstruction of VesicoUrethral Support — ARVUS) [20], тотальная анатомическая реконструкция [21], сохранение достаточной длины уретры [22], также сохранение шейки мочевого пузыря [23]. Одним из наиболее часто использующихся методов задней реконструкции при РАРП является шов Rocco — реконструкция фасции Денонвилье посредством непрерывного шва в поперечном направлении. Данный метод, на наш взгляд, достаточно травматичный, ввиду наличия риска повреждения прямой кишки в ходе прошивания фасции Денонвилье. В сравнении с известными ранее методиками представленный нами способ задней реконструкции малого таза представляется не менее эффективным в отношении ранних результатов удержания мочи, в том числе немедленного ее удержания, при этом риск травматизации прямой кишки отсутствует. Не было отмечено статистически значимого увеличения длительности вмешательства в связи с проведением реконструкции. Предложенный нами метод предполагает использование анатомо-сберегающей техники, достаточно прост для выполнения, поскольку используются собственные ткани, а не синтетические материалы, и не увеличивает риск возникновения периоперационных осложнений.
Вывод
Результаты проведенного исследования показали, что новая техника задней реконструкции при робот-ассистированной радикальной простатэктомии при помощи лоскутов внутритазовой фасции эффективна, безопасна и демонстрирует хорошие ранние функциональные результаты, в частности, немедленное удержание мочи, без ущерба онкологическим исходам. Описанную методику, по нашему мнению, целесообразно использовать в качестве альтернативы шву Rocco при проведении задней реконструкции малого таза. Для подтверждения эффективности данного метода должны быть проведены дальнейшие исследования, в том числе сравнительные, с большими когортами, а также с более длительным периодом наблюдения.
Дополнительная информация
Вклад авторов. Все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.








