Новый метод передней реконструкции структур малого таза при робот-ассистированной радикальной простатэктомии для улучшения раннего удержания мочи
Аннотация
Введение. Рак предстательной железы — одно из частых онкологических заболеваний у мужчин. Робот-ассистированная методика лечения данного заболевания связана с лучшими показателями удержания мочи по сравнению с лапароскопической и открытой техникой, при сопоставимых онкологических результатах. При этом инконтиненция остается значимым осложнением после операции.
Цель: представить новую методику передней реконструкции малого таза при робот-ассистированной радикальной простатэктомии, оценить ее эффективность и безопасность.
Материалы и методы. В исследование включено 50 пациентов с локализованным раком предстательной железы, которым в период с ноября 2020 года по июнь 2021 выполнена робот-ассистированная радикальная простатэктомия в одной клинике. Все операции выполнены трансперитонеально с использованием анатомо-сберегающей техники, выполнялась передняя реконструкция малого таза с использованием внутритазовой фасции. Оценивались основные периоперационные показатели, ранние онкологические и функциональные результаты, а также удержание мочи (на основании данных анкетирования).
Результаты. Средняя длительность операции составила 140 мин (110–170 мин), консольное время – 72,5 мин (45–100 мин), длительность этапа реконструкции – 5,25 мин (3,0 – 7,5). Средняя кровопотеря была 50 мл (15–75). Осложнений III-V степени по классификации Clavien- Dindo не было. Немедленное удержание мочи было отмечено у 74% пациентов, через месяц после операции – у 93%.
Выводы. Новый метод роботической радикальной простатэктомии с передней реконструкцией структур малого таза – безопасен и эффективен, не повышает риск осложнений и не влияет на онкологический исход, при этом ранние функциональные результаты являются многообещающими.
Введение
Рак предстательной железы (РПЖ) — одно из наиболее часто диагностируемых онкологических заболеваний у мужчин и занимает 5 место среди причин смерти от рака во всем мире [1-3]. На сегодняшний день общепризнанной хирургической методикой лечения локализованного РПЖ является радикальная простатэктомия (РПЭ), которую возможно выполнить открытым, лапароскопическим или робот-ассистированным доступом. Робот-ассистированная радикальная простатэктомия продолжает набирать популярность, так как она связана с меньшей интраоперационной кровопотерей и более низкими сроками госпитализации [4]. В настоящее время результаты радикальной простатэктомии оценивают по так называемой «трифекте» (3 основных фактора), которая включает в себя онкологический контроль, удержание мочи и эректильную функцию [5]. Несмотря на множество преимуществ перед традиционным хирургическим способом и лапароскопическим методом хирургического лечения рака предстательной железы актуальным остается вопрос о удержании мочи [6]. Инконтиненция остается неприятным осложнением после радикальной простатэктомии с частотой встречаемости от 2,5% до 69% [7-9]. В среднем 16% мужчин страдают недержанием мочи через 12 месяцев после операции (используя определение «без прокладок») [10]. В последнее время появляются новые хирургические методики, направленные на улучшение функциональных исходов робот-ассистированной радикальной простатэктомии, в особенности, сохранение удержания мочи, поскольку данная проблема имеет важное медицинское и социально-экономическое значение.
Материалы и методы
В наше исследование было включено 50 пациентов с локализованным раком предстательной железы, которые в период с ноября 2020 года по до июня 2021 года перенесли робот-ассистированную радикальную простатэктомию (РАРП) в одном медицинском центре. Все операции были выполнены одним опытным роботическим хирургом (опыт более 1000 роботических простатэктомий) с использованием трансперитонеального доступа и применением анатомо-сберегающей техники, которая подразумевала сохранение внутритазовой фасции, пубопростатических связок, ректоуретральных мышц и фасции Денонвилье. Во всех случаях после наложения уретровезивального анастомоза выполнялась передняя реконструкция с использованием внутритазовой фасции по оригинальной методике (патент РФ No2716463, рис. 1). Всеми пациентами перед включением в исследование были подписаны соответствующие формы информированного добровольного согласия на участие в нем.
 Рис. 1. Патент РФ No2716463 «Способ проведения робот-ассистированной лапароскопической радикальной простатэктомии с передней реконструкцией малого таза при лечении рака предстательной железы»/ Fig. 1. Patent of Russian Federation No. 2716463 «Method of performing robot- assisted laparoscopic radical prostatectomy with anterior reconstruction of the true pelvis in the treatment of prostate cancer»
Рис. 1. Патент РФ No2716463 «Способ проведения робот-ассистированной лапароскопической радикальной простатэктомии с передней реконструкцией малого таза при лечении рака предстательной железы»/ Fig. 1. Patent of Russian Federation No. 2716463 «Method of performing robot- assisted laparoscopic radical prostatectomy with anterior reconstruction of the true pelvis in the treatment of prostate cancer»
В процессе исследования были оценены основные периоперационные показатели, а также ранние онкологические и функциональные результаты. Оценка результатов немедленного (в течение 1 суток после удаления катетера) и раннего удержания мочи (в течение 3 месяцев после операции) осуществлялась на основании данных анкетирования.
Хирургическая техника
Операция выполняется с использованием роботической хирургической системы da Vinci под эндотрахеальным наркозом. Пациент укладывается на спину и производится лапароцентез в верхней, либо нижней параумбиликальной точке. Через данный доступ вводится оптический троакар и создается карбоксиперитонеум, затем слева и справа от срединной линии по стандартной методике вводятся 3 рабочих троакара da Vinci, а также ассистентский порт латерально. Во время операции пациент располагается в положении Тренделенбурга, как минимум 30° (с опущенным краниальным и приподнятым каудальным концом). Вскрывается передняя стенка париетальной брюшины ниже пупка и осуществляется доступ в предпузырное (Ретциево) пространство. Выделяется вентральная поверхность предстательной железы и мочевого пузыря, при этом не вскрывается внутритазовая фасция и не пересекаются пубопростатические связки. Следующим этапом производится отсечение предстательной железы от шейки мочевого пузыря, после чего следует этап выделения задней поверхности предстательной железы, семенных пузырьков и семявыносящих протоков. Семявыносящие протоки коагулируются и пересекаются, семенные пузырьки выделяются полностью. Предстательную железу выделяют от окружающих тканей вдоль ее собственной капсулы (псевдокапсулы) с задней (дорзальной) и боковых поверхностей, с сохранением фасции Денонвилье. Сосудистые ножки предстательной железы клипируются и пересекаются у основания. Затем производится дальнейшая диссекция латеральных поверхностей предстательной железы, с сохранением (либо без сохранения) сосудисто-нервных пучков.
Следующим этапом выполняется апикальная диссекция, в ходе которой при выраженном кровотечении возможна перевязка дорзального сосудистого ком- плекса, что позволяет минимизировать кровопотерю на данном этапе. Затем предстательная железа отсекается от уретры и погружается в специальный лапа- роскопический эвакуатор. После тщательного гемостаза ложа удаленной предстательной железы на катетере Фолея 18 Ch непрерывным швом формируют уретроцистоанастомоз с использованием рассасывающегося шовного материала. Далее уретральный катетер заменяют на аналогичный, после чего производится контроль герметичности уретроцистоанастомоза путем введения по катетеру в мочевой пузырь 100 мл физиологического раствора. Следующим этапом выполняют собственно переднюю реконструкцию малого таза путем фиксации передней стенки мочевого пузыря по его контуру к внутритазовой фасции спереди и латерально непрерывным швом с использованием рассасывающегося шовного материала (рис. 2-4). На завершающем этапе в малый таз к зоне уретроцистоанастомоза устанавливается дренаж.
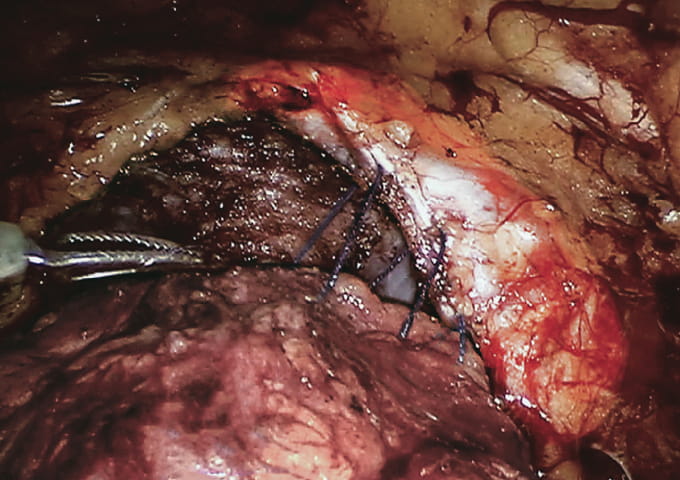 Рис. 2. Начальный этап передней реконструкции: передняя стенка мочевого пузыря справа подшивается к внутритазовой фасции и пубо-простатическим связкам/ Fig. 2. The initial stage of the anterior reconstruction: the anterior wall of the bladder on the right is sutured to the endopelvic fascia and puboprostatic ligaments
Рис. 2. Начальный этап передней реконструкции: передняя стенка мочевого пузыря справа подшивается к внутритазовой фасции и пубо-простатическим связкам/ Fig. 2. The initial stage of the anterior reconstruction: the anterior wall of the bladder on the right is sutured to the endopelvic fascia and puboprostatic ligaments
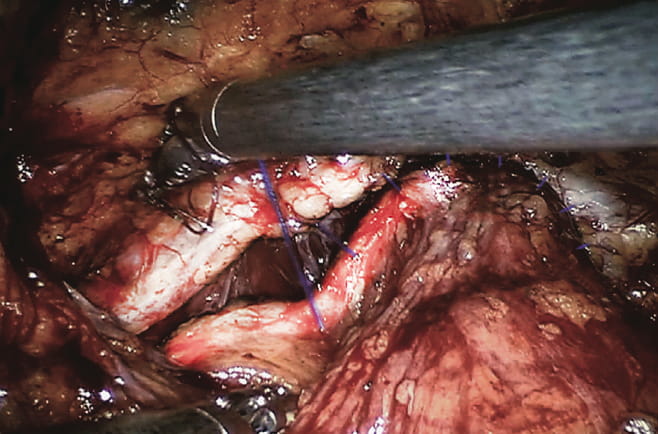 Рис. 3. Передняя стенка мочевого пузыря слева фиксируется к внутритазовой фасции и пубо-простатическим связкам слева Fig. 3. The anterior wall of the bladder on the left is fixed to the endopelvic fascia and pubo-prostatic ligaments on the left
Рис. 3. Передняя стенка мочевого пузыря слева фиксируется к внутритазовой фасции и пубо-простатическим связкам слева Fig. 3. The anterior wall of the bladder on the left is fixed to the endopelvic fascia and pubo-prostatic ligaments on the left
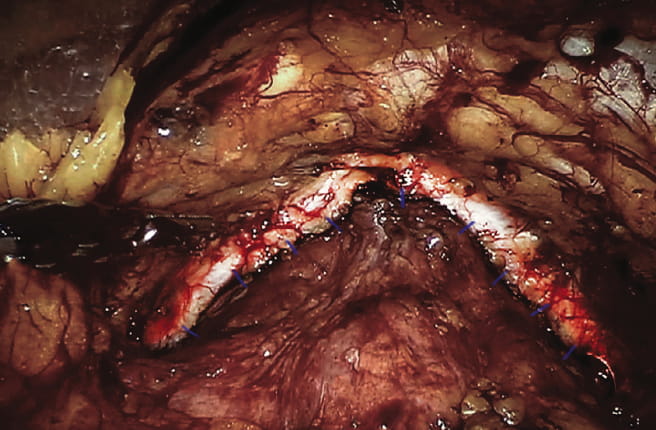 Рис. 4. Конечный вид малого таза — передняя реконструкция завершена/ Fig. 4. The final view of true pelvis — the anterior reconstruction is finished
Рис. 4. Конечный вид малого таза — передняя реконструкция завершена/ Fig. 4. The final view of true pelvis — the anterior reconstruction is finished
Нами оценивались периоперационные показатели, такие как длительность операции (включая консольное время и длительность выполнения реконструкции), объем интраоперационной кровопотери, длительность госпитализации (послеоперационный койко-день), длительность катетеризации мочевого пузыря, периоперационные осложнения по классификации Clavien-Dindo, основные онкологические результаты (стадия pT, положительный хирургический край и т.д.), а также немедленное (первый день после удаления уретрального катетера) и раннее (через 3 месяца после операции) удержание мочи. Способность к удержанию мочи оценивалась с помощью международного опросника EPIC-26 short form. Полное удержание мочи было определено как отсутствие ее подтекания при кашле, смехе, физической нагрузке, ходьбе, а также в покое, а также отсутствие необходимости использования более одной в день «страховочной» урологической прокладки.
Результаты
У всех пациентов предоперационные показатели (возраст, индекс массы тела (ИМТ), уровень ПСА, сумма баллов по Глисону, объем предстательной железы, стадия cT, сумма баллов по шкале IPSS и IIEF-5) были сопоставимы (табл. 1).
Таблица 1. Характеристики пациентов до оперативного вмешательства/ Table 1. Preoperative patients features
| Характеристики пациентов/ Patients features |
Среднее значение/ Mean |
| Возраст, лет/ Age, years | 66 (51-78) |
| ИМТ, кг/м2/ BMI, kg/m2 | 26,2 (20,1-32,3) |
| ПСА, нг/мл/ PSA, ng/ml | 8,9 (4,8-23,4) |
| Сумма баллов по Глисону/ Gleason score | 6,8 (6-9) |
| Сумма Глисона / прогностическая группа, n (%)/ Gleason score / ISUP group, n (%) | |
| 6 / ISUP 1 |
16 (32) |
| 7 (3+4) / ISUP 2 |
11 (22) |
| 7 (4+3) / ISUP 3 | 13 (26) |
| 8 / ISUP 4 | 8 (16) |
| 9,10 / ISUP 5 | 2 (4) |
| Клиническая стадия T (cT), n (%)/ Clinical stage T (cT), n (%) | |
| cT1c | 8 (16) |
| cT2a | 12 (24) |
| cT2b | 14 (26) |
| cT2c | 16 (32) |
| Объем предстательной железы, см3/ Prostate volume, cm3 | 43 (18-83) |
| Сумма баллов по шкале IPSS | 9 (3-17) |
| Сумма баллов по шкале IIEF-5 | 18 (12-25) |
ИМТ – индекс массы тела, ПСА – простат-специфический антиген, ISUP – международная ассоциация уропатологов, IPSS – международная шкала симптомов предстательной железы, IIEF-5 – Международный индекс эректильной функции/ BMI – body mass index, PSA – prostatic specific antigen, ISUP – international society of urological pathologists, IPSS – International Prostate Symptoms Score, IIEF-5 – International index of erectile functions
Средняя длительность операции составила 140 мин (110–170 мин), из которых среднее консольное время – 72,5 мин (45–100 мин), длительность этапа передней реконструкции 5,25 мин (3,0–7,5 мин). Средний объем интраоперационной кровопотери составил 50 мл (15–75 мл). Во всех случаях длительность госпитализации составила 4 койко-дня. После выписки пациенты проходили восстанови- тельное лечение в условиях дневного стационара, в течение 5 койко-дней (до удаления мочевого катетера, а также в течение суток после его удаления). Во всех случаях уретральный катетер был удален на 7-е сутки послеоперационного периода. Немедленное удержание мочи было отмечено у 74% пациентов, через месяц после операции удержание мочи отмечалось у 93% пациентов. Не было зафиксировано осложнений III-V групп по Clavien-Dindo (табл. 2). Миграция суммы баллов по Глисону наблюдалась в 36% (18 случаев), стадии заболевания — в 28% случаев (14 случаев).
Таблица 2. Периоперационные показатели/ Table 2. Perioperative features
| Показатель/ Feature |
Среднее значение/ Mean |
| Длительность операции, мин/ Duration of surgery, min | 140 (110-170) |
| Консольное время, мин/ Console time, min | 72,5 (45-100) |
| Время передней реконструкции, мин/ Duration of lateral reconstruction, min | 5,25 (3,0-7,5) |
| Кровопотеря, мл/ Blood loss, ml 50 | (15-75) |
| Периоперационные осложнения, n (%)/ Perioperative complications, n (%) | |
| Clavien I | 12 (24) |
| Clavien II | 4 (8) |
| Clavien III | 0 (0) |
| Clavien IV | 0 (0) |
| Clavien V | 0 (0) |
| Предоперационный койко-день, койко-дни/ Preoperative length of stay, days | 1 (100) |
| Послеоперационный койко-день (ОРИТ+стационар), койко-дни/ Postoperative length of stay (ICU+hospital), days | 4 (100) |
| Длительность реабилитации (в условиях дневного стационара), дн./ Duration of reabilitation (in hospital), days | 5 (100) |
| Сроки сохранения уретральным катетером, дн./ Urethral catheter indwelling, days | 7 (100) |
ОРИТ – отделение реанимации и интенсивной терапии/ ICU – Intencive care unit
Положительный хирургический край выявлен в 4 случаях (был связан с миграцией стадии), ятрогенного хирургического края выявлено не было. За период наблюдения не было выявлено случаев биохимического рецидива. Основные онкологические результаты предоставлены в таблице 3.
Таблица 3. Онкологические исходы/ Table 3. Oncological outcomes
| Миграция суммы баллов по Глисону после операции, n (%)/ Gleason grade migration (after operation), n (%) | 18 (36) |
| Стадия pT2, n/ Stage pT2, n | 32 |
| Стадия pT3a, n/ Stage pT3a, n | 11 |
| Стадия pT3b, n/ Stage pT3b, n | 7 |
| Миграция стадии, n (%)/ Stage migration, n (%) | 14 (28) |
| Положительный хирургический край, всего, n/ Positive surgical margin, overall, n | 4 |
| Положительный хирургический край (pT2), n/ Positive surgical margin (pT2), n | 0 |
| Положительный хирургический край (pT3), n/ Positive surgical margin (pT3), n | 4 |
| Биохимический рецидив/ Biochemical recurrence | 0 |
Обсуждение
По данным многочисленных исследований робот- ассистированная радикальная простатэктомия демонстрирует лучшие показатели удержания мочи, по сравнению с лапароскопическим и открытым методом, при сопоставимых онкологических результатах [11-13]. Предложено множество способов, которые улучшают функциональные исходы роботической радикальной простатэктомии, такие как увеличение длины культи перепончатой части уретры, сохранение шейки мочевого пузыря, сохранение семенных пузырьков, выполнение операции с максимальным нервосбережением [14-19]. Проблема недержания мочи после робот-ассистированной радикальной простатэктомии до сих пор окончательно не решена, более того, она является наиболее значимым фактором неудовлетворительного качества жизни в послеоперационном периоде, в связи с чем хирурги продолжают поиск решения данного вопроса [20]. Классическим методом, направленным на предупреждение гипермобильности передней стенки мочевого пузыря, и как следствие, риска недержания мочи в послеоперационном периоде, является передняя суспензия уретры, выполняемая, как правило, на этапе лигирования дорзального сосудистого комплекса полового члена (шов V.R. Patel) [21]. Однако данная методика связана с риском травматизации, прошивания мышечных волокон уретры, что в свою очередь может иметь негативные последствия для мочеиспускания в послеоперационном периоде. В качестве альтернативы шву V.R. Patel в нашей клинике разработан и запатентован способ передней реконструкции, представленный в данном исследовании [22].
Заключение
По нашим данным, новый метод проведения робот-ассистированной радикальной простатэктомии с передней реконструкцией является безопасным и эффективным, сама реконструкция не повышает риск осложнений и не влияет на периоперационные и онкологические исходы. Ранние функциональные результаты применения данной техники передней реконструкции являются многообещающими. Необходимо проведение дальнейших исследований для подтверждения эффективности данной техники.








