МПМРТ в планировании нервосберегающей робот-ассистированной радикальной простатэктомии у больных с локализованным раком предстательной железы низкого и промежуточного рисков прогрессии. Пилотное исследование.
Радикальная робот-ассистированная простатэктомия (РРПЭ) с нервосберегающей техникой является инновационным методом оперативного лечения локализованных форм рака предстательной железы (ПЖ) у пациентов с низким и (в меньшей степени) промежуточным рисками онкопрогрессии. Одним из самых «неприятных» результатов операций является наличие положительного хирургического края (ПХК), а также длительный период восстановления континенции. Предоперационная мультипараметрическая магнитно-резонансная томография (мпМРТ) при планировании операции позволит улучшить онкологический и функциональный результаты.
Мультипараметрическая МРТ (мпМРТ) показала многообещающие результаты в диагностике локализованного рака предстательной железы (РПЖ) [1, 2]. Кроме того, недавние исследования продемонстрировали превосходное соответствие значению Глисон при выполнении Fusion биопсии ПЖ с результатами патоморфологического заключения [3]. Тем не менее, определение группы риска для локализованного РПЖ в соответствии с критериями NCCN включает: уровень ПСА в сыворотке, показатель Глисона образца биопсии и клиническая Т-стадия, трансректальное ультразвуковое исследование (ТРУЗИ) и не содержит мпМРТ [4]. Такая концепция часто приводит к более радикальной стратегии лечения, однако 30-50% мужчин в группах низкого и промежуточного раиска имеют локализованное заболевание и, соответственно, могут рассчитывать на получение фасцио- и нервосберегающего хирургического пособия [5, 6].
Работы Somford и др., а также Marcus и др. демонстрируют отрицательные и положительные прогностические значения ЭКЭ по данным мпМРТ у пациентов с низким, промежуточным и высоким риском согласно критериям D`Amico, и возможность изменения хирургической стратегии на основе предварительной мпМРТ [7, 8].
Поскольку РРПЭ предполагает положительный онкологический результат у пациентов с pT1-pT2-заболеванием, предоперационная мпМРТ должна быть сосредоточена не только на прогнозировании ЭКЭ, но и на подборе хирургического вмешательства, направленного на качество жизни пациента (сохранение фасциально-связочного аппарата, а также сосудисто-нервных пучков) и отсутствие положительного хирургического края (ПХК).
В данном исследовании мы планируем оценить предварительную значимость дооперационного мпМРТ в планировании выполнения фасцио- и нервосберегающей робот-ассистированной радикальной простатэктомии.
Материалы и методы
Выборка пациентов.
Все пациенты были внесены в проспективную базу данных для анализа мпМРТ с оценкой по PIRADS v2, включая результаты трансректальной биопсии предстательной железы в Сеченовском университете с сентября 2019 года. Все субъекты дали письменное информированное согласие.
Начиная с сентября 2019 года мы ретро- и проспективно проанализировали 7 пациентов, которым была выполнена мпМРТ, трансректальная, или Fusion биопсия с последующим выполнением РРПЭ с ФиН в клинике уронефрологии им. Р.М. Фронштейна Сеченовского университета. Всем пациентам была выполнена мпМРТ из-за повышенного уровня PSA и/или положительного результата биопсии. Все пациенты были разделены на группы низкого риска (PSA ≤ 10 нг / мл, комбинированный балл Глисона ≤ 3 + 3 и клиническая стадия T1-2a: 3 наблюдения), а также промежуточного риска (PSA 10-20 нг / мл и / или балл по Глисону ≤ 3 + 4 и / или клиническая стадия T2b-T2c: 4 наблюдения) в соответствии с критериями NCCN. Проведен анализ результатов мпМРТ и патогистологического исследования путем сравнения наиболее крупных очагов (см. «2.4 патоморфологическое исследование»). Критериями исключения являлись: высокий онкологический риск, поражение семенных пузырьков, ЭКЭ, наличие метастазов в регионарных лимфатических узлах.
Методика МРТ и интерпретация данных
Все исследования выполняли на аппарате с напряженностью магнитного поля 3 Тесла (Siemens Magnetom Verio) с использованием многоканальной поверхностной катушки, без эндоректальной катушки.
Анализу подвергались T2-, Т1-взвешенные изображения (T2-ВИ, Т1-ВИ), диффузионно-взвешенные изображения (ДВИ), карта диффузии (ADC), а также изображения, полученные после динамического контрастного усиления (ДКУ). Исследование интерпретировали радиологи с многолетним стажем. Итоговая оценка локализации и характеристика выявленных поражений проводилась с использованием зональной схемы предстательной железы и классификации PI-RADS v2. Благодаря мультипараметрическим данным не составляет труда интерпретировать даже изображения пациентов, перенесших биопсию предстательной железы в течение последнего месяца (рис. 1).
Хирургическая техника
Выполнено 7 (100%) робот- ассистированных радикальных простатэктомий (РРПЭ), включающих фасцио- и нервосберегающую методику (ФиН), без рассечения эндопельвикальной фасции таза, включая последовательную мобилизацию предстательной железы, извлекая ее из окружающих фасций, начиная с еѐ задней поверхности, сохраняя элементы пубовезикальных связок и основного компонента дорсального венозного комплекса, покрытого висцеральным листком тазовой фасции («Veil of Aphrodite» вуаль Афродиты). Каждая РРПЭ с ФиН была выполнена одним опытным хирургом. Операцию планировали в соответствии с данными мпМРТ. При локализации очага в апексе предусматривали удаление дополнительно 2-3 мм дистальной уретры; при преимущественном поражении базиса удаляли проксимальную уретру. При диссекции в области апекса отталкивались от формы железы, представленной данными мпМРТ. На стороне большего поражения, в случае затруднений с дифференцировкой капсулы железы, выполняли экономную резекцию сосудисто-нервного пучка и последующее получение тканей для исследования на предмет хирургических краев.
Патоморфологическое исследование
Каждый макропрепарат был окрашен специальными тканевыми красителями. В другой цвет, отдельно окрашивали "вуаль Афродиты", прилежащую к предстательной железе, или место ее фиксации на предстательной железе (передняя поверхность) с целью определения безопасности предложенной нервосберегающей методики.
Патоморфологическое исследование макропрепарата удаленной предстательной железы выполняли специалисты с многолетним опытом в соответствии с международным стандартом, а также в соответствии с рекомендациями Европейской ассоциации уропатологов. Все образцы макропрепаратов фиксировали в 10% забуференном формалине в течение 24 часов. После фиксации всю поверхность макропрепарата, включая основание семенных пузырьков, окрашивали специальным гистологическим красителем для оценки наличия положительного хирургического края. Подвергнуты ступенчатой секции, согласно Стэнфордской процедуре. Фиксированная простата нарезалась на 3–мм срезы с последующей окраской гематоксилином и эозином по общепринятой методике. Базис и апекс выделялись отдельно. Более детально прорабатывался участок поражения согласно данным мпМРТ. Локализацию опухоли на МРТ в сравнении с гистологическим исследованием мы регистрировали как «отсутствие» совпадения, «точное» или «приблизительное» совпадение [9, 10]. «Точное» совпадение обозначает, что расположение опухоли совпадает по результатам мпМРТ и патогистологического исследования. «Приблизительное» совпадение обозначает отклонение местоположения до ближайшей соседней зоны, например, латеральная при патогистологическом исследовании и дорсолатеральные при МРТ, которые могут возникнуть из за усадки и деформация образца во время подготовки гистологических образцов. Определение патоморфологической рТ стадии являлось решающим в отношении ЭКЭ для всех опухолей. Мы определяем ПХК как любую степень положительного хирургического края, с длиной поля в ≤3 мм (фокальное), или > 3 мм (мультифокальное) [11]. Индекс опухоли определяли, как самый крупный очаг с наивысшей оценкой PI RADS при мпМРТ и самый крупный очаг с высоким баллом Глисон. Пример окраски макропрепарата изображен на рисунке 2.
Результаты
Группа пациентов была проанализирована описательно. Проанализировано: наличие экстракапсулярной экстензии, степень поражения семенных пузырьков, локализация наиболее крупных очагов рака по данным мпМРТ. Данные мпМРТ сопоставлены с результатами патогистологического заключения. Оценено наличие положительных хирургических краев (ПХК), их локализация и размеры.
Клинические, патоморфологические данные, а также результаты мпМРТ 7 пациентов (средний возраст 63,0 года, средний уровень пребиопсийного PSA 8,4 нг / мл, средний объем простаты 42 мл, PIR 4 балла). Во всех случаях по данным мпМРТ экстракапсулярной экстензии выявлено не было. Положительный хирургический край (ПХК) выявлен в 1 случае, размерами менее 0.15 мм в проекции правой переднелатеральной поверхности. Во всех случаях по данным мпМРТ и результатам патогистологического заключения поражения семенных пузырьков не выявлено. У всех пациентов диагностирована клиническая стадия T1c, из них в 5 и случаях выявлено повышение стадии до pT2c.
Обсуждение
Хорошо известно, что распространенность ЭКЭ значительно различается между группами риска: от 11,0 18,0% в группе низкого риска до 30,0% у пациентов среднего риска [6, 12, 13, 24]. Для того, чтобы оценить ЭКЭ мы сопоставили наши результаты с недавними публикациями, таким образом, демонстрируя, что стандартизированное выполнение мпМРТ потенциально может довольно точно предсказать ЭКЭ у пациентов с низким и промежуточным риском [14, 24]. В отличие от клинических критериев, входящих в классификацию NCCN, мпМРТ позволяет эффективно выявить ЭКЭ и с более высокой вероятностью предположить о наличии локализованного процесса [14]. Данный подход поможет хирургам как на предоперационном, так и на интраоперационном этапе оценить вероятность ПХК и ЭКЭ [25]. Известно, что у пациентов, перенесших позадилонную радикальную простатэктомию, МРТ улучшает точность решения хирурга об удалении или сохранении сосудисто-нервных пучков [15]. В предыдущих исследованиях положительный хирургический край встречается от 15% до 20% при нервосберегающих РРПЭ [16, 17].
Наши данные свидетельствуют о том, что проведение предоперационной мпМРТ, результаты которой лежат в основе планирования операции, может снижать процент положительных хирургических краев после РРПЭ с ФиН. В частности, снижение количества обширных (> 3 мм) положительных хирургических краев может предотвратить последующие биохимические рецидивы [18, 19]. Известно, что в зависимости от размеров очагов рака предстательной железы изменяются чувствительность и специфичность. При размере очагов 0.2 0.5 мл чувствительность и специфичность составляет 77% и 91% соответственно, в то время как при размере очагов выше 0.5 мл 90% и 88% соответственно [25]. Учитывая эти данные, возрастает диагностическая ценность биопсии ПЖ, в особенности Fusion биопсии, так как забор гистологического материала выполняется непосредственно из очагов рака, а не случайным образом по стандартной схеме (12 точек). мпМРТ также предрасполагает хирурга к выбору тактики оперативного пособия в пользу анатомо- и нервосбережения. Известно, что данные мпМРТ могут изменить хирургическую тактику до 75% случаев среди пациентов с низким и промежуточным риском онкопрогрессии в сторону щадящих методик оперативного пособия [20, 24].
Мы также знаем, что при РРПЭ с ФиН выявляются артефактные ПХК из за интраоперационной обработки образцов. Существует некоторая вариабельность и субъективность в оценке патологоанатомами ЭКР и положительных хирургических краев, что частично связано с трудностями в выявлении капсулы предстательной железы, особенно на ее апексе [21], К сожалению, при оценке МРТ существует риск ложноположительных данных о наличии ЭКЭ, которые могут привести к излишне радикальным решениям о тактике оперативного пособия.
У исследования присутствуют временные недостатки: во первых, у нас нет данных об отдаленном функциональном результате операции. Наши данные могут указывать на то, что предоперационное выполнение, а также оценка данных мпМРТ приводит к более щадящей хирургической тактике, что в свою очередь позволяет прогнозировать улучшение отдаленных и ближайших функциональных результатов, без ущерба онкологическому. Во вторых, отсутствует контрольная группа для сравнения результатов в пределах одной клиники ввиду того, что подход к данным пациентам, обработке после- операционного материала отличаются от предыдущих, поэтому мы можем сравнивать результаты исключительно с результатами других аналогичных исследований. Помимо мпМРТ, интраоперационные замороженные срезы, как известно, способствуют снижению частоты ПХК и увеличению степени нервосбережения [23], а также могут стать способом улучшения как онкологического, так и функционального результатов, однако в настоящий момент данная методика не нашла широкого применения и в данном исследовании не применялась, что может сказаться на различиях в результатах между нашим исследованием и аналогичными зарубежными, где данная методика широко применяется.
По предварительным результатам исследования можно сделать вывод, что предоперационная мпМРТ предстательной железы у больных с низким и промежуточным онкологическими рисками оказывает влияние на решения хирурга в пользу выполнения нервосберегающих методик операции, а также на уменьшение частоты ПХК, особенно мультифокальных, которые, как принято считать, вызывают рецидив заболевания. Дальнейшее исследование позволило бы получить более достоверную оценку суммарного влияния мпМРТ на онкологические и функциональные результаты. Мы планируем продолжать исследование.
Источник финансирования и конфликт интересов
Авторы данной статьи подтвердили отсутствие финансовой поддержки исследования и конфликта интересов, о которых необходимо сообщить
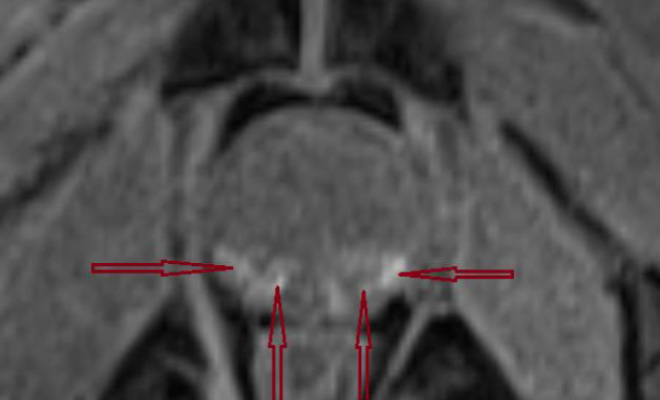 Рис. 1 а. МРТ, пациент А., 59 лет. Состояние после биопсии. Т1-взвешенное изображение с подавлением сигнала от жировой ткани в аксиальной проекции. В периферической зоне предстательной железы визуализируются множественные высокоинтенсивные участки кровоизлияний (стрелки).
Рис. 1 а. МРТ, пациент А., 59 лет. Состояние после биопсии. Т1-взвешенное изображение с подавлением сигнала от жировой ткани в аксиальной проекции. В периферической зоне предстательной железы визуализируются множественные высокоинтенсивные участки кровоизлияний (стрелки).
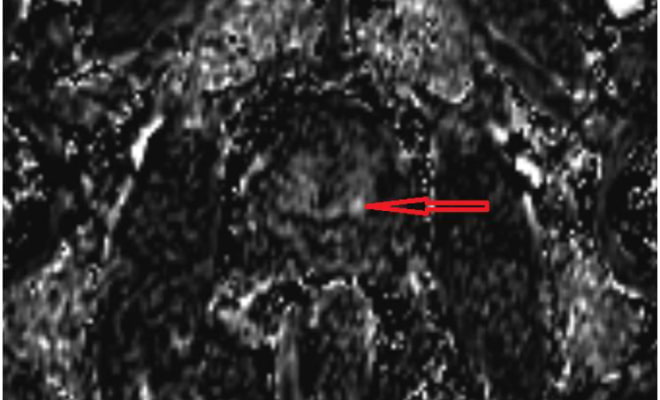 Рис. 1 б. МРТ с контрастированием, пациент А., 59 лет. Состояние после биопсии. Т1-взвешенное субтракционное изображение в аксиальной проекции. Определяется раннее накопление контрастного препарата в очаге аденокарциномы, локализованном в периферической зоне предстательной железы (стрелка).
Рис. 1 б. МРТ с контрастированием, пациент А., 59 лет. Состояние после биопсии. Т1-взвешенное субтракционное изображение в аксиальной проекции. Определяется раннее накопление контрастного препарата в очаге аденокарциномы, локализованном в периферической зоне предстательной железы (стрелка). Рис. 2. Макропрепарат. Удаленная предстательная железа с семенными пузырьками. Удаленная в ходе операции предстательная железа с семенными пузырьками, окрашена тканевым красителем в 2 цвета: черный и оранжевый. Оранжевым окрашена передняя поверхность предстательной железы, прилегающая (до удаления) к «вуали Афродиты». Черным красителем - все остальные поверхности предстательной железы, включая семенные пузырьки.
Рис. 2. Макропрепарат. Удаленная предстательная железа с семенными пузырьками. Удаленная в ходе операции предстательная железа с семенными пузырьками, окрашена тканевым красителем в 2 цвета: черный и оранжевый. Оранжевым окрашена передняя поверхность предстательной железы, прилегающая (до удаления) к «вуали Афродиты». Черным красителем - все остальные поверхности предстательной железы, включая семенные пузырьки.









