Клинический случай: робот-ассистированная расширенная радикальная нефрэктомия слева с удалением конгломерата лимфатических узлов
Резюме
Введение. В статье приведен клинический случай робот-ассистированной расширенной радикальной нефрэктомии слева с удалением конгломерата лимфатических узлов у пациентки с гистологически верифицированным раком почки папиллярного строения; изложена техника операции, приведены основные периоперационные показатели.
Цель исследования заключается в том, чтобы поделиться полученным опытом уникального случая.
Материалы и методы. Пациентка, 21 год, в анамнезе у больной в октябре 2018 года возникла макрогематурия, в связи с чем она была госпитализирована в городскую больницу, где при обследовании, по данным УЗИ и многослойной компьютерной томографии, выявлено образование левой почки. В ноябре 2018 года выполнена прицельная биопсия опухоли левой почки; гистологически — карцинома папиллярного строения. По данным многослойной компьютерной томографии: в верхней и средней трети левой почки определяется гиперваскулярное, неоднородное кистозно-солидное образование с неровным контуром размерами 52 × 44 × 49 мм, распространяющееся в полостную систему почки, компрометирующее хвост поджелудочной железы (без отчетливых признаков инвазии), нельзя также исключить тромбоз ветвей почечной вены. Была выполнена робот-ассистированная расширенная радикальная нефрэктомия слева с удалением конгломерата лимфатических узлов.
Результаты. Длительность первого этапа операции составила 50 минут. Длительность второго этапа операции составила 225 минут. Консольное время — 180 минут. Объем кровопотери не превысил 100 мл. Послеоперационный период протекал без осложнений.
Выводы. Совокупность предварительной эмболизации почечной артерии и робот-ассистированной расширенной радикальной нефрэктомии слева с удалением конгломорета лимфатических узлов является эффективным и безопасным методом лечения у пациентов высокого риска.
Введение
Рак почки составляет около 5 % в структуре онкологической заболеваемости среди мужчин и 3 % среди женщин. В 2018 году в мире было зафиксировано 403 262 новых случаев почечно-клеточного рака (2,2 % в структуре общей онкологической заболеваемости). 175 098 пациентов умерло от рака почки в 2018 году (1,9 % в структуре общей онкологической смертности) [1]. В России регистрируют более 23 000 новых случаев рака почки в год, среди которых на I и II стадии заболевания приходится 47,9 и 16,0 %, а на III и IV стадии — 15,5 и 19,1 % соответственно. Диагностирование рака почки чаще происходит на ранних стадиях заболевания и объясняет высокую частоту (93,1 %) применения оперативного метода как самостоятельного вида радикального лечения [2, 3].
На сегодняшний день общепринятой методикой лечения местно-распространенного почечно-кле- точного рака является радикальная нефрэктомия с удалением пораженных регионарных лимфатических узлов. Используется три основных метода нефрэктомии: открытая, лапароскопическая и робот-ассистированная. Минимальная инвазивная радикальная нефрэктомия ассоциируется со снижением количества осложнений, меньшей кровопотерей и более коротким сроком госпитализации [4, 5]. В настоящее время всё чаще используются роботические хирургические комплексы, наиболее известный — комплекс da Vinci. Впервые нефрэктомия с использованием роботизированного комплекса da Vinci была выполнена в 2000 году [1]. Данный вид малоинвазивной хирургии имеет ряд преимуществ в сравнении с открытой: улучшенная визуализация операционного поля, точность и прецизионность движений хирурга, малая травматичность и минимальная частота возникновения периоперационных осложнений [6, 7]. По данным Rodriguez J, et al. (2018), при сравнении лапароскопической и робот-ассистированной радикальной нефрэктомии последняя была связана с меньшей частотой конверсий, меньшей длительностью операции и меньшей частотой регоспита- лизаций в стационар. Однако разница между этими показателями составляла менее 5 % [4]. Почечно-клеточный рак редко встречается у молодых людей. По данным Taccoen Х, et al. (2007), рак почки у молодых людей чаще локализованный на момент постановки диагноза и имеет лучший прогноз, чем у пожилых людей. Возраст до 40 лет был независимым прогностическим фактором выживания [8]. Выполнение предварительной эмболизации почечной артерии перед нефрэктомией при опухолях крупных размеров позволяет снизить риск развития массивного кровотечения, частоты гемотрансфузий, а также частоты послеоперационных осложнений [6, 7]. Эмболизация почечной артерии перед нефрэктомией является безопасной процедурой и дает преимущества при проведении нефрэктомии, особенно при обильно васкуляризированной опухоли. Многие исследования демонстрируют успешный опыт при использовании данного метода перед нефрэктомией [9, 10, 11].
Материалы и методы
Пациентка, 21 год, с гистологически верифицированным раком левой почки папиллярного строения поступила для планового хирургического вмешательства в урологическое отделение ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России в декабре 2018 года. В октябре 2018 года была экстренно госпитализирована в городскую больницу с макрогематурией, где при обследовании, по данным ультразвукового исследования и многослойной компьютерной томографии, выявлено образование левой почки. В ноябре 2018 года выполнена прицельная биопсия опухоли левой почки под контролем ультразвукового изображения, гистологически — карцинома папиллярного строения. На момент госпитализации пациентка предъявляла жалобы на наличие примеси крови в моче, на ощущение дискомфорта и пальпируемую опухоль в области левого мезогастрия. Объективно: общее состояние удовлетворительное; не лихорадит; гемодинамика стабильная. При пальпации в левой мезогастральной области определяется безболезненное, бугристое, неподвижное образование плотной консистенции. Поколачивание по поясничной области безболезненно с обеих сторон. Вес пациентки — 45 кг; рост — 164 см; индекс массы тела — 16,7. По данным лабораторных исследований от декабря 2018 года — в клиническом анализе крови уровень гемоглобина 98,1 г/л, эритроцитов — 3,58 млн/мкл, лейкоцитоза и палочкоядерного сдвига нет. В биохимическом анализе крови уровень креатинина, мочевины крови — в пределах референсных значений. В общем анализе мочи отмечалась выраженная эритроцитурия (измененные и неизмененные эритроциты, покрывающие все поля зрения).
Многослойная компьютерная томография брюшной полости: в верхней и средней трети левой почки определяется гиперваскулярное, неоднородное кистозно-солидное образование с неровным контуром размерами 52 × 44 × 49 мм, распространяющееся в полостную систему почки, компрометирующее хвост поджелудочной железы (без отчетливых признаков инвазии), нельзя также исключить тромбоз ветвей почечной вены. Вокруг опухоли определяются сосудистые коллатерали. С опухолью вдоль левых почечных сосудов сливается конгломерат увеличенных лимфоузлов справа от аорты, распространяющийся от чревного ствола до уровня бифуркации аорты, максимальным размером до 45 × 36 мм, с обширными жидкостными участками (распад?). Конгломерат компремирует 12-перстную кишку, тощую кишку в проксимальных отделах, левую почечную вену (сквозь него проходит левая почечная артерия), левый мочеточник (инвазия?) плотно прилежит к поджелудочной железе в области хвоста, левой поясничной мышце.
Результаты
20.12.2018 году в ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России первым этапом выполнена эндоваскулярная эмболизация левой почечной артерии. Под 1%-м раствором лидокаина (10 мл) пунктирована в ретроградном направлении правая общая бедренная артерия, установлен интродьюсер 6F, к устьям левых почечных артерии по проводнику 0.035» подведен диагностический катетер; селективная катетеризация. Ангиография: равномерное контрастирование левой почечной артерии, одной аберрантной почечной артерии, отходящей одним устьем с надпочечниковой артерией. Выполнена эмболизация артерий частицами Contour 500–710 mkm. При контрольной ангиографии: interlobar, arcuate, and cortical radiate (interlobular) arteries не контрастируются (стоп-контраст), оптимальный ангиографический результат. Инструменты удалены. Ушивание пункционного отверстия с помощью системы Angio-Seal VIP. Асептическая повязка, продолжительность: 50 минут.
Затем вторым этапом выполнена робот-ассистированная расширенная радикальная нефрэктомия слева с удалением конгломорета лимфатических узлов. Операция была выполнена опытным роботическим хирургом (опыт — более 1000 операций). В положении больного на правом боку выполнен лапароцентез в нижней параумбиликальной точке, наложен карбоксиперитонеум. Троакары da Vinci введены в типичных местах. При ревизии в брюшной полости выпота нет, визуализируется образование левой почки больших размеров, выбухающее из забрюшинного пространства. Образование прилежит к висцеральной поверхности селезенки, хвосту поджелудочной железы, не прорастая в них. В области ворот левой почки, интимно прилежа к сосудам левой почки, передней поверхности хвоста поджелудочной железы, брюшной аорте (без признаков инвазии в вышеперечисленные структуры), определяются неправильной округлой формы образования 4,5 × 3,8 см и 3,0 × 2,2 см — конгломерат увеличенных парааортальных лимфатических узлов (рис. 1), продолжение опухоли левой почки (рис. 2). Выделена сосудистая ножка левой почки (артерия, вена), левая почечная вена, левая артерия раздельно клипированы, пересечены (рис. 3, 4). Выделена левая надпочечниковая вена, клипирована, пересечена. Левый мочеточник выделен на протяжении, клипирован, пересечен. Гемостаз — сухо. Левая почка выделена единым блоком с левым надпочечником, образованиями в области ворот левой почки, удалена через дополнительный поперечный разрез в надлонной области. Контроль гемостаза. Дренаж в ложе удаленной левой почки. Послойный шов ран. Асептическая повязка. Длительность второго этапа операции составила 225 минут. Консольное время — 180 минут. Объем кровопотери не превысил 100 мл.
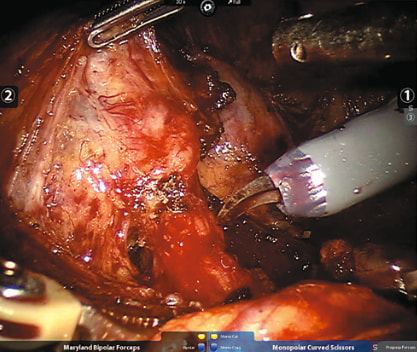 Рис. 1. Конгломерат лимфатических узлов
Рис. 1. Конгломерат лимфатических узлов
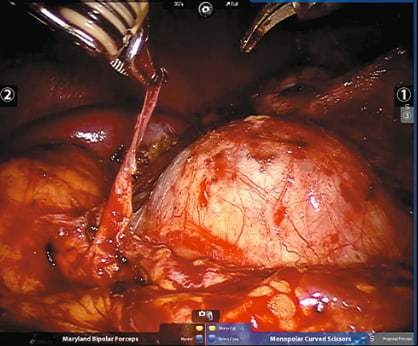 Рис. 2. Опухоль почки
Рис. 2. Опухоль почки
При гистологическом исследовании препарата почки с окружающими тканями размерами 10,0 × 6,0 × 5,5 см на разрезе с образованием, располагающимся близко к лоханке 4,0 × 5,0 см. В воротах почки — лимфатические узлы по 3,5 см в диаметре из бело-желтого цвета ткани с кровоизлияниями — папиллярный почечно-клеточный рак почки, тип 2. В воротах почки два лимфатических узла, один представлен субтотальным метастазом папиллярного почечно-клеточного рака, другой — кровоизлияниями и некрозами ткани лимфатического узла.
Таким образом, у больной установлен заключительный диагноз «папиллярный почечно-клеточный рак pТ3aN1M0 с внутрисосудистым раковым эмболом в почечной вене».
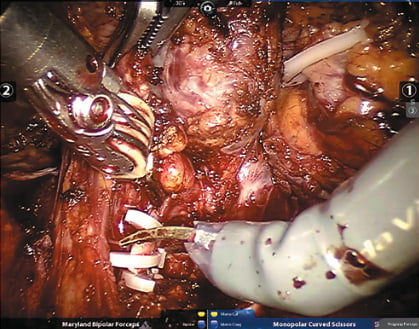 Рис. 3. Левая почечная артерия
Рис. 3. Левая почечная артерия
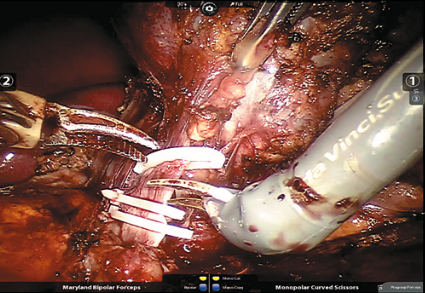 Рис. 4. Левая почечная вена
Рис. 4. Левая почечная вена
Послеоперационный период протекал гладко, без осложнений. Отмечалось клинически незначимое снижение гемоглобина (82,1 г/л; снижение на 8,3 % от исходного), а также уровня эритроцитов (2,93 млн/мкл; ниже исходного на 8,1 %). Уровень креатинина, мочевины в пределах нормы. Пациентка находилась в отделении реанимации и интенсивной терапии 1 сутки. Уретральный катетер удален на 2 сутки. Дренаж удален из ложа удаленной левой почки на 3 сутки. Пациентка выписана из стационара на 8 сутки после операции в удовлетворительном состоянии.
Выводы
Описанный клинический случай демонстрирует эффективность и безопасность применения робот-ассистированной расширенной радикальной нефрэктомии слева с удалением конгломорета лимфатических узлов с предварительной эндоваскулярной эмболизацией левой почечной артерии в лечении пациентки молодого возраста с крупной опухолью почки и конгломератом лимфатических узлов. Также этот уникальный случай показывает возможность снижения травматичности, уменьшения сроков госпитализации и реабилитации пациентов трудоспособного возраста. Такое представляется возможным в руках опытного роботического хирурга, в высокооснащенных клиниках экспертного уровня, где присутствует слаженная командная работа нескольких отделений.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Информация об авторах: Мосоян Мкртич Семенович, д.м.н., руководитель центра роботической хирургии, заведующий кафедрой урологии с курсом роботической хирургии Института медицинского образования, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; профессор кафедры урологии ФГБОУ ВО ПСПбГМУ им. И. П. Павлова Минздрава России; Федоров Дмитрий Александрович, врач-уролог, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Айсина Надежда Анатольевна, врач-уролог, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Терещенко Святослав Игоревич, клинический ординатор, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.








