Роль робот-ассистированных вмешательств в хирургическом лечении локализованного и местнораспространенного неметастатического рака предстательной железы
Рак предстательной железы (РПЖ) на данный момент является одним из самых распространенных онкологических заболеваний мужской части населения 17. В России по показателю прироста среди всех онкологических заболеваний у мужчин данная патология занимает первое место: в период с 2000 по 2010 г. прирост заболеваемости составил 137%. В 2010 г. по сравнению с 2000 г. у мужчин на фоне значительного снижения стандартизованного показателя смертности от большинства злокачественных новообразований (–9,8%) отмечен рост показателя смертности от злокачественных опухолей предстательной железы (+41,4%) 11;14;17.
В настоящее время, несмотря на развитие лучевой терапии, а также различных видов фокальной терапии, наиболее распространенным методом лечения пациентов с локализованными формами РПЖ остается радикальная простатэктомия (РПЭ) 18;20;21;25.
В последние несколько десятилетий основной парадигмой развития хирургической науки являются стремление к минимизации операционной травмы, совершенствование техники оперативных вмешательств и повышение качества жизни (КЖ) пациентов 3. Так, начало 1990-х годов ознаменовалось выполнением первой серии лапароскопических простатэктомий. Несколько позже, в 2000 г., впервые была проведена робот-ассистированная лапароскопическая простатэктомия (РАЛП). Система da Vinci, облегчив выполнение РПЭ за счет хорошей визуализации операционного поля и усовершенствованной эргономики инструментов, способствовала улучшению интра- и послеоперационных показателей, и, по данным многих публикаций, положительно повлияла на онкологические и функциональные результаты операции 22;26;27;28.
Несмотря на это, медицинское сообщество не пришло к единому мнению относительно преимуществ РАЛП. Причем отсутствие рандомизированных исследований, где сравнивались бы результаты открытой и робот-ассистированной операций, усиливает разногласия между сторонниками обеих методик 23;24.
Цель исследования: выявить преимущества и недостатки робот-ассистированной радикальной простатэктомии как современного метода хирургического лечения локализованного и местнораспространенного неметастатического рака предстательной железы.
Материалы и методы
В клиническое исследование были включены 607 пациентов из числа больных, прооперированных по поводу локализованного гистологически верифицированного РПЖ в ФГБУ «Национальный медико-хирургический центр им. Н. И. Пирогова» в период с 2005 по 2017 г. Проанализированы результаты двух вариантов оперативных вмешательств, наиболее полно отражающих особенности хирургии органов малого таза: позадилонной и роботической простатэктомии. Первую группу составили 84 пациента, которым была выполнена позадилонная открытая радикальная простатэктомия (ОРП) в период с февраля 2005 г. по ноябрь 2010 г. (до окончательной инсталляции системы da Vinci Si в НМХЦ им. Н. И. Пирогова). Во вторую группу вошли 523 пациента с РАПЭ, выполненной в период с апреля 2010 г. по декабрь 2017 г.
Показаниями к проведению РПЭ в обеих группах являлось наличие РПЖ стадий T1–T3bN0M0 при ожидаемой продолжительности жизни пациента более 10 лет.
Все операции были проведены одной бригадой хирургов, обладающих опытом выполнения открытых и лапароскопических вмешательств на органах малого таза. Пациенты, прооперированные другими хирургами, не включались в исследование с целью предотвращения погрешностей, связанных с различиями в технике операции и опыте хирурга. ОРП выполняли по стандартной методике, подробно описанной во многих статьях и монографиях 29, 30, РАЛП — по стандартной методике, описанной M. Menon и соавт. 19.
В исследовании был использован стандартный диагностический алгоритм предоперационного и послеоперационного обследования пациентов с клинически локализованным РПЖ, дополненный исследованием функции удержания мочи и эректильной функции (ЭФ), а также изучением КЖ пациентов.
Для анализа осложнений применяли классификацию Clavien (модифицированную в 2004 г.), в основе которой лежит оценка тяжести осложнения в зависимости от метода его коррекции. Мониторинг уровня ПСА проводили через 3, 6, 12 месяцев послеоперационного периода, далее каждые полгода в течение 3 лет, затем 1 раз в год. В соответствии с международным консенсусом за рецидив аденокарциномы после РПЭ принимали уровень ПСА выше 0,2 нг/мл в двух последовательных измерениях.
Исследование континенции строили на оценке статуса удержания мочи в 4 контрольных точках послеоперационного периода: через 1–3 суток после удаления катетера, 3, 6 и 12 месяцев после операции. Полностью удерживающими мочу считали пациентов, отмечавших полное отсутствие подтекания мочи при осуществлении каждодневной деятельности или незначительное подтекание мочи не более 1 раза в неделю. Функцию удержания мочи оценивали путем анализа заполнявшегося пациентом стандартизованного опросника ICIQ-UI SF. Кроме того, применяли подсчет количества гигиенических прокладок, использовавшихся пациентами с инконтиненцией в течение суток.
У пациентов с проведенной нервосберегающей операцией восстановление ЭФ оценивали посредством анализа опросника IIEF-5 — стандартизованного и валидного инструмента выявления нарушений ЭФ. В послеоперационном периоде адекватными считали эрекции при балле IIEF-5 более 17. В дальнейшем наблюдение строилось на оценке восстановления ЭФ в 3 контрольных точках: через 3, 6, 12 месяцев после операции.
С целью объективизации и стандартизации оценки КЖ у пациентов, перенесших РПЭ, использовали анкету SF-36 (Medical Outcomes Study — Short Form).
Для сравнения групп нормально распределенных данных мы использовали t-критерий Стьюдента. Перед использованием критерия Стьюдента мы проверели гипотезу о различии дисперсии выборок с помощью критерия Левена. В случае несопоставимости величины дисперсий в группах использовали t-критерий для выборок с различными дисперсиями.
При сравнении групп данных, распределение которых отличается от нормального, мы использовали критерий Манна-Уитни в случае независимых признаков и критерий Вилкоксона для зависимых признаков. Различия мы считали статистически значимыми при уровне p < 0,05.
Результаты
Анализ интраоперационных и ранних послеоперационных показателей в обеих группах представлен в таблице 1.
Таблица 1. Интраоперационные и ранние послеоперационных клинические параметры
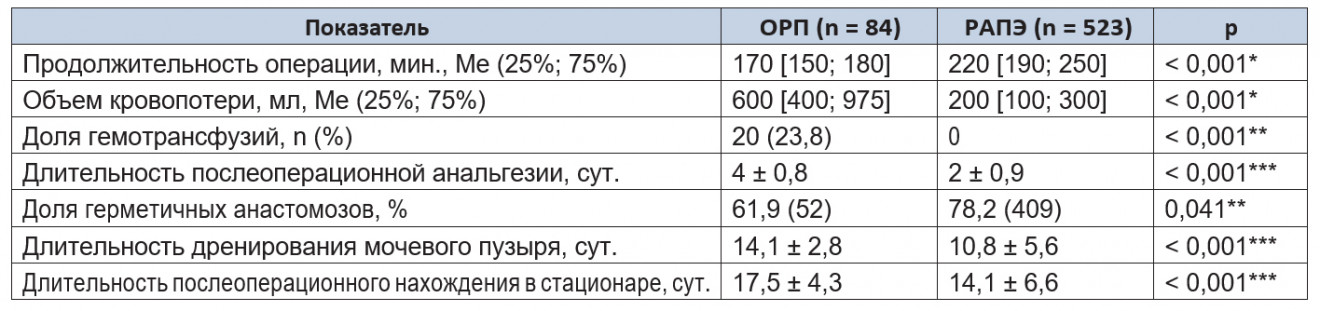
Примечания.
1.В таблицах 1–10 ОРП — открытая радикальная простатэктомия; РАПЭ — робот-ассистированная простатэктомия.
2.(*) — U-критерий Манна — Уитни; (**) — критерий χ² Пирсона; (***) — t-критерий Стьюдента.
Частота осложнений в группе открытого метода составила 25,2%, в группе РАПЭ — 2,2% (p = 0,045) (табл. 2).
Таблица 2. Интраоперационные и послеоперационные осложнения в соответствии с модифицированной классификацией Clavien (2004 г.)
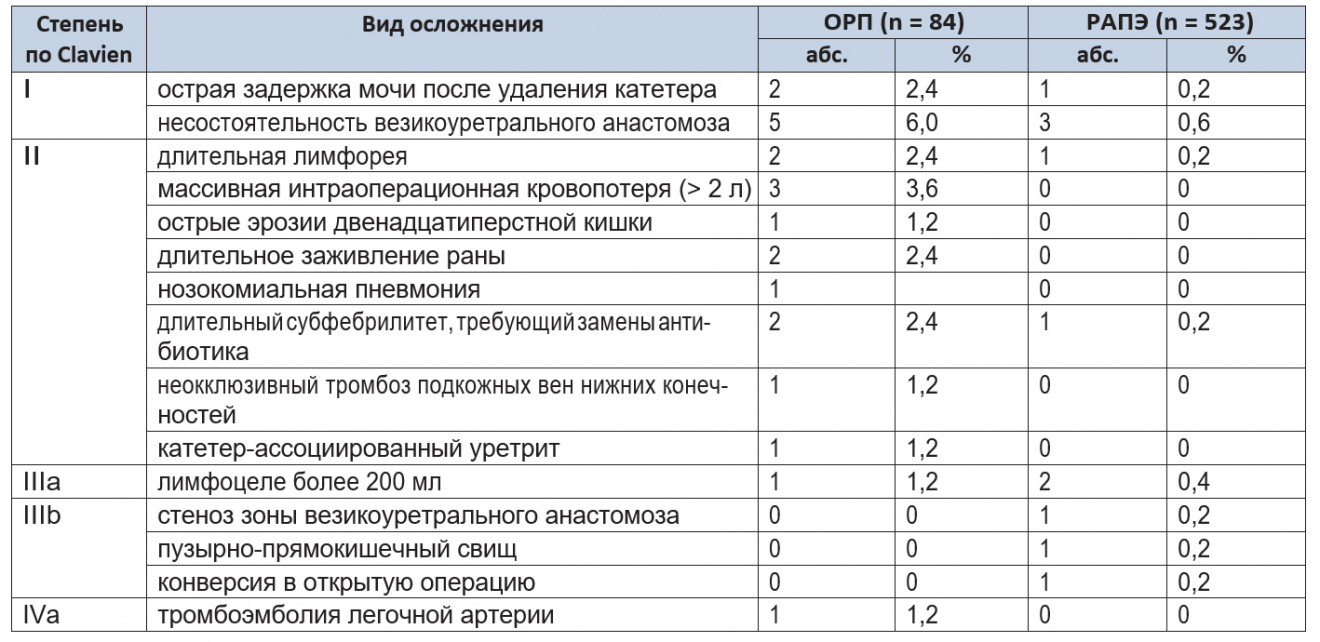
Большинство осложнений в обеих группах было легкой и средней степени тяжести (I–III). В обеих группах не отмечалось случаев полиорганной недостаточности (IVb) или летальных исходов (V). В структуре осложнений статистически значимых различий между группами не обнаружено (p > 0,05).
Через 12 месяцев выявлена одна стриктура зоны анастомоза в группе ОРП. Для коррекции данного осложнения потребовалось проведение трансуретральной резекции зоны анастомоза. Рецидива стриктуры не отмечалось. В группе РАПЭ стриктуры зоны анастомоза отсутствовали. Различия по количеству стриктур в группах сравнения были статистически незначимыми (p = 0,49).
Анализ онкологических показателей. По показателям степени дифференцировки опухоли и стадии опухоли статистически значимых различий между группами не обнаружено (p = 0,699 и p = 0,363 соответственно), что подтверждает их сопоставимость и однородность (табл. 3).
Таблица 3. Послеоперационные онкологические параметры
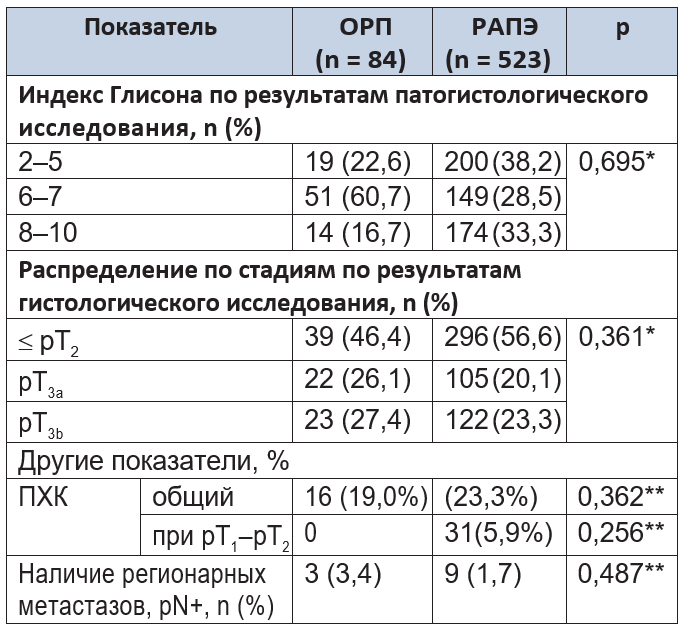
Примечания.
1.ПХК — положительный хирургический край.
2.(*) — t-критерий Стьюдента; (**) — критерий χ² Пирсона.
Статистический анализ не выявил значимых различий по показателю положительного хирургического края (ПХК) (p = 0,362). Анализ удаленной лимфоидной ткани показал поражение опухолью регионарных лимфатических узлов в 3 (3,6%) наблюдениях группы ОРП и в 9 (1,7%) — группы РАПЭ (p = 0,487).
В таблице 4 отражена безрецидивная выживаемость в 3 контрольных точках. Через 12 месяцев наблюдения этот показатель составил 76,7% и 84,0% для групп ОРП и РАПЭ соответственно (p = 0,24). При проведении МРТ и остеосцинтиграфии у больных с выявленным биохимическим рецидивом признаков локального или системного распространения опухолевого роста обнаружено не было.
Таблица 4. Безрецидивная выживаемость в группах сравнения
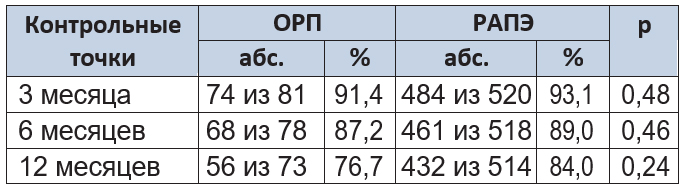
Примечание. Критерий χ2 Пирсона.
Анализ восстановления функции удержания мочи. Состояние функции удержания мочи является основным фактором, влияющим на КЖ пациента после выполненной РПЭ. В таблице 5 приведены показатели восстановления континенции в группах после удаления катетера и через 3 месяца после операции.
Таблица 5. Показатели восстановления континенции в 1-й и 2 контрольных точках
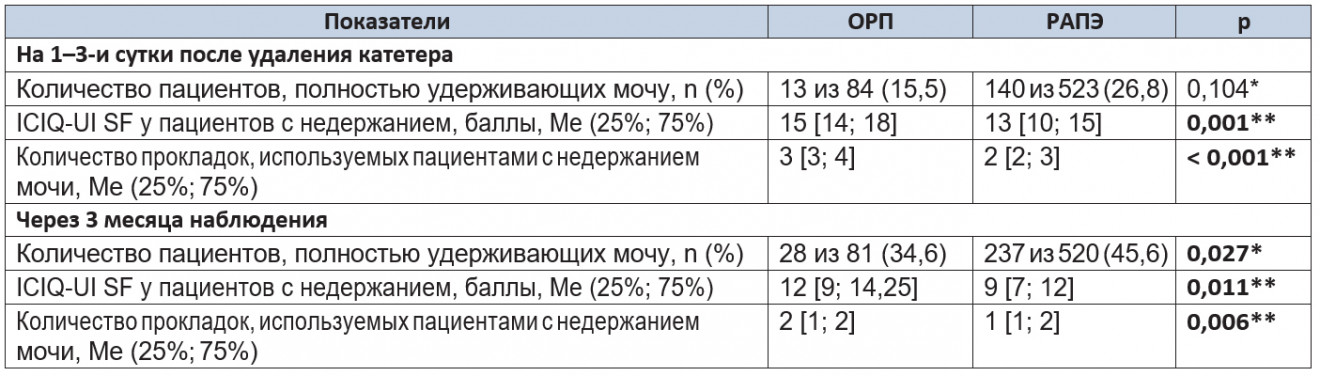
Примечание. (*) — критерий χ2 Пирсона; (**) — U-критерий Манна — Уитни.
После удаления катетера количество пациентов, полностью удерживавших мочу, в группе РАПЭ превышало таковое в группе ОРП при отсутствии статистической значимости различий (p = 0,104). По результатам анкетирования среди пациентов с инконтиненцией группа РАПЭ набирала достоверно меньшее количество баллов, что свидетельствовало о более высоком качестве контроля функции мочеиспускания в этот период (p = 0,001). Кроме того, в этой группе пациенты использовали меньшее количество прокладок, чем пациенты с ОРП (p < 0,001).
Через 3 месяца наблюдения количество пациентов, полностью удерживавших мочу, в группе РАПЭ статистически значимо превышало таковое в группе ОРП (p = 0,027). По результатам анкетирования среди пациентов с недержанием через 3 месяца наблюдения в группе РАПЭ выявлено достоверно более высокое качество континенции (p = 0,011). Среднее количество гигиенических прокладок в группе РАПЭ было меньшим, чем в группе ОРП (p = 0,006).
По окончании 6 месяцев наблюдения количество пациентов, полностью удерживавших мочу, в группе РАПЭ не превышало таковое в группе ОРП (p = 0,14) (табл. 6).
Таблица 6. Показатели уровня континенции через 6 и 12 месяцев после операции
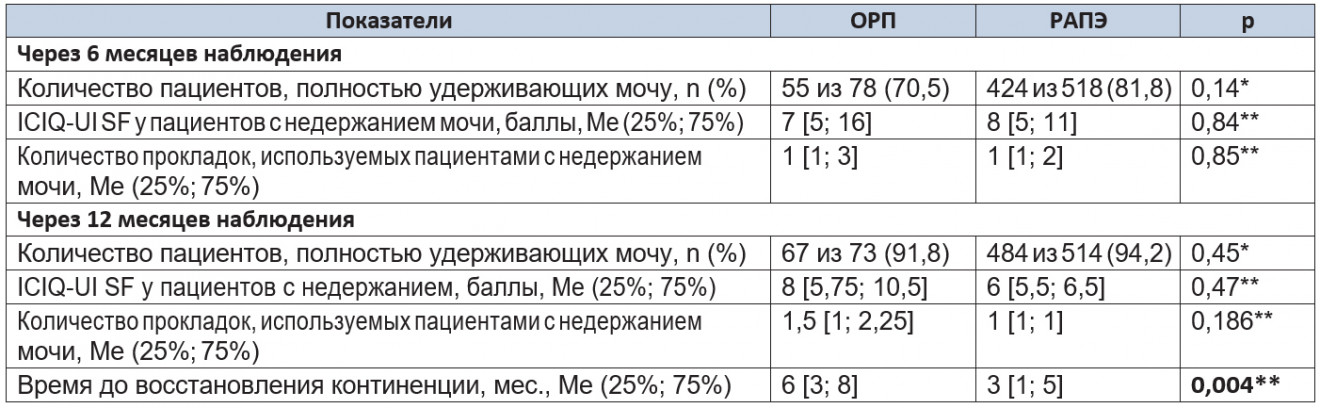
Примечание. (*) — критерий χ² Пирсона; (**) — U-критерий Манна — Уитни.
При статистическом анализе данных анкетирования средние баллы у инконтинентных пациентов в исследуемых группах значимо не различались (p = 0,84). При подсчете количества гигиенических прокладок также не было выявлено значимых различий (p = 0,85). Через 12 месяцев наблюдения количество пациентов, полностью удерживавших мочу, в исследуемых группах было сопоставимым (p = 0,45). При анализе данных анкетирования (p = 0,47) и подсчете количества гигиенических прокладок (p = 0,186) различия в группах сравнения также не имели статистической значимости.
Анализ восстановления эректильной функции. В результате отбора, проведенного в предоперационном периоде, доля пациентов, которым была выполнена нервосберегающая операция, составила 25,0% и 61,8% в группах ОРП и РАПЭ соответственно. После выполненной РПЭ с целью более раннего восстановления ЭФ, а также профилактики кавернозного фиброза всем пациентам назначали ингибиторы фосфодиэстеразы 5-го типа (силденафил в дозировке 50 мг 1 раз в день) через 1 месяц после операции. Результаты восстановления ЭФ представлены в таблицах 7 и 8.
Таблица 7. Результаты восстановления эректильной функции через 3 месяца наблюдения
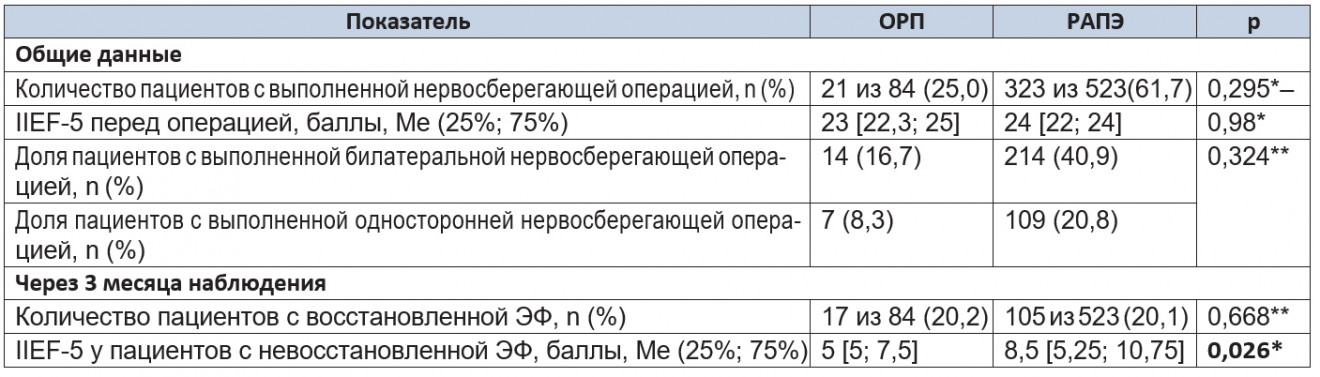
Примечания.
1.В таблицах 7, 8: ЭФ — эректильная функция.
2.(*) — U- критерий Манна — Уитни; (**) — критерий χ² Пирсона.
Таблица 8. Результаты восстановления эректильной функции через 6 и 12 месяцев наблюдения
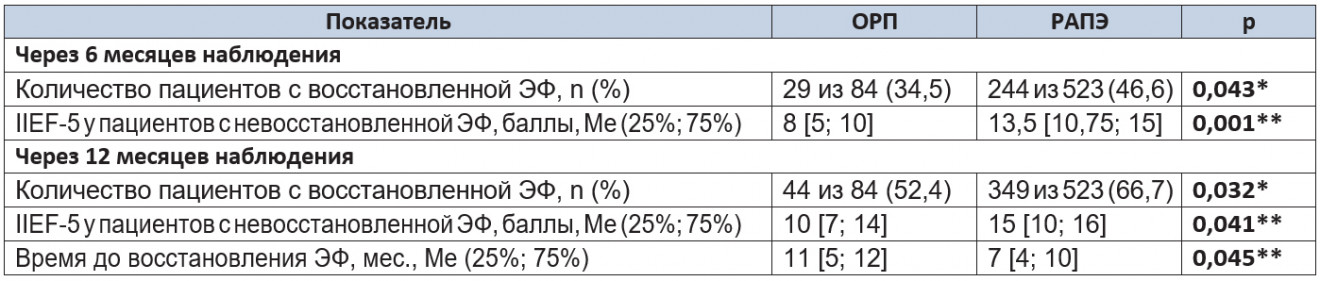
Примечание. (*) — критерий χ² Пирсона; (**) — U-критерий Манна — Уитни.
Доля пациентов с восстановленной ЭФ (IIEF-5 > 17) через 3 месяца после операции в исследуемых группах была одинаковой (p = 0,668). При этом количество баллов, набранных пациентами с невосстановленной ЭФ, при проведении РАПЭ было статистически значимо больше (p = 0,026), что может говорить о более раннем восстановлении спонтанных эрекций в данной группе.
Через 6 месяцев наблюдения количество пациентов с полностью восстановленной ЭФ в группе РАПЭ было значимо больше, чем в группе ОРП (p = 0,043). При сравнении результатов заполнения опросника пациентами с неполным восстановлением ЭФ видно, что средний балл в группе РАПЭ превышает таковой в группе ОРП (p = 0,001), что говорит о более высокой оценке качества восстановления ЭФ пациентами, перенесшими РАПЭ.
Через 12 месяцев доля пациентов с полностью восстановленной ЭФ в группе РАПЭ значимо превышала таковую в группе ОРП (p = 0,032). По количеству баллов опросника среди пациентов с неполным восстановлением ЭФ группа РАПЭ демонстрировала более высокое качество восстановления ЭФ при статистически значимых межгрупповых различиях (p = 0,041).
Скорость восстановления ЭФ до 6 месяцев наблюдения в группах сравнения значимо не различалась. Затем кривые расходятся, демонстрируя более раннее восстановление ЭФ в группе РАПЭ, что нашло подтверждение в сравнении медиан восстановления ЭФ (p = 0,045). Анализ выживаемости с применением регрессии Кокса также выявил статистически значимые различия исследуемых групп по времени восстановления ЭФ (p = 0,039).
Качество жизни пациентов после радикальной простатэктомии в группах наблюдения. По результатам оценки КЖ пациентов после РПЭ установлено, что физический и психологический компоненты здоровья в группах ОРП и РАПЭ значимо улучшались по мере увеличения длительности послеоперационного периода. В ранние сроки наблюдения наименьшие показатели определены по шкалам, составляющим физическое здоровье: ролевое физическое функционирование, интенсивность боли и общее состояние здоровья.
При сравнительном изучении физического компонента здоровья в группах ОРП и РАПЭ установлено, что через 1 месяц после операции пациенты, перенесшие РАПЭ, демонстрировали статистически значимо (p < 0,05) более высокое КЖ по некоторым шкалам: физическое функционирование, интенсивность боли, общее здоровье. Через 3 месяца наблюдения по таким показателям физического компонента здоровья, как физическое функционирование и ролевое функционирование, группа РАПЭ также демонстрировала более высокие баллы (p < 0,05). В других контрольных точках статистически значимых различий не наблюдалось.
Выполнен подсчет средних значений физического компонента здоровья в различные сроки послеоперационного периода, а также проведено сравнение данных показателей в исследуемых группах (табл. 9).
Таблица 9. Физический компонент здоровья пациентов после операции
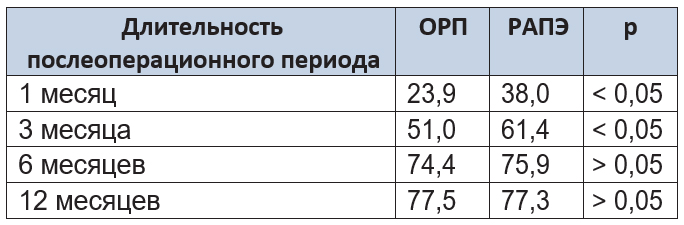
Из таблицы следует, что сред- ний балл физического компонента здоровья через 1 и 3 месяца наблюдения после РАПЭ был выше, чем после ОРП (p < 0,05), что может быть объяснено меньшей интенсивностью боле- вых ощущений и более ранним восстановлением физической активности в группе РАПЭ. Через 6 и 12 месяцев статистически значимых различий между группами не выявлено.
При сравнительном изучении психологического компонента здоровья в группах ОРП и РАПЭ установлено, что через 1 месяц после операции пациенты, которым выполнялась РАПЭ, демонстрировали статистически значимо (p < 0,05) более высокое КЖ по таким шкалам, как жизненная активность и социальное функционирование.
Выполнен подсчет средних значений психологического компонента здоровья в различные сроки послеоперационного периода, а также проведено сравнение данных показателей в исследуемых группах (табл. 10).
Таблица 10. Психологический компонент здоровья пациентов после операции
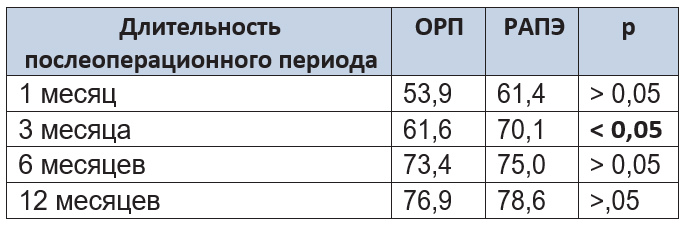
Как следует из таблицы, через 3 месяца наблюдения средний балл в группе РАПЭ был статистически значимо выше, чем в группе ОРП, что, по нашему мнению, связано с бо’льшим количеством пациентов группы РАПЭ, полностью удерживавших мочу, в данной контрольной точке. Через 1, 6 и 12 месяцев различий между группами не наблюдалось. При сравнении КЖ в группах ОРП и РАПЭ с группой контроля установлено, что независимо от вида выполненного вмешательства уровень КЖ приближался к уровню КЖ здоровых людей приблизительно к 12 месяцам послеоперационного периода.
Обсуждение
На сегодняшний день РАПЭ является основной альтернативой ОРП. С начала использования роботизированной техники в лечении локализованного РПЖ данный доступ стал демонстрировать хорошие, если не лучшие, результаты в сравнении с классической методикой в серии инициальных наблюдений 4, 12. Аналогичные выводы прослеживаются и при анализе крупных серий наблюдений. J. Hu и соавт. провели исследование, включившее 8837 мужчин, оперированных по поводу РПЖ в период с 2003 по 2007 г. 16. Данный анализ публикаций ставил своей целью сравнение результатов ОРП как метода «золотого стандарта» и минимально инвазивных методик — лапароскопических простатэктомий и РАПЭ. Исследователи пришли к выводу, что оперированные минимально инвазивными методами пациенты имели статистически значимо меньшую продолжительность госпитализации, меньшее число гемотрансфузий, респираторных и так называемых смешанных хирургических осложнений, а также стриктур везикоуретрального сегмента. Группы имели сходные показатели дополнительного послеоперационного лечения онкологической патологии, что свидетельствует об эквивалентной радикальности традиционной и минимально инвазивных методик.
Следует отметить, что по мере накопления опыта происходило сокращение времени операции. Так, средняя продолжительность первых 20 РАПЭ составила 323 ± 106 минут, тогда как длительность последних 20 РАПЭ уменьшилась до 160 ± 29,8 минуты.
При сравнении интра- и ранних послеоперационных данных, таких как объем кровопотери, частота гемотрансфузий, продолжительность послеоперационной анальгезии, длительность катетеризации мочевого пузыря, длительность послеоперационного нахождения в стационаре, нами отмечено статистически значимое улучшение показателей при применении робот-ассистированных технологий (p < 0,05). Важным моментом, на наш взгляд, явилось значительное снижение расходов на проведение гемотрансфузий при выполнении РАПЭ за счет отсутствия трансфузий.
Описанная в исследовании частота осложнений — 24% после ОРП и 13,3% после РАПЭ — относительно высока в сравнении с аналогичным показателем у других авторов 1;2;6;7. Разница в результатах может быть объяснена тем, что в наше исследование были включены все пациенты, в том числе и те, кто вошел в кривую обучения (в первых 20–25 случаев). Кроме того, для классификации осложнений мы использовали модифицированную систему Clavien, учитывающую любое отклонение от нормального интра- и послеоперационного периода (включая клинически незначимые события).
Согласно данным литературы, доля общего (для pT2–pT3) ПХК после ОРП и РАПЭ весьма вариабельна и составляет в среднем 15–30% 5, 11. При этом в большинстве сравнительных исследований продемонстрирован меньший процент ПХК при РАПЭ по сравнению с ОРП 8;9. В выполненном исследовании показатель ПХК после ОРП составил 19,0% против 23,3% после РАПЭ (p > 0,05). Анализируя наши данные, можно отметить, что разница в частоте выявления ПХК в группах при данном количестве наблюдений не имела статистической значимости.
При сравнении функциональных показателей наши данные демонстрируют статистически значимо (p < 0,05) лучшее восстановление континенции через 3 месяца послеоперационного периода и ЭФ за период наблюдения 6 и 12 месяцев после РАПЭ, что сравнимо с результатами зарубежных исследователей 10;13;15.
Заключение
Робот-ассистированная радикальная простатэктомия является эффективным и безопасным методом в хирургическом лечении пациентов с локализованным и местнораспространенным неметастатическим раком предстательной железы.
Применение робот-ассистированной технологии в радикальном хирургическом лечении таких больных уменьшает объем кровопотери, продолжительность послеоперационного обезболивания, долю негерметичных анастомозов, длительность катетеризации мочевого пузыря и продолжительность послеоперационного койко-дня, снижает уровень осложнений по сравнению с традиционной методикой.
Робот-ассистированная лапароскопическая простатэктомия в радикальном лечении рака предстательной железы демонстрирует сопоставимые с открытой методикой отдаленные онкологические результаты. Эта методика способствует более раннему восстановлению функции удержания мочи и эректильной функции по сравнению с открытой операцией.
Качество жизни пациентов, перенесших робот-ассистированную лапароскопическую простатэктомию, через 1 и 3 месяца после операции выше, чем у пациентов, перенесших открытую операцию, а в более поздние сроки сопоставимо с качеством жизни пациентов группы традиционного доступа.
Таким образом, применение роботизированной системы da Vinci S в онкологической практике позволяет свести к минимуму операционную травму и достигнуть высоких показателей качества хирургической помощи.
Автор, ответственный за переписку: Ханалиев Бениамин Висампашаевич — д. м. н., заведующий отделением урологии ФГБУ «НМХЦ им. Н. И. Пирогова» Минздрава России.
Е-mail: urology-andrology@yandex.ru


-2x.jpg)






