Робот-ассистированные операции в хирургии поджелудочной железы
Цель. Улучшить результаты лечения больных опухолями поджелудочной железы применением роботического комплекса.
Материал и методы. За период с 2009 по 2017 г. в абдоминальном отделении No1 ФГБУ “Институт хирургии им. А.В. Вишневского” оперировано 93 пациента с различными опухолями поджелудочной железы. Панкреатодуоденальная резекция (ПДР) выполнена в 17 наблюдениях, дистальная резекция поджелудочной железы – в 49, энуклеация опухоли – в 19, срединная резекция – в 6, дуоденопанкреатэктомия – в 2.
Результаты. Продолжительность вмешательств зависела от их объема: ПДР – 400 (360; 505) мин, дистальной резекции – 210 (178; 250) мин. Средний объем кровопотери при ПДР составил 200 (150; 500) мл, при дисталь- ной резекции – 100 (50; 300) мл. При энуклеации опухоли и срединных резекциях кровопотеря была минимальной. Конверсия потребовалась в 4 наблюдениях: при ПДР – в 2, при дистальной резекции – в 1, при энуклеации опухоли – в 1. Послеоперационные осложнения развились у 38 больных: панкреатический свищ – у 35, кровотечение на фоне панкреатического свища – у 6.
Заключение. Показаниями к робот-ассистированным операциям являются злокачественные и погранично злокачественные опухоли поджелудочной железы Т1–T2, а также доброкачественные опухоли органа 5–6 см. Робот-ассистированный вариант операций не позволяет значимо уменьшить число послеоперационных осложнений. С накоплением опыта показания к робот-ассистированным вмешательствам могут быть расширены.
Введение
Поджелудочная железа (ПЖ) является оптимальным объектом для робот-ассистированного метода выполнения операций. Этот способ обеспечивает максимальный эффект от преци- зионной работы в малом анатомическом пространстве, что полностью соответствует идеологии роботической хирургии [1]. Коллектив 1-го абдоминального отделения ФГБУ “Институт хирургии им. А.В. Вишневского” обладает наибольшим в стране опытом робот-ассистированных операций на ПЖ, что позволяет изложить некоторые соображения по поводу эффективности и целесообразности этих вмешательств [2].
Материал и методы
За период с 2009 по 2017 г. в учреждении оперированы 93 пациента с различными опухолями ПЖ. Предоперационное обследование включало УЗИ, КТ с внутривенным контрастированием.
При необходимости к диагностическому поиску добавляли МРТ, эндо-УЗИ, артериально-стимулированный забор крови, пункционную биопсию. Операции выполняли на роботическом комплексе Da Vinci S неизменным коллективом специалистов. В состав операционной бригады входили 3 хирурга и операционная сестра, анестезиолог, реаниматолог, эндокринолог. При обнаружении в послеоперационном периоде жидкостных скоплений привлекали специалистов по лучевой диагностике для применения пункционных методов лечения, при аррозионном кровотечении в 5 наблюдениях применили эндоваскулярный гемостаз.
Заболевания, по поводу которых были выполнены робот-ассистированные операции, и ближайшие результаты лечения отражены в табл. 1 и 2. Послеоперационные осложнения развились у 38 больных, основным из которых был панкреатический свищ, на фоне которого следовал каскад последующих осложнений (табл. 3).
Таблица 1. Характеристика клинических наблюдений и робот-ассистированных операций
| Заболевание | Число наблюдений, абс. | ||||
| ПДР | Дистальная резекция | Срединная резекция | Энуклеация опухоли | Панкреатэктомия | |
| Протоковая аденокарцинома | 12 | 7 | - | - | - |
| Нейроэндокринная опухоль | 4 | 16 | 6 | 15 | 1 |
| Солидная псевдопапиллярная опухоль | - | 7 | - | 2 | - |
| Кистозные опухоли | 1 | 16 | - | - | - |
| Другие | - | 3 | - | 2 | 1 |
| Итого | 17 | 49 | 6 | 19 | 2 |
Таблица 2. Результаты оперативного лечения
| Показатель | ПДР | Дистальная резекция | Срединная резекция | Энуклеация опухоли | Панкреатэктомия |
| Время операции, мин | 400 (360; 505) | 210 (178; 250) | 268 (213; 281) | 140 (115; 160) |
468 (456; 479) |
| Объем кровопотери, мл | 200 (150; 500) | 100 (50; 300) | 100 (63; 138) | 70 (20; 100) | 550 (425; 675) |
| Число конверсий, абс. (%) | 2 (12) | 1 (2) | - | 1 (5) | - |
| Продолжительность дренирования, сут | 12 (9; 14) |
8 (5; 14) |
12 (8; 15) |
7 (4; 14) |
23 (14; 32) |
| Продолжительность пребывания в стационаре, сут | 16 (14; 25) | 10 (8; 15) | 14 (13; 15) | 12 (7; 17) | 27 (20; 34) |
| Число больных, которым назначали опиоидные анальгетики, абс. (%) | 11 (65) | 20 (41) | 5 (83) | 12 (63) | 1 (50) |
Таблица 3. Характеристика послеоперационных осложнений
|
Заболевание |
Число наблюдений, абс. | ||||
| ПДР | Дистальная резекция | Срединная резекция | Энуклеация опухоли | Панкреатэктомия | |
| Панкреатический свищ тип А | 3 | 17 | 3 | 7 | - |
| Панкреатический свищ тип В | 1 | 3 | - | 1 | - |
| Кровотечение тип В | - | 1 | - | - | - |
| Кровотечение тип С | 1 | 2 | 1 | 1 | - |
| Гастростаз | 6 | - | - | - | 1 |
| Желчный свищ | 1 | - | - | - | 1 |
| Летальный исход | 1 | 1 | - | 1 | - |
Число удаленных лимфатических узлов у больных, оперированных по поводу протоковой аденокарциномы, составило 17 (14; 21). По результатам морфологического исследования состояние R0 было достигнуто у 17 больных из 19. Все данные представлены в виде медианы значений Me с указанием интерквартильного размаха IQR (25%; 75%). Относительно небольшое число операций, выполненных с применением роботического комплекса, связано с ограниченным числом квот высокотехнологичной медицинской помощи, предназначенных для робот-ассистированных операций.
Результаты и обсуждение
При многих положительных качествах роботической хирургии существуют и специфические недостатки, ограничивающие разрешающие способности метода. Явным недостатком является невозможность получения во время операции тактильной информации [3, 4]. Соответственно оценка плотности тканей, поиск опухоли небольшого размера, скрытой в глубине паренхимы ПЖ, затруднены, а порой и невозможны. Очевидным выходом из этой ситуации является применение интраоперационного УЗИ [5]. Однако даже при его выполнении лучевым диагностом, не говоря уже о хирурге, это исследование обладает высокой операторзависимостью, что зачастую не позволяет выйти из сложной диагностической ситуации и приводит в лучшем случае к напрасным потерям времени, в худшем – к диагностическим ошибкам, за которыми следуют интраили послеоперационные осложнения. Размер объекта, подлежащего удалению, является существенным сдерживающим фактором для выполнения робот-ассистированных операций. Например, мобилизация увеличенной за
счет большой опухоли ПЖ требует смещения органа в разные стороны [5, 6]. Для этого необходима фиксация ПЖ зажимом и ее тракция в требуемом направлении. При наложении зажима на ткань ПЖ происходит ее прорезывание, развивается кровотечение. Фиксация за ткань опухоли, если она расположена поверхностно, может приводить к повреждению капсулы, а при кистозной опухоли – вскрытию ее просвета. И тот и другой вариант приводит к нарушению абластики. При плотной капсуле опухоли зажимы не могут быть надежно фиксированы и по- стоянно соскальзывают [4, 7].
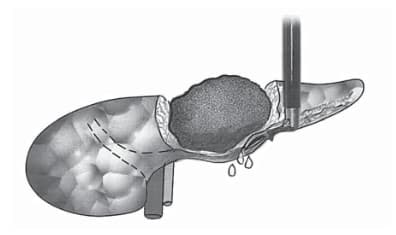
Рис. 1. Работа “вслепую” по задней поверхности опухоли согнутым под 90° зажимом Мериленда представляет опасность повреждения сосудов или капсулы задней поверхности опухоли.
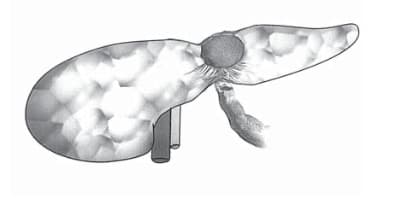
Рис. 2. Энуклеация нейроэндокринной опухоли “на пальце”. Пальцем левой руки, подведенным под ПЖ, опухоль смещается кпереди, что обеспечивает ее контурирование в паренхиме органа и сдавление прилежащих сосудов.
Опухоль небольшого размера (5–7 мм), особенно располагающуюся в глубине паренхимы железы, при роботической операции можно об- наружить только за счет интраоперационного УЗИ, о проблеме которого уже было упомянуто. Определив при УЗИ локализацию опухоли, не- обходимо безошибочно выйти на ее капсулу за счет рассечения здоровой паренхимы железы, что сопровождается кровотечением, для оста- новки которого приходится использовать электрокоагуляцию, что провоцирует послеоперационный панкреатит. Для энуклеации опухоли требуется ее фиксация и смещение кверху. Эти действия при роботической операции не всегда удается обеспечить за счет смещения опухоли боковой поверхностью инструментов, что менее травматично, а фиксация опухоли, всегда имею- щей мягкую консистенцию, зажимом приводит к ее фрагментации. Кроме того, после завершения энуклеации приходится обеспечивать коагуляционный гемостаз в области дна образовавшегося дефекта, что всегда несет опасность повреждения протока ПЖ и развития в дальнейшем панкреатического свища [7]. Перечисленных проблем удается избежать при открытой операции, когда в большинстве наблюдений локализацию опухоли удается определить пальпаторно, а энуклеацию выполнить “на пальце” (рис. 2). Этот прием позволяет существенно уменьшить паренхиматозное кровотечение за счет натяжения и сдавливания ткани и мелких сосудов, а смещение опухоли через ткань железы кверху значительно облегчает ее вылущивание без повреждения капсулы [6]. Считаем, что отсутствие тактильных ощущений и проблемы гемостаза являются ограничением к робот-ассистированным операциям при осложнениях хронического панкреатита [2]. Бес спорна возможность успешного выполнения цистоеюностомии или продольной панкреатоеюностомии. Но при этом вызывает сомнение целесообразность применения дорогостоящего роботического оборудования для выполнения операций, которые с успехом могут быть выполнены лапароскопическим способом. К резекции головки ПЖ с применением как роботического, так и лапароскопического варианта выполнения операций у нас сложилось негативное отношение. Эти вмешательства относятся к разряду сложных, и для достижения хороших отдаленных результатов необходимо обеспечить разумно радикальную резекцию паренхимы головки ПЖ. Объем предполагаемой резекции определяется перед операцией по данным КТ, но достичь желаемого результата во время операции непросто.
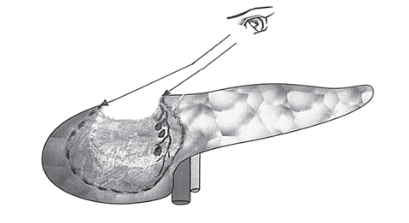 Рис. 3. Источник кровотечения находится на боковой стенке трапециевидной полости вне поля зрения и трудно досягаем для инструментов.
Рис. 3. Источник кровотечения находится на боковой стенке трапециевидной полости вне поля зрения и трудно досягаем для инструментов.
Рис. 4. Аппликация ультразвукового датчика для контроля адекватности резекции головки ПЖ затруднена.
Безошибочное вскрытие протока ПЖ возможно, если он пролабирует через ее паренхиму, но это бывает далеко не у всех больных. Даже существенно расширенный проток, но расположенный ближе к задней поверхности железы, бывает сложно обнаружить; при его поиске может потребоваться несколько рассечений паренхимы, что в дальнейшем затрудняет формирование анастомоза с тощей кишкой. Наибольшие трудности возникают при резекции головки ПЖ. Во-первых, иссечение фрагментов ткани головки всегда сопровождается достаточно интенсивным кровотечением. На начальном этапе резекции, когда образующаяся полость неглубока, обеспечить гемостаз можно как за счет коагуляции, так и прошиванием. По мере углубления образующейся полости, особенно если она приобретает трапециевидную форму, обеспечение гемостаза усложняется. Кровоточащий сосуд оказывается вне зоны пря- мой видимости, а угол атаки инструментов не позволяет подойти к источнику истечения крови, которая заливает поле зрения (рис. 3). В результате время, затрачиваемое на обеспечение гемостаза, возрастает, а объем кровопотери увеличивается. Не меньшие проблемы возникают при оценке адекватности выполняемой резекции головки ПЖ. При открытой операции пальпация позволяет определить остающийся объем ткани железы, кальцинаты в ней и камни в протоке ПЖ. При робот-ассистированной и лапароскопической резекции адекватно определить перечисленное невозможно. Применение интраоперационного УЗИ затруднено, поскольку за счет сформированной полости создаются сложности при аппликации ультразвукового датчика к зоне резекции (рис. 4). В результате при миниинвазивных вмешательствах возрастает вероятность выполнения нерадикальной операции вследствие оставления избыточной паренхимы железы, блокирующих проток конкрементов. Практика показывает, что использование роботического комплекса позволяет добиться оптимальных результатов при протоковой аденокарциноме ПЖ Т1–Т2. Возможности комплекса обеспечивают адекватную лимфаденэктомию с удалением до 36 лимфатических узлов [2]. Доброкачественные опухоли и новообразования с низким потенциалом злокачественности можно успешно удалять при их размере не более 5–6 см. Превышение указанных ограничений приводит к нарушению онкологических требований или несет опасность интра- и послеоперационных осложнений. Стационар, в котором оперируют больных опухолями ПЖ и хроническим панкреатитом, должен обеспечивать высококвалифицированную лучевую диагностику, что позволяет точно формулировать показания к робот-ассистированным операциям. Лечение следует выполнять командой с постоянным составом участников (хирурги, анестезиолог, реаниматолог, эндокринолог, эндоваскулярный хирург), обладающих высоким уровнем специальной профессиональной подготовки [2, 4, 6].
Заключение
Применение роботического комплекса позволяет безопасно выполнять весь спектр радикальных операций, которые требуются при опухолях ПЖ, – от энуклеации опухоли до панкреатэктомии. Для достижения оптимального результата хирургического лечения необходимо трезво оценивать возможности этой технологии. Превышение разумных пределов влечет за собой спектр негативных последствий и дискредитирует миниинвазивную хирургию. Операции на ПЖ, независимо от способа выполнения, следует выполнять только в специализированных центрах, что требует организации строгой маршрутизации больных.
Конфликт интересов
Все авторы заявляют об отсутствии конфликта интересов. Ответственность за предоставленную информацию несут только авторы публикации.