Робот-ассистированные операции на поджелудочной железе (обзор литературы)
Цель исследования: систематизировать данные мировой литературы о применении робот-ассистированной технологии в хирургии поджелудочной железы.
Материал и методы. Проанализирована 31 публикация за период с 2010 по 2014 г. В работах освещен опыт 856 робот-ассистированных операций на поджелудочной железе.
Результаты. Наибольшее число робот-ассистированных операций на поджелудочной железе (90%) составляют панкреатодуоденальная и дистальная резекции – 55 и 35% соответственно. Средняя продолжительность робот-ассистированной панкреатодуоденальной резекции составила 342 ± 209 мин, дистальной резекции – 200 ± 131,9 мин. Средняя величина кровопотери при робот-ассистированной операции относилась к I степени тяжести согласно классификации ВОЗ 2001 г. Отмечено увеличение числа осложнений после робот-ассисти- рованных вмешательств по мере увеличения числа операций на поджелудочной железе.
Заключение. Проведенный анализ литературы демонстрирует возрастающий интерес хирургов-панкреатологов к использованию робототехники. В то же время отсутствует единая концепция применения роботического комплекса в хирургии поджелудочной железы, не сформулированы четкие показания и противопоказания к робот-ассистированным операциям на поджелудочной железе. Отсутствует методологическая база, описывающая технические аспекты выполнения этих сложных вмешательств. Устранение указанных недостатков делает актуальными продолжающиеся исследования по использованию робот-ассистированной технологии.
Введение
Хирургическая панкреатология является одним из наиболее сложных направлений абдоминальной хирургии, а оперативные вмешательства на поджелудочной железе (ПЖ) осуществляют в ограниченном числе клиник. Робот-ассистированные операции (РАО) на ПЖ выполняют в центрах, оснащенных роботизированными комплексами (РК) и обладающих опытом как открытых, так и лапароскопических вмешательств. Число таких учреждений в настоящее время невелико. В медицинских журналах за период с 2010 по 2014 г. была найдена всего 31 публикация, посвященная различным операциям на ПЖ с использованием РК DaVinci1. Проанализированные статьи охватывают 856 РАО на ПЖ [1–41].
Анализ публикаций
Анализ осуществлен для панкреатодуоденальной резекции (ПДР) и дистальной резекции ПЖ (ДРПЖ), составляющих более 90% всех наблюдений (табл. 1). Результаты по остальным РАО на ПЖ рассматривали дополнительно, если информация о них носила достаточно полный характер. В публикациях приведены средние величины по тем операциям, на которых они основаны. Однако различия в размерах выборок крайне ве- лики (от 1 до 250). В качестве средней величины здесь и далее была использована средневзвешенная величина, которую определяли по формуле: В срв i = (∑ ( В срij × Nij )) / ∑ Nij, где В срв i – средневзвешенный показатель для операции i-го вида; В ср ij – средний показатель для операции i-го вида в j-й публикации; Nij – число наблюдений для операции i-го вида, на которых основана j-я публикация. Применение средней величины позволило учесть разное число клинических наблюдений, на которых основаны публикации.
Таблица 1. Робот-ассистированные операции на ПЖ: сводные данные по публикациям
| Операция | Число вмешательств, абс. (%) |
| Панкреатодуоденальная резекция | 474 (55,4) |
| Дистальная резекция | 300 (35,0) |
| Срединная резекция | 48 (5,6) |
| Панкреатэктомия | 23 (2,7) |
| Энуклеация | 11 (1,3) |
| Итого | 856 (100) |
Анализу подвергнуты следующие группы критериев: характеристики пациентов, заболевание, оперативное вмешательство, послеоперационный период. Для сравнения полученных результатов были учтены данные лапароскопических (ЛСО) и традиционных операций (ТрО) на ПЖ. Статистические параметры для ТрО и ЛСО на ПЖ были взяты из современных литературных источников, наиболее полно отражающих особенности этих видов хирургических вмешательств [32–39]. Указанные публикации не учитывали при проведении анализа, поскольку в них отсутствовали данные об использовании РК. Такой подход был применен повсеместно, кроме случаев, когда доля анализируемого критерия была столь мала, что сравнительный анализ представлялся бессмысленным.
Характеристики пациентов
Здесь и далее представлены данные только по тем показателям и видам операций, по которым были репрезентативные результаты. Информация о среднем возрасте пациентов, половой принадлежности, индексе массы тела (ИМТ) приведена практически во всех публикациях (табл. 2). Аналогичные показатели имеются и в группах ЛСО и ТрО на ПЖ. Средний возраст пациентов при ЛС ПДР и Тр ПДР составил 62 и 67 лет; при ЛС ДРПЖ и Тр ДРПЖ – 52 и 58 лет. ИМТ у больных, оперированных с помощью РК, составил 25,9–26,4 кг/м2. Следовательно, все пациенты, перенесшие РАО на ПЖ, имели нормальную или избыточную массу тела (предожирение). Больных с ожирением среди оперированных не было. Информация о сопутствующих заболеваниях, стратификации по ASA, наличии предшествующих операций, билиарной гипертензии, пред- операционном дренировании желчных путей, диаметре панкреатического протока и консистенции ПЖ не подвергалась анализу по причине низкой регистрации этих параметров в анализируемых публикациях.
Таблица 2. Характеристика пациентов, перенесших РАО на ПЖ
| Параметр | ПДР | Дистальная резекция |
| Число РАО, абс. | 474 | 300 |
| Средний возраст больных, лет (s) | 64,1 (4,2) | 58,2 (10,3) |
| Доля мужчин, % | 50 | 43,8 |
| Средний ИМТ, кг/м2 (s) | 25,9 (1,4) | 26,5 (3,4) |
Заболевания
Для анализа того, какие критерии заболевания являются определяющими при использовании РК в хирургии ПЖ, были рассмотрены морфологические данные, а также сведения о размере опухоли. В табл. 3 приведены нозологические едини- цы, при которых выполняли РАО на ПЖ. В некоторых публикациях часть необходимой ин- формации о диагнозе отсутствовала. Поэтому здесь и в других аналогичных ситуациях число наблюдений для каждого диагноза делили на скорректированное число операций этого вида (ПДР, ДРПЖ). Для этого из общего числа однотипных вмешательств вычитали число наблюдений, соответствующая информация по которым отсутствовала. В результате сумма долей диагнозов, приходящихся на каждый из видов РАО на ПЖ, могла не равняться 100%.
Таблица 3. Диагноз при РАО на ПЖ
| Диагноз | Число наблюдений, % | ||
| ПДР | Дистальная резекция | Срединная резекция | |
| Рак ПЖ | 57* | 23,9 | - |
| Нейроэндокринные опухоли | 6,1 | 29,0 | 24,0 |
| IPMN | 11,3 | 20,0 | 4,0 |
| Доброкачественные кистозные опухоли | 4,6 | 22,6 | 52,0 |
| Хронический панкреатит | 5,8 | 0,6 | - |
| Другие | 14,4 | 11,6 | 20,0 |
Примечание: * для РА ПДР включена аденокарцинома БСДПК и терминального отдела ОЖП.
Таблица 4. Объем робот-ассистированного этапа при РА ПДР
| Объем РА этапа | Число наблюдений, % |
| Только РА мобилизация | 5,5 |
| Только РА реконструкция | 38,2 |
| Полностью РА вмешательство | 56,3 |
Таблица 5. Панкреатодигестивные анастамозы и склерозирование ППЖ при РА ПДР
| Процедура | Число наблюдений, абс. (%) |
| Панкреатогастроанастомоз | 44 (21) |
| Панкреатоеюноанастомоз | 100 (48) |
| Склерозирование ППЖ | 65 (31) |
| Итого | 209 (100) |
Таблица 6. Продолжительность вмешательств на ПЖ с использованием РК и объем кровопотери
| Вмешательство | Число наблюдений, абс. | Продолжительность, мин (min–max; s) | Объем кровопотери, мл (min–max; s) |
| ПДР | 474 | 484 (240–980; 98,2) | 342 (100–800; 209) |
| Дистальная резекция | 300 | 278 (180–720; 82,7) | 200 (100–475; 131,9) |
| Срединная резекция | 48 | 337 (150–506; 101,6) | 201 (158–300; 50,2) |
ПДР чаще (57%) выполняли по поводу рака головки ПЖ, большого сосочка двенадцатиперстной кишки (БСДПК), терминального отдела общего желчного протока (ОЖП). Аналогичная ситуация была при выполнении ЛС ПДР (46–64%) и Тр ПДР (65%). РА ДРПЖ чаще выполняли по поводу нейроэндокринных опухолей – 29%. Рак ПЖ (23,9%), доброкачественные кистозные (22,6%) и внутрипротоковые папиллярно-муцинозные опухоли (20%) представлены приблизительно с одинаковой частотой. ЛС ДРПЖ чаще выполняли при доброкачественных кистозных опухолях (37– 57%). Тр ДРПЖ по поводу аденокарциномы выполняли в половине наблюдений (47%), по поводу кистозных опухолей – в 36%. Большая доля больных, оперированных по поводу рака в группе РА ДРПЖ, может объясняться техническими преимуществами РК перед лапароскопией, что увеличивает радикальность хирургического вмешательства. Размеры опухолей ПЖ приведены в усредненном виде по каждой публикации. Средние размеры варьировали от 1,5 до 4 см. По данным литературы средний размер опухоли при ЛС ПДР и ЛС ДРПЖ составил 2,7 и 3 см. При ТрО на ПЖ этот показатель не являлся определяющим критерием.
Оперативное вмешательство
Характер оперативного вмешательства был отражен во всех публикациях. Распределение на гПДР и пПДР отмечено в 8 статьях из 17, что со- ставило 42,2%. Число гПДР более чем в 2 раза превышало пПДР. При ЛСО тенденция была об- ратной – пПДР выполняли в 6 раз чаще, чем гПДР, а при ТрО – в 1,4 раза. Указания об объеме робот-ассистированного этапа операции были представлены в 65% публикаций (табл. 4). На всех этапах хирургического вмешательства РК использовался в 56,3% наблюдений. На реконструктивном этапе ПДР РК применяли в 38,2% наблюдений; мобилизацию панкреатодуоденального комплекса при этом выполняли лапароскопически. Только мобилизацию комплекса с применением РК осуществляли в 5,5% случаев. Характер формирования панкреатодигестивного анастомоза и состояние протока поджелудочной железы (ППЖ) отражены в табл. 5.
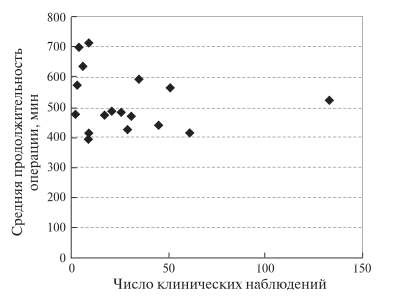
Рис. 1. Диаграмма. Зависимость средней (в публикации) продолжительности РА ПДР от числа учтенных клинических наблюдений.
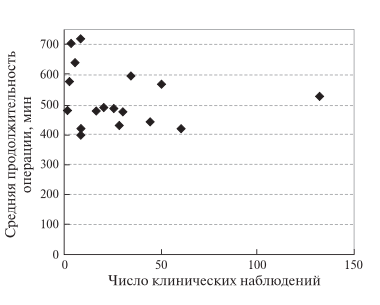 Рис. 2. Диаграмма. Зависимость средней (в публикации) продолжительности РА ДРПЖ от числа учтенных клинических наблюдений.
Рис. 2. Диаграмма. Зависимость средней (в публикации) продолжительности РА ДРПЖ от числа учтенных клинических наблюдений.
Большинство хирургов (69%) формировали панкреатоеюно- или панкреатогастроанастомоз. В трети наблюдений склерозировали ППЖ био- логическим клеем. Авторы прибегали к такому способу при нитевидном ППЖ и рыхлой неизмененной паренхиме ПЖ. Указанные результаты демонстрируют преимущества РК перед стандартной лапароскопической техникой на всех этапах хирургического вмешательства на ПЖ, особенно при формировании анастомозов. Продолжительность различных видов РАО на ПЖ приведена в табл. 6. Среднее время ЛС ПДР составляло от 487 ± 121,9 до 541 ± 88 мин, Тр ПДР – 401 ± 108 мин. РА ПДР выполняли за одинаковое или меньшее время по сравнению с ЛСО и незначительно дольше, чем ТрО. Средняя продолжительность ЛС ДРПЖ составила 200 мин, Тр ДРПЖ – 258 мин. Увеличение времени РА ДРПЖ, по-видимому, было связано с большим числом операций, выполняемых по поводу рака ПЖ, что требовало лимфаденэктомии. Для анализа были построены графики зависимости средней (по публикации) продолжительности РА ПДР и РА ДРПЖ от числа операций, на которых основана соответствующая статья (рис. 1, 2). По мере накопления опыта разброс продолжительности РА ПДР и РА ДРПЖ уменьшается и постепенно стремится к среднему значению по всей выборке. При достижении уровня 50 РАО средняя продолжительность вмешательства в конкретной публикации отклоняется от средней величины по всем статьям менее чем на 20%. Это соответствует стандартным отклонениям. Полученный результат демонстрирует, после скольких РАО одного вида время операции начинает соответствовать средним мировым значениям.
Величина кровопотери для различных видов РАО на ПЖ также приведена в табл. 6. Средняя кровопотеря при РА ПДР относилась к I степени тяжести согласно классификации ВОЗ 2001 г.2 Число наблюдений РА ПДР, в которых величина кровопотери относилась ко II степени (более 750 мл), было крайне мало (рис. 3). Кровопотеря при РА ДРПЖ и РА срединной резекции ПЖ также относилась к I степени тяжести. При ЛС ПДР объем кровопотери составил в среднем 240 мл (30–1200 мл), при Тр ПДР – 1032 ± 1151 мл. Средняя кровопотеря при ЛС ДРПЖ – 150–300 мл (50–700 мл), при Тр ДРПЖ – 350–450 мл. Анализируемый показатель в группах РАО имел сопоставимое среднее значение, при этом максимальное значение кровопотери при РА ПДР и РА ДРПЖ было значительно ниже. Выявленная тенденция свидетельствует о большей прецизионности РК по сравнению с лапароскопической и традиционной технологиями. При анализе выявлена зависимость величины кровопотери от числа проведенных операций, аналогичная продолжительности РАО (рис. 4). При достижении уровня 50 РАО величина кровопотери отличалась от среднего показателя по всей выборке менее чем на 20%. Кроме того, при меньшем числе клинических наблюдений прослеживалось преобладание операций с большей кровопотерей по сравнению со средней величиной по всей выборке. Другие особенности РАО на ПЖ представлены в табл. 7. ЛС ДРПЖ с сохранением селезенки выполняли в 21–72% наблюдений, Тр ДРПЖ – в 14– 16%. РК позволяет улучшить этот показатель по сравнению с ТрО и ЛСО. Конверсию на ТрО при ЛС ДРПЖ приходи- лось выполнять в 15–30% наблюдений, при ЛС ПДР – в 15%. РАО снижает этот риск в 2–3 раза. При РА ПДР только в 2,7% наблюдений операция включала резекцию верхней брыжеечной или воротной вены. В настоящее время инвазия опухоли в указанные сосуды рассматривается большинством хирургов как противопоказание к применению миниинвазивных технологий (РАО, ЛСО).
Таблица 7. Особенности РАО на ПЖ
| Анализируемый параметр | ПДР | Дистальная резекция |
| Частота сохранения селезенки, % | - | 43,2 |
| Применение техники Warshaw, % | - | 6,1 |
| Частота трансфузии эритроцитарной массы, % | 19,5 | 10,1 |
| Частота конверсии, % | 9,3 | 6,8 |
| Частота резекции верхней брыжеечной вены – воротной вены, % | 2,7 | - |
| Частота R0, % (s) | 94 (8,17) | 82 (37,1) |
| Число удаленных лимфоузлов, абс. (s) | 18 (5,7) | 12 (5,6) |
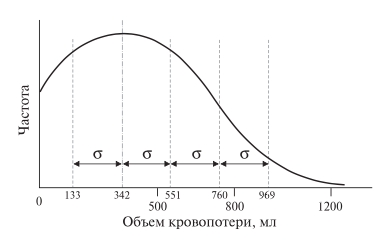 Рис. 3. Диаграмма. Распределение величины кровопоте- ри при РА ПДР.
Рис. 3. Диаграмма. Распределение величины кровопоте- ри при РА ПДР.
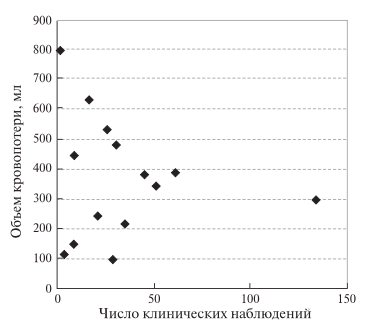 Рис. 4. Диаграмма. Зависимость средней (в публикации) кровопотери при РА ПДР от числа клинических наблю- дений.
Рис. 4. Диаграмма. Зависимость средней (в публикации) кровопотери при РА ПДР от числа клинических наблю- дений.
Выполнение ЛС ПДР и Тр ПДР в объеме R0 отмечено в 89–96 и 83% наблюдений соответственно. Среднее число удаленных лимфатических узлов при ЛС ПДР составило 13–15, при ТрПДР–16,8,ЛСДРПЖ–6–8,ТрДРПЖ– 5–6. При РАО выявлено увеличение этих показателей по сравнению со всеми указанными группами. На основании этого можно судить о преимуществах РК с онкологической точки зрения.
Послеоперационный период
Особенности течения послеоперационного периода РАО на ПЖ отражены в табл. 8. При ЛС ПДР послеоперационные осложнения развивались с частотой 27–77%, при ЛС ДРПЖ – 27–57%, Тр ДРПЖ – 30–40%. Анализируемый показатель в группах РАО и ЛСО имел сопоставимое среднее значение, при этом максимальное значение меньше при использовании РК.
Таблица 8. Характеристика послеоперационного периода РАО на ПЖ
| Параметр | ПДР | Дистальная резекция | Срединная резекция |
| Частота осложнений, % | 48,4 | 48,4 | 71,1 |
| Частота повторных операций, % | 6 | 2,5 | 2 |
| Частота осложнений I–II по Clavien, % | 36,1 | – | 61,5 |
| Частота осложнений III–IV по Clavien, % | 21,6 | – | 15,4 |
| Частота формирования свищей, % | 21,4 | 29,3 | 70,8 |
| Тип A | 10 | 18,7 | 22,9 |
| Тип B | 5,5 | 8,8 | 11,4 |
| Тип C | 4,5 | 4,1 | 2,9 |
| Частота желчеистечения, % | 2,8 | – | – |
| Летальность (90 дней), % | 3,1 | 0 | 0 |
| Продолжительность госпитализации после операции, дней (s) | 14 (9,1) | 9 (6,3) | 15 (6,2) |
Летальность при ЛС ПДР варьировала от 1,6 до 5,7%, при Тр ПДР достигала 8,8%. ЛС ДРПЖ характеризовались отсутствием смертности в послеоперационном периоде. При Тр ДРПЖ этот показатель меньше 1%. После РА ПДР зафиксировано почти трехкратное уменьшение летальности при сопоставлении с ТрО, а также уменьшение максимального значения показателя по сравнению с ЛСО. Средняя продолжительность пребывания в стационаре после операции в группах РАО (ПДР, ДРПЖ) соответствовала таковой в контрольных группах: ЛС ПДР – 8–15 сут, Тр ПДР – 12–13, ЛС ДРПЖ – 5–11, Тр ДРПЖ – 7–10 сут. При этом отметили тенденцию к уменьшению послеоперационного пребывания в стационаре в группе РА ПДР по мере накопления опыта (рис. 5). Отмечено увеличение числа осложнений после РАО по мере увеличения числа операций на ПЖ, осуществленных конкретной хирургической бригадой (рис. 6). Эта тенденция, по- видимому, обусловлена тем, что хирурги начина- ли выполнять технически более сложные операции. Указанная тенденция прослеживалась также для числа летальных исходов в течение 90 дней после РА ПДР (рис. 7). Если не учитывать точку с 50% летальностью (одно из двух клинических наблюдений, которые легли в основу публикации), то заметен постепенный рост летальности после РАО, который начинал про- являться у достаточно опытных хирургов (более 20 РА ПДР).
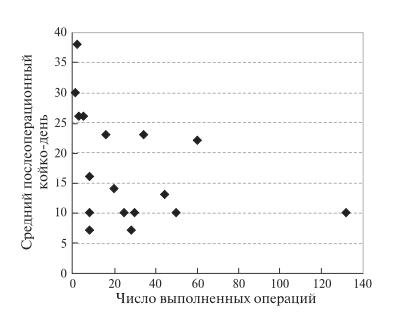 Рис. 5. Диаграмма. Зависимость средней продолжительности пребывания в стационаре (по публикации) после РА ПДР от числа операций, выполненных одной хирургической бригадой.
Рис. 5. Диаграмма. Зависимость средней продолжительности пребывания в стационаре (по публикации) после РА ПДР от числа операций, выполненных одной хирургической бригадой.
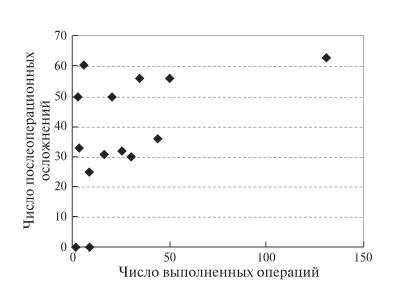 Рис. 6. Диаграмма. Зависимость числа послеоперационных осложнений от числа РА ПДР, выполненных одной хирургической бригадой.
Рис. 6. Диаграмма. Зависимость числа послеоперационных осложнений от числа РА ПДР, выполненных одной хирургической бригадой.
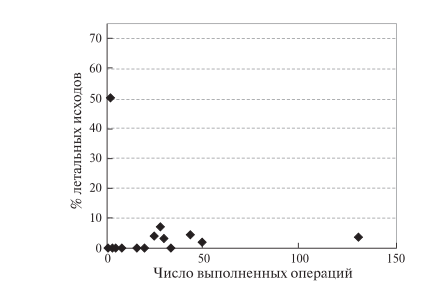 Рис. 7. Диаграмма. Зависимость летальности от числа РА ПДР, выполненных одной хирургической бригадой.
Рис. 7. Диаграмма. Зависимость летальности от числа РА ПДР, выполненных одной хирургической бригадой.
Отмечено формирование двух противоположных тенденций. По мере накопления опыта РАО сокращается время хирургического вмешательства и объем кровопотери, но увеличивается число послеоперационных осложнений и летальность. Считаем, что это связано с тем, что по мере освоения РК и роста профессионализма хирургических бригад происходит усложнение РАО за счет увеличения следующих показателей:
– число удаляемых лимфоузлов (рис. 8);
– число злокачественных опухолей (рис. 9);
– средний возраст пациентов (рис. 10);
– число вмешательств, выполненных полностью роботически.
Рис. 11 не только отражает рост полностью РА вмешательств по мере накопления опыта, но и демонстрирует отсутствие подобной зависимости в ряде публикаций. Точки на оси Х соответствуют тем ситуациям, в которых РК использует- ся только на одном из этапов РАО. При этом опыт клиники может достигать 30 РА ПДР. Это объясняется изначально разными техническими подходами к выполнению РА ПДР. Стационары, выполняющие РА вмешательства полностью, увеличивали их число по мере накопления опыта. Операционные бригады, которые использовали РК на том или ином этапе ПДР, как правило, не меняли свою технику с увеличением числа РАО.
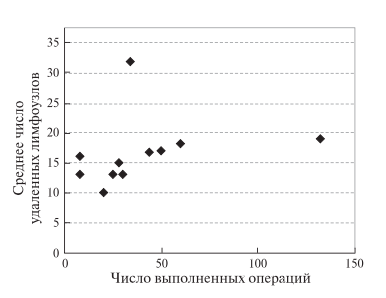 Рис. 8. Диаграмма. Зависимость среднего числа удаляемых при РА ПДР лимфоузлов от числа операций, выполненных одной хирургической бригадой.
Рис. 8. Диаграмма. Зависимость среднего числа удаляемых при РА ПДР лимфоузлов от числа операций, выполненных одной хирургической бригадой.
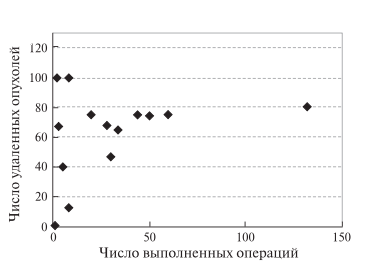 Рис. 9. Диаграмма. Зависимость числа удаленных при РА ПДР злокачественных опухолей от числа операций, выполненных одной хирургической бригадой.
Рис. 9. Диаграмма. Зависимость числа удаленных при РА ПДР злокачественных опухолей от числа операций, выполненных одной хирургической бригадой.
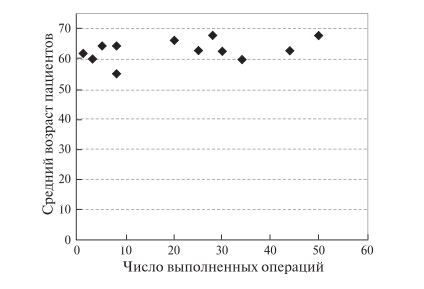 Рис. 10. Диаграмма. Зависимость среднего возраста пациентов, перенесших РА ПДР, от числа операций, выполненных одной хирургической бригадой.
Рис. 10. Диаграмма. Зависимость среднего возраста пациентов, перенесших РА ПДР, от числа операций, выполненных одной хирургической бригадой.
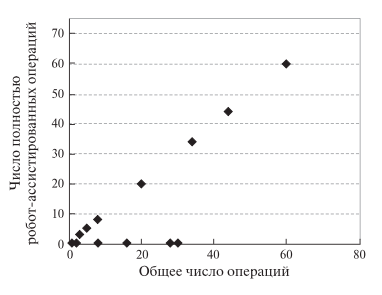 Рис. 11. Диаграмма. Зависимость числа полностью роботических ПДР от числа операций, выполненных одной хирургической бригадой.
Рис. 11. Диаграмма. Зависимость числа полностью роботических ПДР от числа операций, выполненных одной хирургической бригадой.
Заключение
Проведенный анализ литературы демонстрирует возрастающий интерес хирургов-панкреатологов к роботической технике. В то же время отсутствует единая концепция применения РК в хирургии ПЖ, не сформулированы четкие по-казания и противопоказания к РАО на ПЖ, отсутствует методологическая база технических аспектов этих сложных вмешательств. Устранение указанных недостатков делает актуальными продолжающиеся исследования применения РА технологии.