Применение хирургической робот-системы при удалении опухоли орбиты (случай из практики)
Введение
Появление роботизированной хирургии обусловило резкий скачок в развитии хирургии. По значимости это событие сопоставимо с изобретением анестезии. Оно также внесло весомый вклад в развитие малоинвазивной хирургии [1]. Первым в мире хирургическим роботом стал Arthrobot, разработанный в 1983 г. и предназначенный для ассистенции при ортопедических операциях. В 1985 г. был создан робот PUMA 560 (Unimate, США) для точного позиционирования иглы при биопсии опухолей головного мозга под контролем компьютерной томографии. За ним в 1988 г. последовал Robodoc (Integrated Surgical Systems, США) – система для ассистенции при эндопротезировании тазобедренного сустава.
Далее, в 1988 г., в Имперском колледже (Лондон, Великобритания), с помощью системы Probot была выполнена первая роботизированная трансуретральная операция. В 1993 г. Computer Motion (США) выпустила Aesop – робототехническую руку для удержания и позиционирования камеры при лапароскопических операциях. А в 1994 г. был выпущен кибернож Cyber Knife (Accuray, США) для стереотаксической радионейрохирургии. 1998 г. стал важной вехой в развитии роботохирургии: были внедрены системы Zeus (Computer Motion, США) и da Vinci (Intuitive Surgical, США). Обе системы включали консоль управления и «руки»-манипуляторы. Первая операция с использованием da Vinci состоялась в Германии в 1998 г. и представляла собой шунтирование коронарных артерий [2].
На сегодня роботизированной хирургии посвящены более 4 тыс. публикаций в рецензируемых журналах, из них 46 % – по проблемам урологии, 17 % – кардиоторакальной хирургии, 13 % – общей хирургии, 8 % – гинекологии, 4 % – детской хирургии, 2 % – оториноларингологии, а 7 % – по иной хирургической тематике (включая исходы, тенденции, соотношение затрат и эффективности для различных типов роботов) [3, 4]. Если в хирургии органов малого таза робот da Vinci применяется давно, то в хирургии основания черепа и пазух носа это пока довольно редкое явление, которое носит на данный момент скорее экспериментальный характер. Известны следующие методики и доступы, опробованные на трупах людей и животных. Хирургический подход к передней черепной ямке с использованием робота da Vinci описали в 2007 г. E.Y. Hanna и соавт. Доступ осуществляется через двусторонние верхние вестибулярные разрезы. Затем выполняют остеотомию передней стенки верхнечелюстных пазух в области fossa canina. Далее, также с обеих сторон, выполняют миатотомии из верхнечелюстных пазух в полость носа для введения инструментов. После резекции задней части перегородки носа через один носовой ход вводят 3D-камеру диаметром 5 мм. Такой подход обеспечивает доступ к решетчатому лабиринту, клиновидной пазухе, турецкому седлу, супраселлярной и параселлярной областям и продырявленной пластинке решетчатой кости [5]. Шейный-трансоральный подход к основанию черепа с использованием робота da Vinci предложили в 2007 г. B.W. O’Malley и G.S. Weinstein. «Руки» робота вводят в ротоглотку через порты, расположенные по заднему краю подчелюстных слюнных желез, 3D-камеру вводят трансорально. По мнению авторов, данная методика позволяет выполнять резекции в селлярной, супраселлярной и параселлярной областях с хорошей визуализацией переднего основания черепа [6]. Полностью трансоральный подход описали в 2010 г. J.Y. Lee и соавт. Камеру и инструменты вводят трансорально. После с помощью резиновых трубок, пропущенных через нос и ротовую полость, аналогично выполнению задней тампонады носа, смещают мягкое небо [7]. Это единственный малоинвазивный подход, позволяющий использовать робота da Vinci в хирургии средней черепной ямки, но данная методика не обеспечивает доступ к среднему и переднему отделам передней черепной ямки и орбитам. Доступ к подвисочной ямке предложен в 2010 г. R.R. McCool и соавт. При этом доступе одну «руку» робота вводят через разрез, находящийся над подъязычной костью, в валекулу, а затем в рото- и носоглотку; камеру и вторую «руку» – трансорально [8]. Данный подход обеспечивает хороший доступ к инфратемпоральной ямке благодаря визуализации и сохранению всех критических структур (III ветви тройничного не- рва, XI и XII пар черепных нервов, внутренней сонной артерии и внутренней яремной вены). Остальные методики и доступы к структурам основания черепа остаются на уровне экспериментов с использованием прототипов роботов на трупах людей и животных. Применение хирургических роботов для доступа к тканям орбиты и проведения манипуляций на орбите в научной литературе мы не встретили. В связи с этим представляем собственное клиническое наблюдение пациента с опухолью орбиты, который был прооперирован с применением хирургического робота da Vinci.
Клиническое наблюдение
В клинику Башкирского государственного медицинского университета обратился пациент с жалобами на опущение верхнего века слева и смещение левого глазного яблока книзу и кнутри. При этом двоение в глазах отсутствовало.
Птоз верхнего века появился после травмы лицевого черепа в 1994 г. (падения с мотоцикла и удара левой половиной лица о камень с потерей сознания). Птоз нарастал очень медленно, но в январе 2019 г. значительно уси- лился, что и стало поводом для обращения пациента за медицинской помощью. При осмотре установлено: острота зрения с коррекцией на правом глазу 1,0, на левом – 0,7 (что связано, скорее всего, с обскурационной амблиопией). Выраженный птоз, глазное яблоко смещено книзу и кнутри, имеется ограничение движений левого глазного яблока кнаружи и кверху (рис. 1). По данным компьютерной томографии, опухоль оссифицирована, примерные размеры – 3 × 2 см (рис. 2).
После обследования и установки клинического диагноза опухоли орбиты была выполнена костно-пластическая орбитотомия, робот-ассистированное удаление опухоли.
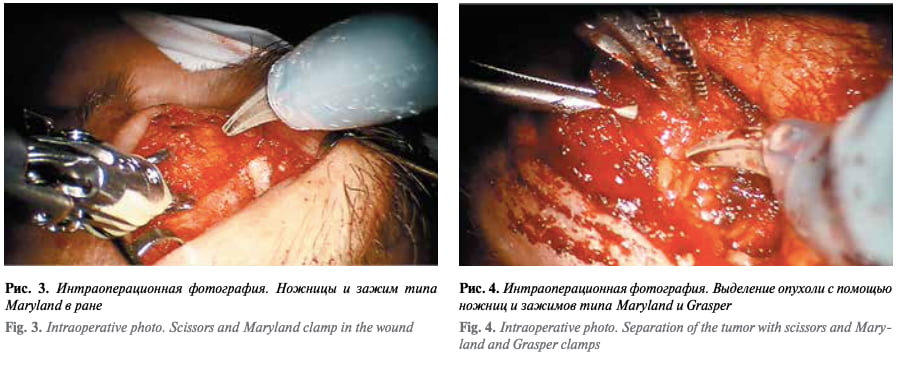
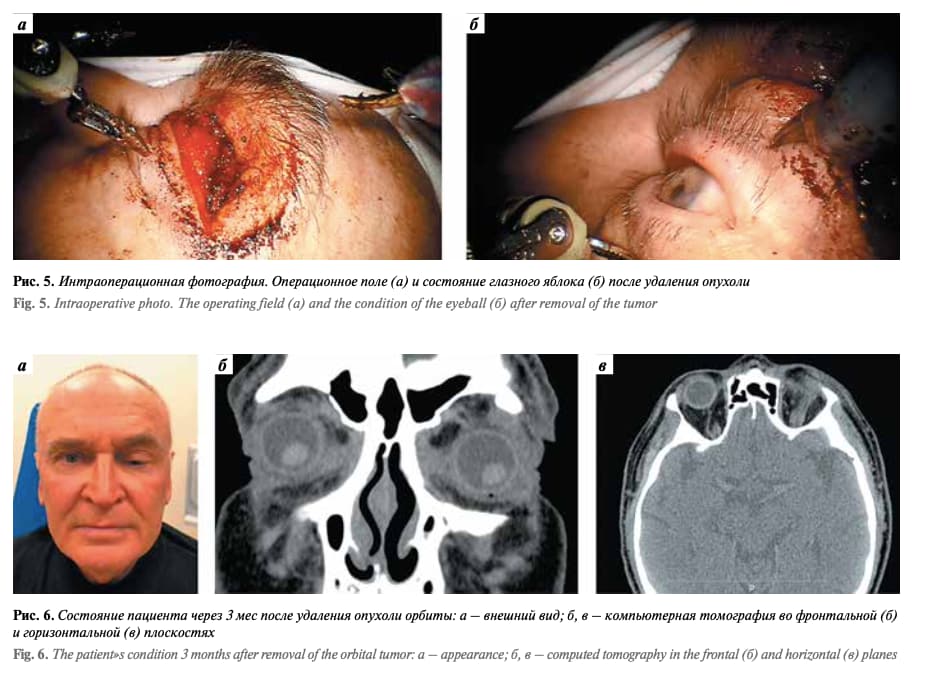
Проведен косметический разрез кожи длиной 1,5 см по складке верхнего века. Затем выполнена костно-пластическая орбитотомия с помощью боров и долота. После установлена роботическая система da Vinci. В рану введены инструменты: ножницы, одновременно выполняющие функцию монополярного коагулятора, и зажим типа Maryland, выполняющий функцию биполярного коагулятора (рис. 3). С помощью ножниц рассечена над- костница, с помощью ножниц и зажима типа Maryland выделен наружный край опухоли, который затем взят на зажим типа Grasper (рис. 4). Опухоль костной плотности. С помощью ножниц и зажима типа Maryland вы- делены и коагулированы сосуды, идущие к опухоли, также выделены и перерезаны протоки слезной железы. Опухоль плотно спаяна с леватором верхнего века на всем протяжении. Выведен из раны инструмент типа Grasper, опухоль взята на зажим типа Maryland и с помощью ножниц, используемых как монополярный коагулятор, полностью отделена от леватора верхнего века. Вид операционного поля и состояние глазного яблока после удаления опухоли представлены на рис. 5. Удаленный костный фрагмент установлен на место и фиксирован узловыми швами к краям кости через пропилы в кости. Рана послойно ушита, установлен перчаточный дренаж.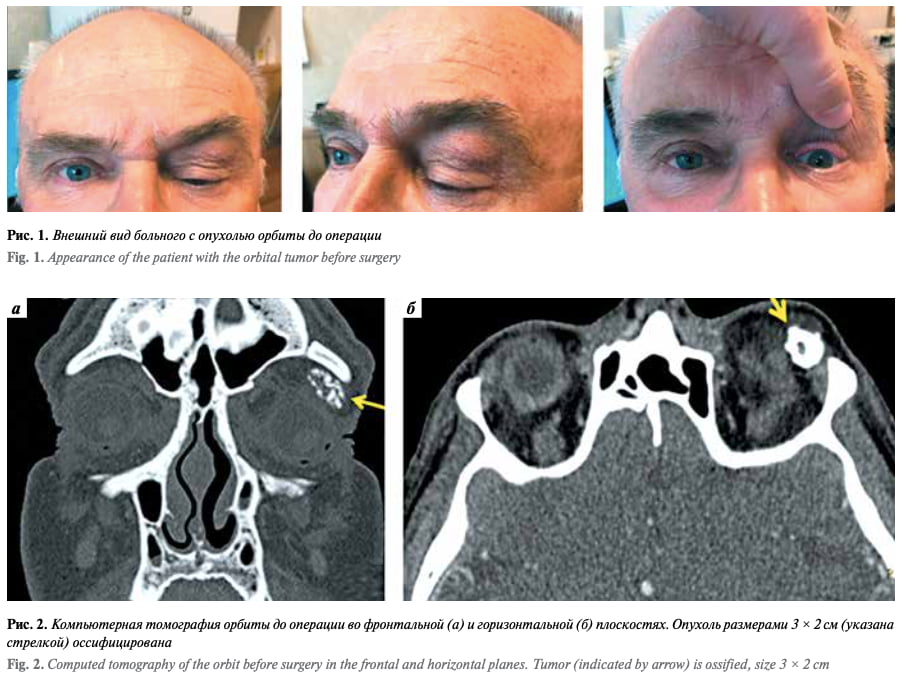
В ходе операции не потребовалось использование микроскопа, так как система da Vinci имеет функцию увеличения, которого оказалось достаточно для работы в орбитальном пространстве. В процессе операции также не проводилась инсуффляция операционной полости. В послеоперационном периоде единственный перчаточный дренаж выпал в 1-е сутки, и на 3-и сутки в ране скопилась прозрачная слеза. Для оттока слезы под мест- ной анестезией со стороны свода конъюнктивы была установлена силиконовая трубочка диаметром 1 мм, которая была удалена на 10-е сутки. При осмотре примерно через 1 мес зрение на оперированном глазу улучшилось с 0,7 до 1,0. Движение левого глазного яблока восстановилось в полном объеме, двоение отсутствовало (рис. 6).
Заключение
Хотя в процессе операции мы использовали все 3 «руки» робота, в ключевые моменты мы пользовались в основном 2 «руками», так как операционное поле было узким и глубоким, и для 3 «рук» не всегда хватало места. Возможно, при использовании инструментов меньшего калибра этого бы не произошло. Явными преимуществами, которые давало применение хирургического робота, были огромный диапазон регулировки и легкость постановки камеры, достаточное для та- кой операции увеличение (хотя и хотелось большего), возможность выполнения операции небольшим набором инструментов, одновременное использование биполярного и монополярного коагуляторов без из- влечения из раны и смены инструментов, а также отсутствие даже минимального кровотечения, ухудшающего видимость.
По нашему мнению, дальнейшее развитие роботизированной хирургии орбиты и основания черепа пойдет по пути миниатюризации инструмента и манипуляторов робота, а также увеличения разрешающей способности камеры робота (комфортное увеличение для работы в данной области – 12–18-кратное).








