Использование робот-ассистированного доступа для выполнения резекций легких
Видеоторакоскопия (ВТС) стала основным мини-инвазивным методом в современных торакальных центрах. Данный метод гораздо менее травматичен, чем торакотомия, поскольку позволяет избежать пересечения мышц грудной стенки и использования ранорасширителя, что приводит к уменьшению интенсивности послеоперационной боли, сокращению времени дренирования плевральной полости и ранней реабилитации больных. Однако стандартные видеоторакоскопические инструменты являются жесткими и ограничивают движения хирурга. Кроме того, визуализация операционного поля в большинстве случаев является двухмерной на фоне отсутствия возможности фиксации камеры в одном положении.
Разработка роботизированных хирургических систем позволила преодолеть некоторые ограничения ВТС. В 2002 г. появилась публикация о первой робот-ассистированной лобэктомии 1. Новая технология отличалась наличием улучшенной трехмерной визуализации и стабильной камеры и, помимо того, сделала возможным применение многосуставных инструментов, что сыграло свою роль в популяризации данной технологии для выполнения бронхо- и ангиопластических резекций легких. При этом фильтрация тремора и масштабирование движений позволили осуществлять более точные движения хирургическими инструментами, чем при использовании ВТС.
Основная масса исследований робот-ассистированных операций в торакальной хирургии посвящена хирургическому лечению рака легкого. Эффективность и безопасность новой технологии при этой патологии уже доказаны. Между тем роботизированная хирургия при неонкологических заболеваниях легких, прежде всего инфекционных болезнях и врожденных пороках развития, еще находится на этапе обсуждения.
Цель исследования: изучение непосредственных результатов робот-ассистированных анатомических резекций легких при неонкологических заболеваниях.
Материалы и методы
Характеристика пациентов
В статье ретроспективно проанализированы результаты хирургического лечения 99 пациентов с различными неонкологическими заболеваниями легких, оперированных с использованием робот-ассистированной хирургической системы в Центре торакальной хирургии ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» в период с мая 2013 г. по февраль 2018 г. В исследование были включены 69 мужчин (69,7%) и 30 женщин (30,3%). Средний возраст больных составил 40 ± 14 лет.
Локализация патологического процесса в легочной ткани представлена в таблице 1. Согласно таблице, наиболее часто им была затронута верхняя доля правого легкого.
Таблица 1. Локализация патологических изменений в легких
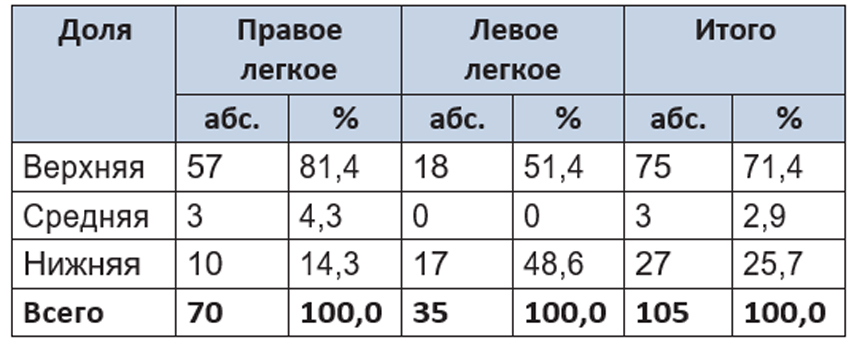
При расположении патологического процесса в пределах анатомических границ сегмента выполнялась анатомическая сегментэктомия. Тотальное поражение доли легкого либо центральное расположение патологических изменений служило показанием к лобэктомии.
Предоперационное обследование всех пациентов соответствовало Национальным клиническим рекомендациям 2. Тактика хирургического лечения и оценка функциональной операбельности в каждом случае обсуждались мультидисциплинарной командой.
Структура заболеваний, ставших причиной обращения в хирургическую клинику, приведена в таблице 2.
Таблица 2. Структура заболеваний легких в исследуемой группе пациентов (n = 99)
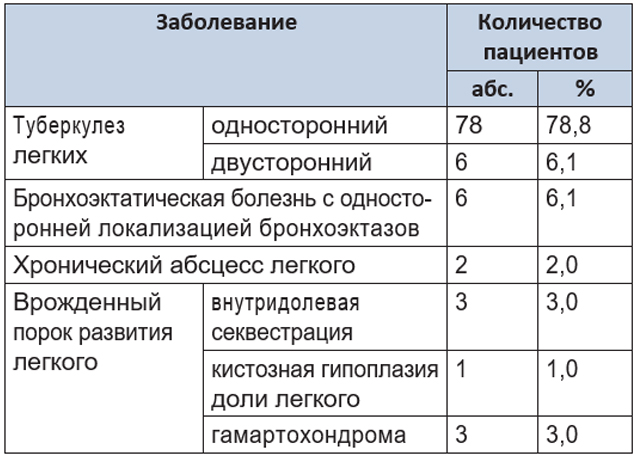
Как видно из таблицы, среди оперированных пациентов наибольшую долю составляли больные туберкулезом легких, что связано прежде всего с профилем торакального центра.
Подробная характеристика данной группы пациентов приведена в таблице 3.
Таблица 3. Характеристика пациентов с туберкулезом легких
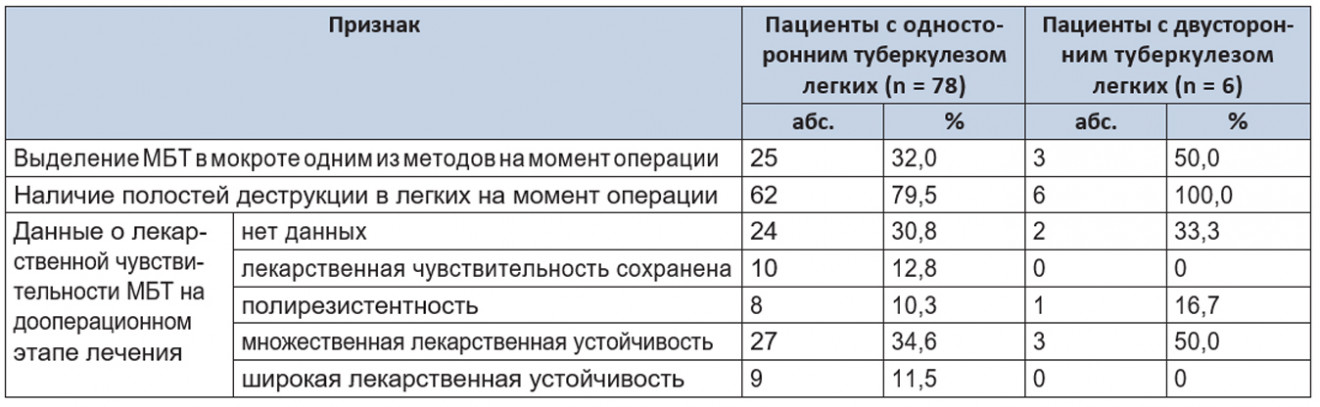
Из таблицы следует, что основным показанием для хирургического лечения туберкулеза легких были полости распада, сохранявшиеся после проведенного курса противотуберкулезной химиотерапии с учетом данных о лекарственной чувствительности МБТ. При этом 30,8% и 33,3% пациентов в группах с односторонним и двусторонним туберкулезом легких соответственно не имели данных о лекарственной чувствительности МБТ к моменту операции, что являлось дополнительным обоснованием хирургического лечения.
В исследовании оценивались длительность операции и кровопотеря, структура и причины конверсии доступа, особенности выполнения робот-ассистированных анатомических резекций легких при различных заболеваниях легких и послеоперационные осложнения.
Методика робот-ассистированного доступа
При выполнении резекций легких использовался робот da Vinci Si (PS3000, Intuitive Surgical). Особенность применения данной системы при манипуляциях в плевральной полости заключается в необходимости позиционирования точек введения троакаров максимально близко к диафрагме для получения оптимальных углов операционного действия. В связи с этим применялась оригинальная методика, опубликованная в 2017 г. в Journal of Visualized Surgery 3. Схема введения троакаров приведена на рисунке 1.
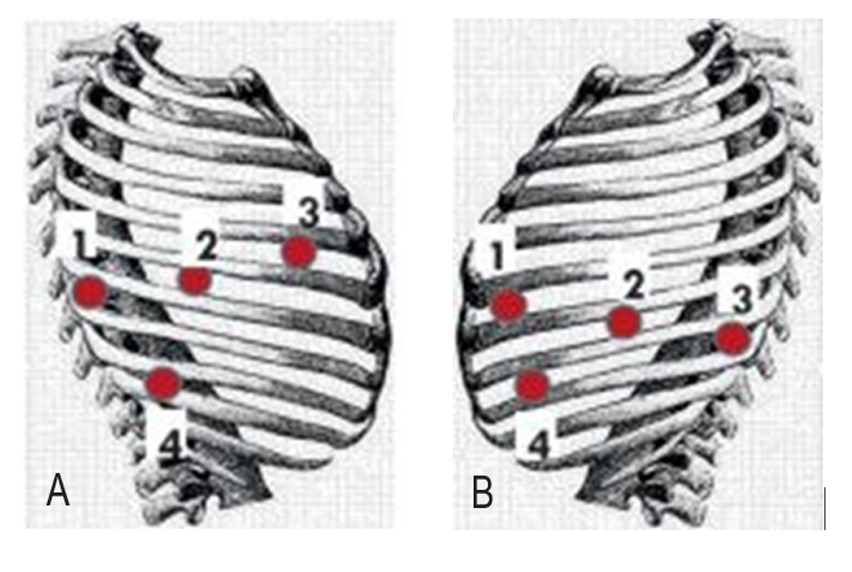 Рис. 1. Расположение точек введения торакопортов в зависимости от локализации патологического процесса.
A — схема робот-ассистированного доступа при локализации патологических изменений в верхней и средней легочных долях.
B — схема робот-ассистированного доступа при локализации патологических изменений в нижней легочной доле.
Примечание. 1, 3 — роботические инструментальные торакопорты; 2 — оптический торакопорт; 4 — ассистентский торакопорт (мини-доступ для удаления препарата)
Рис. 1. Расположение точек введения торакопортов в зависимости от локализации патологического процесса.
A — схема робот-ассистированного доступа при локализации патологических изменений в верхней и средней легочных долях.
B — схема робот-ассистированного доступа при локализации патологических изменений в нижней легочной доле.
Примечание. 1, 3 — роботические инструментальные торакопорты; 2 — оптический торакопорт; 4 — ассистентский торакопорт (мини-доступ для удаления препарата)После установки торакопортов выполнялся докинг консоли пациента, которая устанавливалась под углом 15 градусов по отношению к головному концу операционного стола. После подключения консоли к троакарам и введения инструментов операция продолжалась с использованием робота. Этапы робот-ассистированных операций не отличались от таковых при хирургических вмешательствах, выполняемых видеоторакоскопическим и торакотомным доступом. Операция завершалась установкой одного или двух силиконовых дренажей в зависимости от особенностей аэростаза и расправления легкого.
Результаты
Были выполнены 85 лобэктомий, 10 сегментэктомий, 3 энуклеации гамартохондромы и 1 краевая резекция. Распределение операций по нозологическим группам содержится в таблице 4.
Таблица 4. Структура выполненных операций
Особенности выполнения робот-ассистированных операций при туберкулезе легких
Одним из главных условий выполнения операций при туберкулезе легких было наличие адекватного предоперационного курса противотуберкулезной химиотерапии с учетом данных Национальных клинических рекомендаций 2.
На этапе освоения техники операций в числе первых вмешательств была краевая резекция легкого, выполненная по относительным (социальным) показаниям при субплевральном расположении туберкулемы в верхней доле правого легкого. При этом дальнейшее использование робот-ассистированного четырехпортового доступа при минимальных изменениях в легких было признано нецелесообразным с учетом отсутствия преимуществ перед рутинной ВТС.
Робот-ассистированные сегментэктомии при туберкулезе также выполнялись в период кривой обучения. Время операции при сегментэктомиях составило от 65 до 320 минут, интраоперационная кровопотеря — от 10 до 200 мл. Из 8 операций в 2 случаях была выполнена конверсия доступа: во время резекции 1–2 сегментов правого легкого из-за кровотечения (объем — 1200 мл), вызванного двукратным непрошиванием межсегментарной границы сшивающим аппаратом, и во время резекции 1–2 сегментов левого легкого для зашивания бронхонодулярного свища кульминального бронха, образовавшегося при удалении увеличенного лимфатического узла. В этой группе пациентов наблюдалось одно хирургическое осложнение — замедленное расправление оперированного левого легкого, что потребовало выполнения редренирования плевральной полости.
Наиболее распространенной операцией при туберкулезе была робот-ассистированная лобэктомия. Общее время вмешательства составило от 85 до 380 минут, интраоперационная кровопотеря — от 20 до 500 мл. Частота серьезных хирургических осложнений равнялась 13,3% (10 пациентов). В структуре осложнений преобладали продленный сброс воздуха по дренажам и ателектаз, потребовавший проведения санационной фибробронхоскопии.
Основными особенностями выполнения анатомических резекций легких при туберкулезе являются фиброзные изменения элементов корня легкого, наличие спаечного процесса в плевральной полости и кальцинированные бронхопульмональные лимфатические узлы.
В исследуемой группе у 67 из 84 (79,8%) пациентов были зарегистрированы плевролегочные сращения, у 5 из них (7,5%) — тотальное заращение плевральной полости. У 10 пациентов потребовалось выделение легкого в экстраплевральном слое на ограниченном участке (как правило, в верхушке плевральной полости). При этом только в одном случае была выполнена конверсия в боковую торакотомию — при наличии париетальной шварты толщиной более 1 см, когда невозможно было сформировать свободное пространство, достаточное для работы робота.
В большинстве вмешательств при использовании робот-ассистированного доступа удавалось безопасно обработать элементы корня легкого, несмотря на перибронхиальный и периваскулярный фиброз в корне легкого. При проведении лобэктомий у 2 больных возникла необходимость в конверсии доступа. В первом случае это был пациент с прикорневым расположением каверны и лимфаденопатией прикорневых лимфатических узлов, когда невозможно было найти безопасный слой диссекции артерий верхней доли левого легкого. Второму пациенту потребовалось выполнение экстренной конверсии доступа в связи с повреждением передней стенки легочной артерии слева в процессе диссекции верхнедолевого бронха.
При одностороннем туберкулезе легких робот-ассистированная резекция являлась основным этапом. После нее пациенту возобновлялась противотуберкулезная химиотерапия с коррекцией в соответствии с данными о лекарственной чувствительности МБТ, полученной из операционного материала.
При двустороннем туберкулезе робот-ассистированная резекция легких выполнялась как один из этапов хирургического лечения: у одного пациента в сочетании с клапанной бронхоблокацией на противоположной стороне; у пяти — в сочетании с мини-инвазивными анатомическими резекциями контралатерального легкого. Конверсий доступа в этой группе не требовалось. Послеоперационные осложнения были зарегистрированы у половины пациентов и включали в себя продленный сброс воздуха (2 случая) и тромбоз вены язычковых сегментов после резекции С1–3 левого легкого (что потребовало выполнения повторной операции видеоторакоскопическим доступом по типу верхней лобэктомии слева).
Все пациенты были выписаны для продолжения лечения в терапевтический стационар/санаторий в удовлетворительном состоянии без признаков активного туберкулезного воспаления.
Особенности робот-ассистированных резекций легких при врожденных пороках развития легких
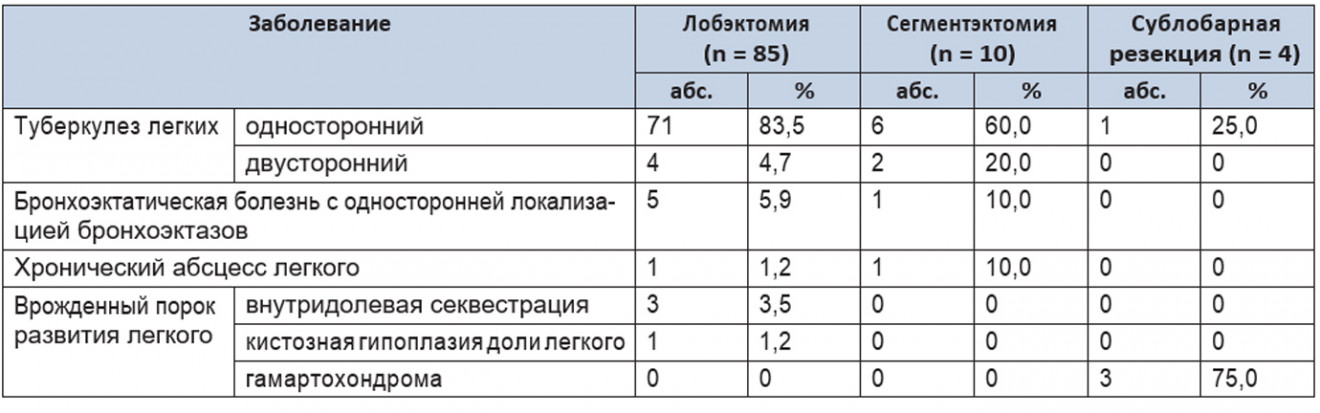
На этапе освоения методики робот-ассистированного доступа в 2013 г. первые операции выполнялись, в том числе с лечебно-диагностической целью, у пациентов с периферическими новообразованиями. При этом было проведено прецизионное удаление гамартохондром у 3 больных (рис. 2).
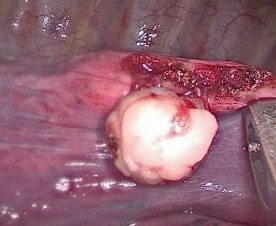 Рис. 2. Эндофотограмма вылущенной гамартохондромы. Фото авторов
Рис. 2. Эндофотограмма вылущенной гамартохондромы. Фото авторовВремя операции составило от 175 до 230 минут при отсутствии значимой кровопотери (менее 10 мл). Одна конверсия доступа была выполнена при невозможности выявить зону патологических изменений в ходе инструментальной пальпации. В дальнейшем робот-ассистированный доступ при этой патологии не использовался ввиду отсутствия значимых преимуществ перед рутинной ВТС.
Одну операцию провели при кистозной гипоплазии верхней доли левого легкого (продолжительность — 155 минут, кровопотеря — 10 мл). Особенностью был выраженный спаечный процесс в верхних отделах левой плевральной полости. При этом преимущества робот-ассистированного доступа позволили выполнить прецизионный пневмолиз в экстраплевральном слое без вскрытия кист легкого.
Три пациентки были оперированы по поводу внутридолевой секвестрации легкого. В 2 случаях имелось вторичное инфицирование нетуберкулезной микобактерией, что потребовало проведения предоперационного курса антибиотикотерапии. В 2 случаях была выполнена нижняя лобэктомия слева, в одном — нижняя лобэктомия справа. Количество аберрантных сосудов, идущих от брюшной аорты, составляло от 1 до 3 (рис. 3).
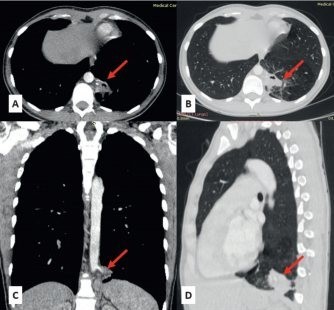 Рис. 3. Предоперационная спиральная компьютерная томограмма органов грудной полости. Фото авторов.
A, B — аксиальная проекция. C — фронтальная проекция. D — сагиттальная проекция.
Примечание. Стрелкой указаны секвестр и аберрантный сосуд
Рис. 3. Предоперационная спиральная компьютерная томограмма органов грудной полости. Фото авторов.
A, B — аксиальная проекция. C — фронтальная проекция. D — сагиттальная проекция.
Примечание. Стрелкой указаны секвестр и аберрантный сосудОбщее время операции составило 130–515 минут. Главной особенностью были прецизионная диссекция нижней легочной связки и прошивание/клипирование аберрантного сосуда (рис. 4).
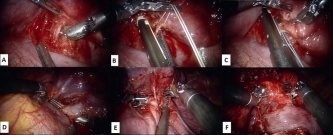 Рис. 4. Этапы робот-ассистированной лобэктомии при внутридолевой секвестрации. Фото авторов.
A, B, C — выделение и обработка аберрантных сосудов.
D — выделение нижней легочной вены.
E — выделение артерии нижней доли. F — выделение нижнедолевого бронха
Рис. 4. Этапы робот-ассистированной лобэктомии при внутридолевой секвестрации. Фото авторов.
A, B, C — выделение и обработка аберрантных сосудов.
D — выделение нижней легочной вены.
E — выделение артерии нижней доли. F — выделение нижнедолевого бронхаПослеоперационных осложнений, требовавших дополнительных инвазий, не было. В одном случае отмечался продленный сброс воздуха по дренажам (более 5 дней), прекратившийся самостоятельно. По результатам бактериологического исследования препарата был скорректирован курс антибиотикотерапии у пациентов с сочетанием врожденного порока развития легкого и микобактериальной инфекции. Фото препарата представлено на рисунке 5.
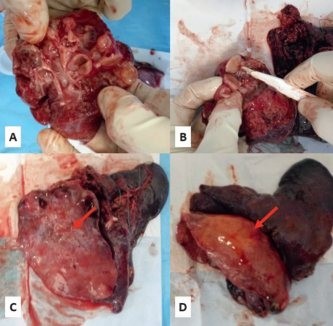 Рис. 5. Операционный препарат. Фото авторов.
A, B — вид на разрезе.
C — общий вид препарата сзади.
D — общий вид препарата спереди.
Примечание. Стрелкой указан секвестр
Рис. 5. Операционный препарат. Фото авторов.
A, B — вид на разрезе.
C — общий вид препарата сзади.
D — общий вид препарата спереди.
Примечание. Стрелкой указан секвестрОсобенности робот-ассистированных резекций легких при хронических неспецифических заболеваниях легких
При локализованных бронхоэктазах и хронических абсцессах были выполнены 6 лобэктомий и 2 сегментэктомии. Длительность операции составила от 95 до 380 минут, операционная кровопотеря — 10–220 мл. Во всех случаях был выявлен спаечный процесс. Кроме того, главной особенностью операции при данных патологиях являлась необходимость тщательной обработки гипертрофированных бронхиальных артерий (рис. 6).
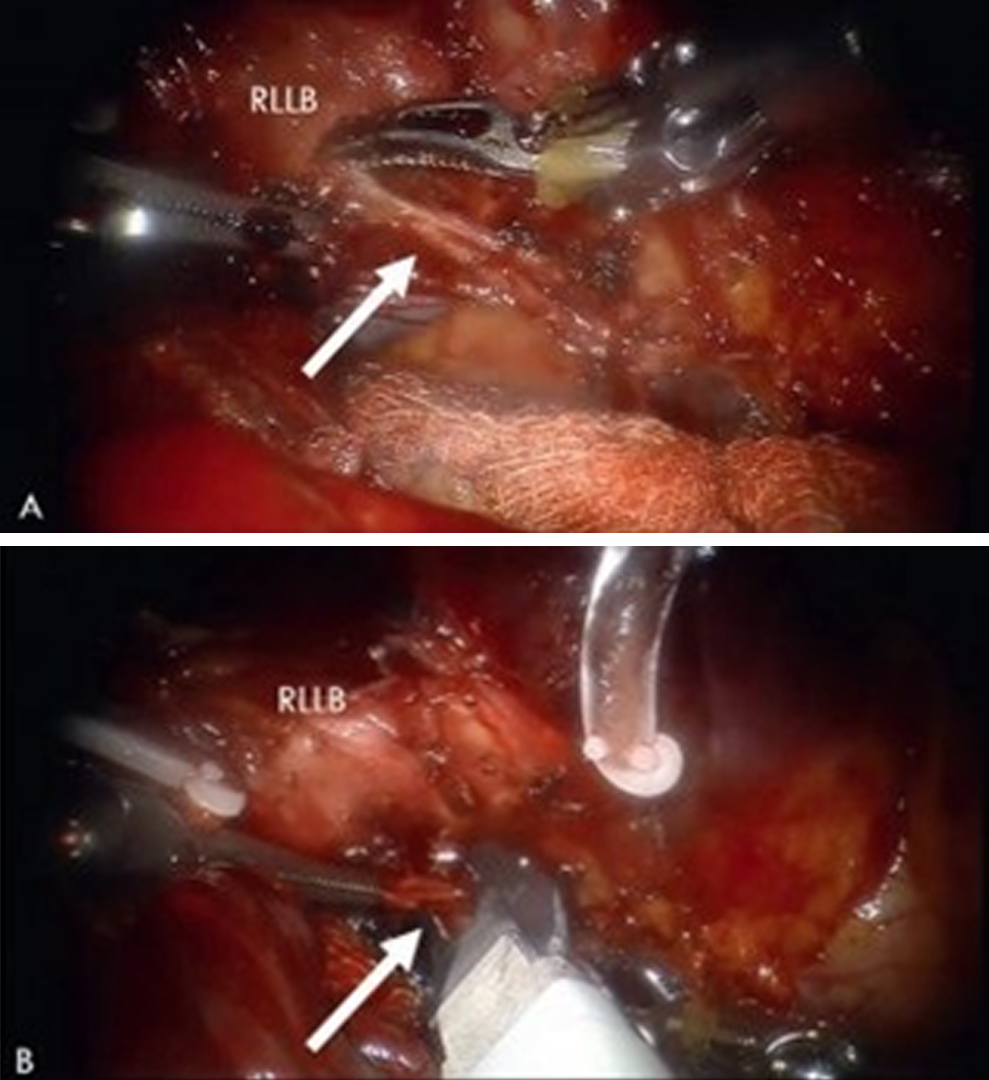 Рис. 6. Этап обработки бронхиальной артерии при нижней лобэктомии справа по поводу бронхоэктатической болезни. Фото авторов.
А — выделение бронхиальной артерии.
В — клипирование бронхиальной артерии.
Примечание. RLLB — бронх нижней доли правого легкого; стрелкой указана гипертрофированная бронхиальная артерия
Рис. 6. Этап обработки бронхиальной артерии при нижней лобэктомии справа по поводу бронхоэктатической болезни. Фото авторов.
А — выделение бронхиальной артерии.
В — клипирование бронхиальной артерии.
Примечание. RLLB — бронх нижней доли правого легкого; стрелкой указана гипертрофированная бронхиальная артерияЕдинственная конверсия была выполнена по экстренным показаниям в связи с тракционным надрывом передней стенки левой легочной артерии у пациентки с бронхоэктазами в месте интимного прилежания увеличенных лимфатических узлов (ранее пациентке были проведены курс лучевой терапии на область молочной железы в связи со злокачественным новообразованием, а также многократные курсы неспецифической антибиотикотерапии по поводу обострения неспецифической инфекции). Хирургическое осложнение было зарегистрировано также у одной пациентки — продленный сброс воздуха по дренажам, потребовавший редренирования плевральной полости.
Обсуждение
Результаты исследования характеризуют актуальное в настоящее время направление торакальной хирургии. Первые публикации об использовании робот-ассистированной техники для выполнения анатомических резекций легких появились еще в 2002 г., но дальнейшие исследования в основном были направлены на изучение эффективности и безопасности технологии при ранних формах рака легкого 1. Вопросы, связанные с выполнением мини-инвазивных операций при инфекционной патологии, а также врожденных и неспецифических заболеваниях легких, остаются обсуждаемыми.
Наибольшей группой пациентов в данном исследовании была группа с ограниченными формами туберкулеза легких. Анализ эффективности и безопасности робот-ассистированных операций показал, что параметры периоперационного периода и частота послеоперационных осложнений у этих больных сравнимы с таковыми при неспецифических заболеваниях.
Наиболее частыми ограничениями для применения мини-инвазивных технологий являются спаечный процесс в плевральной полости и фиброзные изменения корня легкого. Результаты исследования показали эффективность и безопасность роботизированной хирургической системы для работы в таких условиях. При этом частота конверсии доступа в торакотомию, в том числе конверсий по экстренным показаниям, находилась на минимальном уровне и не превышала результатов опубликованных исследований при раке легкого 4.
Преимущества робот-ассистированного доступа очевидны на примере пациентов с хроническими неспецифическими заболеваниями легких: безопасное выделение элементов корня легкого и бронхиальных артерий на фоне гипертрофированных лимфатических узлов сопровождалось минимальной интраоперационной кровопотерей и увеличивало безопасность хирургического лечения по сравнению с альтернативными доступами.
Улучшенная визуализация слоя диссекции позволила выполнять пневмолиз как в интраплевральном, так и в экстраплевральном слое без повреждения легочной ткани и сосудов грудной стенки. Кроме того, оригинальная методика введения торакопортов обеспечила эффективную работу как в нижних, так и в верхних отделах плевральной полости. Это было особенно важно у больных с секвестрацией легкого, когда первым этапом выполнялись диссекция нижней легочной связки и обработка аберрантного сосуда, а затем проводилась типичная лобэктомия.
Заключение
Робот-ассистированные анатомические резекции легких — эффективный и безопасный метод хирургического лечения неонкологических заболеваний легких. Плотные плевральные сращения при инфекционных заболеваниях легких не являются противопоказанием для использования робот-ассистированного доступа. Общее время операций, частота конверсий доступа и количество послеоперационных осложнений при применении данного метода у неонкологических больных сопоставимы с опубликованными результатами робот-ассистированных торакоскопических лобэктомий при раке легкого.
Автор, ответственный за переписку:
Кудряшов Григорий Геннадьевич — врач — торакальный хирург туберкулезного легочно-хирургического (торакального) отделения № 3 Центра торакальной хирургии ФГБУ «СПб НИИФ» Минздрава России.
E-mail: dr.kudriashov.gg@yandex.com





