Современная робототехника в медицине
Резюме
На сегодняшний день робот-ассистированная хирургия и в целом применение роботов в медицине знаменует качественно новый этап развития минимально инвазивных технологий и эндовидеохирургии за счет высокого уровня точности, функциональности и эргономичности современных роботических систем. С помощью роботических технологий повышается качество диагностических манипуляций, улучшаются результаты терапевтических процедур и хирургических вмешательств, что в конечном итоге ведет к улучшению прогноза и качества жизни для пациентов, при этом также значительно расширяются возможности клиницистов. В данной обзорной статье приведены основные исторические вехи и предпосылки развития автоматизации и роботических технологий, применяемых в различных отраслях производства, с древних времен до настоящего времени. Кратко изложена история применения роботизированных процедур в разных областях медицины. Особое внимание уделено робот-ассистированной хирургии как одному из главных плацдармов применения современных технологий. На данный момент можно смело говорить, что медицинская робототехника играет очень важную роль в развитии хирургии будущего.
Список сокращений: ЛРП — лапароскопическая радикальная простатэктомия, ОРП — открытая радикальная простатэктомия, РАНЭ — робот-ассистированная радикальная нефрэктомия, РАП — робот-ассистированная пиелопластика, РАРП — робот-ассистированная радикальная простатэктомия, РАРЦ — робот-ассистированная радикальная цистэктомия/цистопростатэктомия, РРП — робот-ассистированная резекция почки.
Введение
Более ранняя диагностика, повышение эффективности проведения терапевтических мероприятий в сочетании с улучшением хирургических методов лечения привели к улучшению прогноза и функциональных результатов для пациентов, увеличению продолжительности жизни и постоянному расширению границ выживаемости. В результате роль клиницистов, несомненно, стала связана с обработкой большого количества мультимодальной, многомерной, многомасштабной, интервенционной, метаболической и системной информации, помимо анатомических деталей. Ранняя диагностика обеспечивает меньший объем поражения органов патологическим процессом, требующий не только минимально инвазивного доступа, но и максимальной прецизионности вмешательства, зачастую сверхчеловеческой ловкости, видения, анализа и принятия решений. В этом отношении медицинская робототехника играет важную роль в развитии хирургии будущего.
История роботов
Философия автоматизации впервые была изложена древнегреческим мыслителем Аристотелем в IV веке до н. э. Существуют данные, что автоматические машины создавались на территории Древней Греции, Древнего Китая, Древнего Рима. В 322 году до н. э. древнегреческий изобретатель Архит Тарентский сотворил деревянного голубя, летающего при помощи струй пара. Большой вклад в развитие механики, гидравлики и пневматики внесли александрийские математики и философы, Герон и Ктезибий, жившие в конце III века до н. э., многие изобретения которых перевернули представления о возможностях человека. В эпоху Средневековья значительная часть их изобретений, трудов и чертежей была уничтожена и утрачена, и развитие прогресса, в том числе в области меха- ники, приостановилось [1].
В конце XV века великий художник и изобретатель Леонардо да Винчи для развлечения королевской семьи спроектировал механического рыцаря, облаченного в броню, которого можно назвать первым антропоморфным роботом. Внутри доспехов находился механизм, приводящий в движение искусственного человека при помощи системы тросов и роликов и позволявший ему имитировать человеческие движения. Подробные чертежи этого механизма были найдены в 1950-х годах [2]. К другим известным изобретателям эпохи Возрождения относятся Торриано, сконструировавший в 1540 году женщину, играющую на мандолине, Жак де Вокансон, создатель механической утки, способной двигаться, пить и есть, Пьер Жаке-Дро — часовщик, создавший сохранившихся по сей день «автоматонов» (антропоморфных механизмов — художник, музыкант, каллиграф), Жозеф Мари Жаккар, Вольфганг фон Кемпелен [3].
Важной исторической вехой в робототехнике является конец XIX века. В 1898 году гениальный изобретатель Никола Тесла впервые продемонстрировал возможность дистанционного управления устройствами, создав лодку на радиоуправлении. В начале ХХ века Генри Форд, благодаря внедрению в производство конвейера вместо ручной сборки, произвел настоящую революцию в машиностроении. Сошедший с конвейера Ford Model T ознаменовал начало новой эры промышленности, усложнение производства и неминуемый прогресс в индустрии создания машин и механизмов. Сам термин «робот» появился лишь в 1920 году, благодаря чешскому писателю-фантасту Карелу Чапеку и его брату и соавтору Йозефу. В действие одной из своих пьес, «R.U.R», автор ввел человекоподобные механизмы и назвал их «роботами» (от чешского «robota» — тяжелый физический труд). В литературе тему роботов развил писатель Айзек Азимов, а сборник рассказов «Я, робот» принес ему всемирную известность [4]. В 1951 году Рэймонд Гоерц, работавший в комиссии по атомной энергетике в США, спроектировал механический телеуправляемый манипулятор для работы с радиоактивными веществами, исключающий непосредственный контакт с ними человека. Несколько лет спустя был создан первый промышленный робот «Unimate», использовавшийся для сварки и литья на заводах компании General Motors [5].
История роботов в медицине
Именно «Unimate» послужил прообразом первого робота, использовавшегося в медицине. В 1977 году В. Шайнман сконструировал роботическую систему PUMA 560 (Programmable Universal Machine for Assembly), которая была усовершенствована и использована в 1985 году в нейрохирургии для точного направления движения иглы при проведении биопсии головного мозга человека [6]. Этот момент считается отправной точкой в истории медицинских роботов. В 1988 году уролог Джон Уикхэм, которому принадлежит термин «минимально инвазивная хирургия», совместно с Брэйном Дэвисом из Имперского колледжа Лондона представил роботическую систему PROBOT, созданную специально для проведения трансуретральной резекции предстательной железы. Первая операция с использованием данной системы была успешно выполнена в Лондоне в 1991 году [7]. Годом позже компанией Integrated Surgical Systems была представлена хирургическая система ROBODOC для использования в ортопедии при эндопротезировании тазобедренного сустава [8]. В дальнейшем подобные устройства были разработаны для использования при замене коленного сустава (Acrobot, The Acrobot Company, Ltd., Лондон, Великобритания) и в хирургии височной кости (RX-130, Staubli Unimation Inc., Faverges, France), которые используются по сей день [9]. В 1993 году компанией Computer Motion Inc. было представлено роботизированное устройство для фиксации и изменения положения видеокамеры при проведении лапароскопических операций, которое получило название Aesop («Эзоп»). Хирургический комплекс прикреплялся к операционному столу или тележке и перемещал эндоскоп при помощи голосового управления либо позволял устанавливать эндоскоп вручную [5]. В 1995 году компания Computer Motion Inc. объединила два робота-манипулятора с инструментами и Aesop для создания системы ZEUS («Зевс»). Манипуляторы-руки роботического комплекса были телеуправляемы хирургом, который совершал движения с помощью инструментов управления («мастер-рук» или джойстиков) на консоли хирурга. Технически ZEUS не являлся роботом, поскольку он не следовал запрограммированным движениям, а скорее был компьютерным телеманипулятором с интерактивными роботизированными руками. Чтобы повысить точность движения инструмента, ZEUS отфильтровывал тремор рук и мог масштабировать размашистые движения руки хирурга в короткие и точные движения инструмента. Хирургическая система ZEUS использовалась при проведении первой в истории трансатлантической хирургической операции (операции Линдберга). 7 сентября 2001 года французский профессор, хирург J. Marescaux из Нью-Йорка (США) выпол- нил холецистэктомию пациенту, находившемуся на расстоянии в несколько тысяч километров, в г. Страсбург (Франция) [10].
В 1999 году компания Intuitive Surgical Inc. (США) ввела в эксплуатацию роботическую хирургическую систему da Vinci. Как и ZEUS, da Vinci представляет собой телеуправляемую систему, которая состоит из трех компонентов:
- консоль хирурга, на которой расположены средства управления манипуляторами;
- тележка пациента, снабженная четырьмя руками-манипуляторами, одна из которых служит для фиксации эндоскопа, изображение с которого передается на монитор, встроенный в консоль хирурга, остальные же предназначены для фиксации инструментов;
- эндовидеохирургическая стойка.
Точность движения механических манипуляторов превосходит возможности рук человека, поскольку они имеют семь степеней свободы и способность изгиба на 90 градусов. На экран выводится 3D-изображение оперируемого участка. Хирург управляет манипуляторами с помощью сенсорных джойстиков, причем движения хирурга с абсолютной точностью воспроизводятся роботическими инструментами, обеспечивая улучшенную артикуляцию, которая увеличивает простоту наложения швов и позволяет выполнять сложнейшие манипуляции с максимальной точностью. В конечном итоге это обеспечивает высокое качество операции и повышает безопасность ее проведения. Несколько лет компания Computer Motion конкурировала с Intuitive Surgical, но в июне 2003 года произошло объединение двух компаний в Intuitive Surgical Inc., после чего было закрыто производство систем ZEUS и модернизировано производство Da Vinci [11].
Современные роботы в различных областях медицины
В 2001 году начались первые клинические исследования аппарата CyberKnife — кибернож (Accuray Inc., г. Саннивейл, Калифорния, США). Он представляет собой минимально инвазивную радиохирургическую роботизированную систему, используемую для лечения опухолей черепа и позвоночника (а также рака предстательной железы, легких, печени и поджелудочной железы) с использованием линейных ускорителей. В системе используются контроль по изображению и робот-манипулятор с компьютерным управлением, позволяющие непрерывно отслеживать перемещения опухоли и пациента на протяжении процедуры и производить соответствующие корректирующие действия. Благодаря своей исключительной точности системе не требуются инвазивные рамки для фиксации головы или других частей тела пациента, что значительно повышает гибкость системы. Радиохирургическая система обладает возможностью онлайн-трекинга мишени и облучения с синхронизацией дыхания. Эта система признана стандартной технологией радиотерапии онкологических заболеваний, более 100 000 пациентов проходят лечение по всему миру. CyberKnife является примером коммерчески доступного и широко используемого безрамного радиохирургического робота [12].
В 2007 году компанией Endocontrol (Франция) была разработана первая роботизированная система для лапароскопической хирургии с голосовым управлением, получившая название VIKY, которая используется в гинекологии, общей хирургии, урологии, торакальной хирургии и насчитывает порядка 150 устройств по всему миру [13]. В том же году была представлена роботизированная магнитная навигационная система Niobe (Stereotaxis, США) для эндоваскулярных операций на сердце, а также эндоскопических манипуляций в гастроэнтерологии (капсульная эндоскопия). Система состоит из двух магнитов с роботизированным управлением рядом с операционным столом. Во время процедуры врач использует 3D-навигацию, интуитивный компьютерный интерфейс для настройки магнитного поля вокруг пациента, что позволяет точно направлять движение катетера либо капсулы со встроенным магнитом [14]. Компания Hansen Medical в 2007 году выпустила специализированную роботическую систему для Sensei для проведения эндоваскулярных транскатетерных вмешательств на сердце, в частности коррекции наджелудочковой тахикардии, трепетания предсердий, а также сложных процедур аблации для лечения фибрилляции предсердий. Также, как и у системы Niobe, имеется удаленное управление, обеспечивающее стабильность, точное позиционирование и проведение катетера, однако интегрированной навигационной системой у Sensei является 3D-картирование, флюороскопия и УЗИ.
В 2009 году на базе Sensei была создана усовершенствованная система для эндоваскулярных вмешательств — Magellan. Еще одним примером этой группы медицинских роботов является система CorPath GRX, созданная несколькими годами позже компанией Corindus Vascular Robotics (США) [15, 16]. 2009 год ознаменовался дальнейшим развитием управляемых гибких катетеров для эндолюминального доступа и работы в ограниченных областях, недоступных для ригидной лапароскопии. В 2011 году американской компанией Mazor Robotics был разработан специализированный роботизированный комплекс Renaissance для нейрохирургии. Система предоставляет врачам возможность, благодаря специальной программе, заранее спланировать все этапы оперативного вмешательства, продумать размеры необходимых имплантатов и фиксирующих материалов. После установки роботической платформы непосредственно на позвоночный столб пациента и синхронизации разработанного хирургического плана с текущим положением платформы выполняется запланированный объем хирургического вмешательства с максимальной прецизионностью — до 1,5 мм. На данный момент большая часть мирового опыта выполнения роботизированных вмешательств на позвоночнике связана именно с Renaissance [17].
С течением времени приоритетным направлением в медицинской робототехнике становится создание более компактных, легких и безопасных роботических систем с усовершенствованным искусственным интеллектом, которые легко могут быть интегрированы в клинический рабочий процесс. Благодаря разработкам в сфере узкоспециализированных хирургических роботов в 2009–2013 годах миру были представлены ортопедические роботические системы Mako (Stryker, США) и Navio (Smith & Nephew, Великобритания). Оба аппарата представляют собой полуактивные роботизированные системы, используемые для замены коленного сустава. Mako использует 3D-модель коленного сустава пациента для предоперационного планирования хирургического вмешательства. Система обеспечивает как слуховую, так и тактильную обратную связь, ограничивая рабочее пространство бура. Navio не использует предоперационное КТ-сканирование, поскольку система постоянно отслеживает как анатомию пациента, так и роботизированное устройство с помощью инфракрасной камеры и оптических приборов. Mako является параллельным команипулятором (хирург и робот работают вместе для перемещения инструмента), Navio является последовательным команипулятором (хирург удерживает и перемещает робота, который перемещает инструмент) [18].
В 2015 году Управлением по контролю за продуктами питания и лекарственными средствами США (FDA) была одобрена технология Flex Robotic System (Medrobotics, США), которая является первой специализированной хирургической платформой, основанной на управляемом и настраиваемом объеме робототехники, который обеспечивает доступ через естественные пути в отоларингологии и колоректальных процедурах. Гибкий многоярусный эндоскоп, управляемый через единую точку доступа, может быть проведен по нелинейным извилистым анатомическим путям. Когда интересующая область достигнута, роботизированный эндоскоп становится жестким и служит устойчивой платформой, на которой визуализируются и управляются гибкие инструменты [19]. Еще одной роботической системой, применяющейся в ЛОР-хирур-ии, является μRALP, разработанная Mattos и коллегами в 2015 году для микрохирургического ла- зерного лечения поражений гортани [20]. По тому же принципу работают и созданный в 2011 году J. Shang с коллегами робот i-Snake, и разработанный несколько позднее Micro-IGES, который уже про- шел клинические испытания, нашедший себе применение в хирургическом лечении поражений желудочно-кишечного тракта, верхних дыхательных путей и бронхов [21]. Еще одной перспективной разработкой в области роботической эндоскопии является представленная в 2018 году компанией Auris Health Inc. система Monarch. Данная роботическая система создана для проведения диагностической и лечебной бронхоскопии, она обеспечивает доступ в бронхи субсегментарного порядка и, благодаря 3D-МСКТ-навигации в сочетании с изображением в высоком разрешении, передаваемым с эндоскопа, а также эргономичному управлению, позволяет выполнить прицельную биопсию периферических образований легких [22].
Роботы-хирурги
В 2018 году на симпозиуме Хэмлина в Лондоне компания Intuitive Surgical Inc. презентовала роботический хирургический комплекс нового поколения — Da Vinci SP, пришедший на смену предыдущим генерациям: da Vinci Xi, da Vinci X и da Vinci Si, которых на сегодняшний день в мире больше всего. Что касается генерации da Vinci S, da Vinci Standart, с 2018 года их техническое обслуживание прекратилось. Новейшая система da Vinci SP создана для однопортовой хирургии, т. е. через разрез длиной 2,5 см устанавливается единственный троакар, через который вводятся все 3 инструмента и эндоскоп, причем и эндоскоп, и хирургические инструменты являются гибкими. Данные преимущества позволяют осуществлять доступ к анатомическим образованиям в пределах 360 градусов из одного порта, минимизировать инвазивность процедуры, а также существенно повысить эффективность трансоральных хирургических вмешательств [23].
В большинстве развитых стран мира уже достаточно давно ведутся разработки роботических систем для хирургии, чтобы создать продукт, который будет способен конкурировать с da Vinci, при этом инженеры стараются компенсировать недостатки уже известных систем и стремятся создать идеальную. Одним из таких комплексов является созданный компанией TransEnterix (США) аппарат Senhance. Он представляет собой роботизированную платформу консольного типа, состоящую из пульта дистанционного управления, манипуляторов и узла соединения. Каждый из трех манипуляторов-рычагов установлен на отдельной тележке. Манипуляторы лапароскопического типа обеспечивают тактильную обратную связь от рычагов с тросовым приводом, которые обеспечивают 7 степеней свободы. На экран выводится 3D-изображение в высоком разрешении, имеется встроенная система управления камерой, которая центрирует изображение в точке, на которую смотрит хирург. Аппарат Senhance одобрен FDA в 2017 году и успешно применяется главным образом в гинекологии и колоректальной хирургии [24].
Еще один представитель Нового Света — SPORT (Single Port Orifice Robotic Technology) — однопортовая роботизированная хирургическая система (Titan Medical Inc., Канада), которая состоит из рабочей станции и роботизированной платформы, управляемой хирургом с помощью ручных контроллеров, ножных педалей и сенсорного 3D-HD-экрана. Для операций используются гибкие многосуставные инструменты и эндоскоп. Хорошие результаты использования системы SPORT продемонстрированы в экспериментах на животных моделях [25]. В стадии разработки находятся системы SurgiBot и SPIDER (обе — компания TransEnterix, США) — роботизированные комплексы для однопортовой минимально инвазивной хирургии. Хирурги используют гибкие контролируемые инструменты, вводимые через единственный эндопорт. Обе роботизированные системы позволяют размещать несколько инструментов в рабочем канале, а также обеспечивают трехмерную визуализацию, эргономичное управление и точность движений с масштабированием. Главной целью создания этих систем является обеспечение хирургическими роботами регионов с недостаточным их количеством с минимальными затратами на приобретение [26].
Одним из европейских проектов является роботический хирургический комплекс консольного типа MiroSurge (RMC, DLR, Немецкий аэрокосмический центр, Германия). Представляет собой систему телеманипулируемой малоинвазивной роботизированной хирургии, включающую в себя 3–5 индивидуальных инструментов с несколькими режимами управления и возможностью установки в различных позициях на направляющих операционного стола [27]. Также к европейским разработкам относится система Versius (Cambridge Medical Robotics Ltd., Великобритания) — это легкая модульная роботизированная система, предназначенная для лапароскопических операций на верхней части желудочно-кишечного тракта, для гинекологических, колоректальных операций и операций на почках. Модульная конструкция обеспечивает гибкость и универсальность позиционирования в операционной, в то же время имеется возможность подключения многочисленных инструментов к манипуляторам [28]. Весьма перспективной представляется совместная разработка компаний Google и Ethicon — «Verb Surgical». Она представляет собой систему для консолидации данных, получаемых от роботических хирургических систем всех производителей по всем пациентам из медицинских учреждений (истории болезни, мед. карты) от врачей различных специальностей, для создания «идеального» роботического комплекса с системой «умной» визуализации, способностью к самообучению и самопроверке, универсального для пациента и для врача, а также для оптимизации цены [29].
Классификация медицинских роботов
С появлением медицинских роботизированных технологий появились новые термины. В частности, телехирургия — использование при хирургическом вмешательстве устройств «ведущий–ведомый», в которых ведущий и ведомый компоненты физически разделены. Хирург, который располагается на удаленном расстоянии от операционного стола осуществляет активное управление инструментами. Обмен данными между консолью хирурга и инструментами происходит по телекоммуникационной линии. Хотя устройства «ведущий–ведомый» обычно находятся в одном и том же помещении во время операции, процедура может быть выполнена с помощью хирургической консоли, расположенной в другой комнате или даже в другом регионе.
Сегодня всех существующих хирургических роботов можно разделить следующим образом:
- Пассивные роботы — не обладают автономией. Управляются вручную, самостоятельно движений не выполняют (например, Neuronavigator).
- Телеуправляемые роботы — не обладают автономией. Удерживают хирургические инструменты, которыми управляет человек дистанционно (например, da Vinci).
- Полуактивные (взаимодействующие) роботы — «истинные роботы-ассистенты». Оператор постоянно контролирует систему. Робот обеспечивает некоторое управление. Примеры включают роботов с виртуальными функциями (полуактивные — Renaissance, Navio; взаимодействующие — Mako).
- Активные роботы, обладающие автономностью в рамках конкретной задачи. Оператор осуществляет дискретный контроль, робот выполняет определенное задание автономно, но с инициативы оператора (например, ROBODOC).
- Активные роботы, которые автономно выполняют запланированное движение, условно автономные роботы. Оператор строит и подтверждает хирургический план/план лечения. Робот выполняет процедуру автономно под контролем оператора (например, CyberKnife).
Будущее роботической хирургии
Роботы с высоким уровнем автономии — роботы способные принимать медицинские решения под контролем человека (на данный момент не существуют).
Полностью автономные роботы, способные выполнять хирургическое вмешательство полностью без участия человека (на данный момент — научная фантастика). Также медицинских роботов можно разделить по сфере их применения:
1. Хирургические роботы.
- Нейрохирургические — использующиеся при хирургических вмешательствах на позвоночном столбе и головном мозге (Neuromate, Renaissance).
- Эндоскопические — использующиеся при бронхоскопии (Auris Monarch), внутрипросветных манипуляциях в ЛОР-хирургии (μRALP), манипуляциях на органах ЖКТ и верхних дыхательных путях (Flex Robotic System, i-Snake).
- Эндоваскулярные — управляемые гибкие катетеры для проведения эндоваскулярных вме- шательств на сердце и сосудах (Magellan, Niobe, Sensei, CorPath).
- Роботы для радиохирургии — CyberKnife.
- Универсальные лапароскопические ро- боты — телеуправляемые манипуляторы (Aesop/ ZEUS, VIKY, Da Vinci).
2. Вспомогательные медицинские роботы.
- Реабилитационные — роботы ухода (Riba), роботы-компаньоны (PARO), роботы-экзоскелеты (ALEX, LOPES, RUPERT).
- Фармакологические — роботы-фармдиспенсеры (RPDS), роботы для таргетной доставки лекарственных препаратов через кровоток (микро- боты/микророботы/нанороботы).
- Обслуживающие (госпитальные) роботы — роботы для дезинфекции (Xenex Robot), роботы для наблюдения, обучения и телеприсутствия (InTouch tele-robotic system), автономные мобильные манипуляторы, для транспортировки медикаментов, оборудования, расходных материалов (TUG), социальные роботы-администраторы/секретари, способные распознавать десятки языков (Pepper, Nao).
3. Другие медицинские роботы.
- Роботическая система для пересадки волос (ARTAS).
- Робот для венопункции (Veebot).
- Роботические системы для реанимационных отделений (The AutoPulse Plus, LS-1).
Хирургия Da Vinci сегодня
В последние годы начала появляться конкуренция на рынке медицинских роботов, наиболее серьезными из потенциальных противников Intuitive Surgical являются компании TransEnterix, Titan Medical, Accuray, MAKO Surgical, Mazor Robotics, Hansen Medical и др. Несмотря на это, на данный момент именно компания Intuitive Surgical уже на протяжении длительного времени является фактически монополистом на мировом рынке роботизированных хирургических комплексов, во многом благодаря огромному количеству запатентованных технологий, использующихся в da Vinci. Компания обладает более 1700 национальных и международных патентов на технологии. С тех пор как в 2000 году Управление по контролю за продуктами питания и лекарственными средствами США дало разрешение на проведение с помощью хирургического робота da Vinci операций, da Vinci является единственной в мире универсальной роботизированной системой с дистанционным управлением, распространенной и широко используемой на всех континентах. По данным Intuitive Surgical Inc., на сегодняшний день в мире установлено почти 5500 роботических хирургических систем da Vinci, из них около 3000 — в США, порядка 900 — в странах Европы.
Число выполняемых робот-ассистированных операций растет с каждым годом, на данный момент в мире выполнено более 6 000 000 роботических операций. Первый в России и странах СНГ роботический хирургический комплекс da Vinci был установлен в 2007 году в Свердловской областной клинической больнице No 1, где 4 ноября того же года была выполнена первая робот-ассистированная операция. На данный момент в России установлено в общей сложности 33 роботических хирургических комплекса, выполнено более 16 500 операций. Валидация роботической хирургической системы da Vinci началась с кардиохирургии, однако в настоящее время лидирующими специальностями по применению данной технологии являются урология, гинекология и общая хирургия. Помимо этих специальностей, уже осуществляется либо планируется применение da Vinci в торакальной и кардиохирургии, колоректальной хирургии, ЛОР-хирургии, ортопедии. В России порядка 66 % всех робот-ассистированных операций выполняется урологами. Неуклонно растет число публикаций по роботической хирургии. В 2017 год количество публикаций, связанных с роботической хирургией составляло более 13 500, причем количество публикуемых статей возросло до 2000 за год. За последние годы появились в том числе и длительные сравнительные многоцентровые исследования, мета-анализы и рандомизированные контролируемые исследования, доказывающие эффективность и безопасность роботической хирургии.
Робот-ассистированные операции
Робот-ассистированная радикальная простатэктомия
В нашей стране хирургическое лечение локализованного рака предстательной железы включает открытую радикальную простатэктомию (ОРП), которая может быть выполнена позадилонным либо промежностным способом, лапароскопическую радикальную простатэктомию (ЛРП) и робот-ассистированную радикальную простатэктомию (РАРП). Долгое время ОРП являлась «золотым стандартом» лечения локализованного рака предстательной железы, обеспечивающим удовлетворительные онкологические и функциональные результаты [30]. В нашей стране ОРП является наиболее распространенным методом лечения локализованного рака простаты, операция выполняется во многих регионах России на протяжении многих лет. Основными недостатками данного метода являются травматичность и сравнительно большой объем кровопотери. ЛРП была впервые выполнена в 1991 году W. Schuessler с коллегами. В течение десятилетия методика претерпевала различные модификации и в конечном итоге, по мере накопления опыта, в начале 2000-х, стала альтернативой открытой хирургии. В России первая ЛРП была выполнена в 2000 году В. Л. Медведевым. С середины 2000-х годов ЛРП успешно применялось в России в хорошо оснащенных экспертных клиниках. В 2000 году в США была выполнена первая РАРП [31]. В России данное вмешательство было выполнено впервые в 2008 года в клинике урологии Московского государственного медико-стоматологического университета им. А. И. Евдокимова. Оперировал американский роботический хирург V. Patel совместно с главным урологом Минздрава России Д. Ю. Пушкарем. Первые результаты были опубликованы в 2010 году. Профессор Д. Ю. Пушкарь и соавторы представили свои данные по 80 РАРП, причем результаты лечения были схожи с аналогичными, достигнутыми при внедрении роботической программы за рубежом [32]. Первая робот-ассистированная простатэктомия в Северо-Западном регионе была выполнена в НМИЦ им. В. А. Алмазова. На сегодняшний день Центр Алмазова — одно из российских учреждений, которое имеет большой опыт по проведению данной операции (рис. 1).
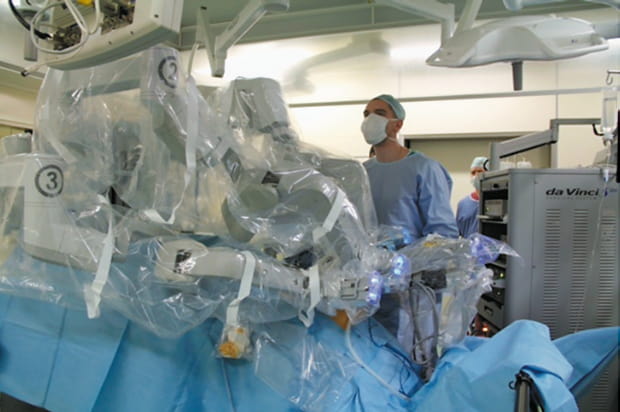 Рис. 1. Робот-ассистированная операция в НМИЦ им. В. А. Алмазова
Рис. 1. Робот-ассистированная операция в НМИЦ им. В. А. Алмазова
Робот-ассистированная резекция почки
Несмотря на то, что «золотым стандартом» лечения локализованного рака почки долгое время считалась радикальная нефрэктомия, на сегодняшний день органосохраняющие вмешательства на почке приняты в качестве стандартного подхода при опухолях почек, поскольку обеспечивают лучшие функциональные результаты, а также связаны с меньшим риском возникновения кардиоваскулярных осложнений [33]. Ранее считалось, что выполнение резекции почки целесообразно только при опухолях маленьких размеров либо при опухоли единственной функционирующей почки, однако позднее показания к органосохраняющим операциям при почечно-клеточном раке расширились — в настоящее время в медицинских центрах экспертного класса выполняются резекции почки при здоровой контралатеральной почке, при крупных новообразованиях почек, в том числе до 7 см в наибольшем измерении [34]. В 1993 году H. N. Winfield впервые сообщил о лапароскопической резекции почки, впоследствии многие авторы докладывали об успешных долгосрочных онкологических и не онкологических результатах минимально инвазивной резекции почки при опухолях. С момента, когда было сообщено о первом успешном опыте робот-ассистированной резекции почки (РРП) [35], было опубликовано множество исследований, доказывающих выполнимость, эффективность и безопасность данного вмешательства. Первая РРП в России была выполнена в 2010 году в Санкт-Петербурге профессором Д. Ю. Семеновым (совместно с М. С. Мосояном, С. Х. Аль-Шукри), позднее было сообщено об успешных результатах лечения 4 пациентов (рис. 2) [36]. На данный момент РРП, по сравнению с открытой резекцией почки, обеспечивает сопоставимые онкологические и функциональные результаты при меньших рисках развития периоперационных осложнений (по Clavien-Dindo). По сравнению с ЛРП, РРП связана с меньшим риском интраоперационных осложнений, а также лучшим сохранением функции почки [37].
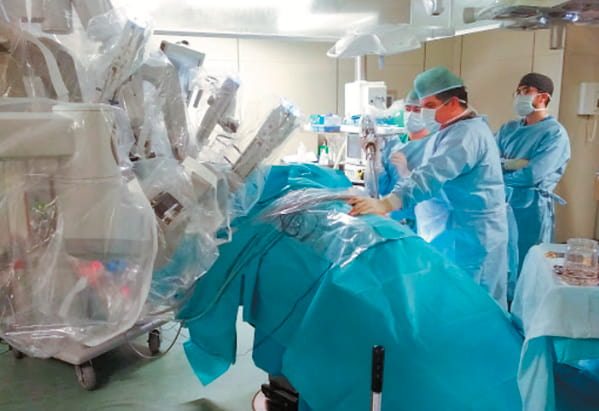 Рис. 2. Начало робот-ассистированной резекции почки (оперирует профессор М. С. Мосоян). Этап установки эндопортов и «докинг» роботического хирургического комплекса
Рис. 2. Начало робот-ассистированной резекции почки (оперирует профессор М. С. Мосоян). Этап установки эндопортов и «докинг» роботического хирургического комплекса
На сегодняшний день именно робот-ассистированная радикальная простатэктомия и робот-ассистированная резекция почки являются наиболее распространенными урологическими вмешательствами, выполняемыми в России.
Другие робот-ассистированные урологические операции
Робот-ассистированная радикальная нефрэктомия (РАНЭ). Несмотря на то, что в последние годы были существенно расширены показания для органосохраняющих операций при раке почки, радикальная нефрэктомия выполняется повсеместно, при опухолях стадии T2, а также при определенных характеристиках опухоли, не позволяющих планировать органосохраняющее лечение. РАНЭ была впервые описана D. W. Klinger и соавторами [38]. В России данное вмешательство было впервые осуществлено в 2010 году в Центре Алмазова. С тех пор в нашей стране накоплен большой опыт выполнения подобных вмешательств, они проводятся практически во всех медицинских центрах, имеющих комплексы da Vinci, демонстрируя удовлетворительные онкологические и функциональные результаты в сравнении с открытой методикой, при этом обладая всеми преимуществами минимально инвазивной хирургии [36].
Робот-ассистированная пиелопластика (РАП). Робот-ассистированная пластика пиелоуретерального сегмента успешно выполняется с 2001 года. Первым хирургом, выполнившим та- кое вмешательство, является австриец M. Gettman, опубликовавший в 2002 году результаты лечения 9 пациентов, доказав тем самым эффективность и безопасность методики [39]. Впоследствии было опубликовано множество исследований, в том числе многоцентровых, согласно которым выполнение РАП целесообразно, связано с минимальной послеоперационной морбидностью и имеет многообещающие показатели проходимости и долгосрочные результаты [40]. В России робот-ассистированная пиелопластика выполняется в нескольких учреждениях, однако эти операции выполняются гораздо реже, чем роботические вмешательства при раке почки и предстательной железы.
Робот-ассистированная радикальная цистэктомия/цистопростатэктомия (РАРЦ). В 2003 году M. Menon выполнил первую робот-ассистированную радикальную цистопростатэктомию у мужчины с мышечно-инвазивным раком мочевого пузыря. В том же году выполнена цистэктомия у женщины, причем отведение мочи осуществлялось как путем формирования илеокондуита, так и путем создания ортотопического мочевого пузыря [41]. В настоящее время имеются данные, в том числе рандомизированных контролируемых исследований, которые гласят, что РАРЦ связана с меньшей послеоперационной морбидностью, а также меньшей длительностью госпитализации по сравнению с открытым методом при аналогичных онкологических результатах [42]. В нашей стране РАРЦ выполняется всего в нескольких центрах.
Робот-ассистированная радикальная нефрэктомия с тромбэктомией из нижней полой вены. Впервые данная операция была описана в 2011 году R. Abaza, который имеет наибольший опыт в мире по таким вмешательствам. Позднее было опубликовано многоцентровое исследование, по данным которого роботизированная нефрэктомия, при наличии опухолевого тромба в нижней полой вене, является приемлемым методом хирургического лечения и может быть выполнена безопасно и эффективно у отобранных пациентов. Несмотря на техническую сложность вмешательства, в данном исследовании демонстрируются благоприятные результаты и воспроизводимость при должном опыте в роботической хирургии [43]. В России робот-ассистированная радикальная нефрэктомия с тромбэктомией из нижней полой вены с предварительной эндоваскулярной эмболизацией почечной артерии впервые была успешно выполнена в 2017 году в НМИЦ им. В. А. Алмазова д.м.н. М. С. Мосояном [44]. Всего, по нашим данным, в России выполнено 2 подобных операции, обе — в Центре Алмазова.
Робот-ассистированная аденомэктомия. Робот-ассистированная аденомэктомия впервые была описана в 2008 году R. Sotelo с соавторами [45].







