Случай успешного хирургического лечения сочетания центрального плоскоклеточного рака легкого с прорастанием в предсердие и активного деструктивного туберкулеза легких с применением аппарата искусственного кровообращения
Резюме
Рассмотрен случай успешного лечения сочетания у больного рака и активного туберкулезного процесса. Описаны сложности оценки распространенности обоих процессов. Представлен эффективный выбор тактики лечения обоих заболеваний у пациента.
Введение
О возможном развитии у больных одновременно рака и туберкулеза легких известно давно. В последнее время случаи сочетания этих заболеваний стали выявляться все чаще в связи с повышением заболеваемости населения раком легких и увеличением продолжительности жизни больных туберкулезом [1, 2]. В свою очередь, диагностика и своевременное выявление сочетания этих заболеваний затруднительно, так как при подтвержденном диагнозе туберкулеза легких снижается онкологическая настороженность [3, 4]. К сожалению, у пациентов с активным туберкулезом легких диагноз рака легкого устанавливается на поздней стадии или посмертно, несмотря на все диагностические мероприятия. В случае выявления рака легкого, распространяющегося на магистральные сосуды или имеющего инвазию в структуры сердца, больным предпочитают проводить химиолучевую терапию [4–7]. По данным литературы крупные центры помощи больным с патологией легких имеют возможность оперировать в условиях применения аппарата искусственного кровообращения (АИК) [8], в основном это резекции легких при раке. Однако описаний операций с резекцией предсердий при сочетании рака и туберкулеза в источниках литературы не найдено. АИК имеет тонкости подключения и запуска, такие как стерильность и абластика. В представляемом случае, когда операция выполнялась в условиях специфической эмпиемы, условно инфицированной плевральной полости, со вскрытием перикарда интраоперационно для верификации распространенности процесса, подключение АИК было нецелесообразным, так как имелась высокая вероятность гематогенного распространения специфического процесса [9].
Подключение АИК связано с некоторыми рисками. Некоторые из них обусловлены введением высоких доз антикоагулянтов, как в представляемом случае. У больных с туберкулезом легких на фоне подключения АИК и введения гепарина развивается гипокоагуляция, что сопряжено с риском развития кровотечения во время и после операции [10], так как пациенты со специфическим поражением склонны к послеоперационным коагулопатиям. Кроме того, перенесенный ранее плеврит у пациента вызвал полную облитерацию плевральной полости [11]. Это вынуждает выделять легкое в экстраплевральном слое во избежание контаминации плевральной полости. После выделения легкого в экстраплевральном слое остается обширная кровоточащая раневая поверхность [1], что в условиях гипокоагуляции влечет за собой риск развития диапедезного кровотечения.
Кроме того, в процессе химиотерапии отмечено снижение коагулирующих свойств крови за счет понижения противосвертывающего компонента и протромбиновой активности I, связанной с токсическим воздействием на печень химиопрепаратов.
Увеличенные лимфатические узлы также представляют трудность для интерпретации, так как лимфаденопатия может сопровождать оба этих заболевания. В представленном случае больному, помимо рентгенологических методов диагностики (КТ, ПЭТ-КТ), выполнены инвазивные методы диагностики для определения дальнейшей тактики лечения [12, 13].
Материалы и методы исследования
Больной О., 65 лет, поступил в хирургическое отделение ФГБУ «СПб НИИФ» Минздрава России 29.11.2016 г. с жалобами на слабость, ночную потливость, одышку при умеренной физической нагрузке, кашель с небольшим количеством мокроты слизистого характера, непостоянные боли в левой половине грудной клетки. Отмечал потерю массы тела на 20 кг в течение последних 2 лет. Из анамнеза жизни: бытовые условия расценивает как удовлетворительные. Ранее работал водителем, профессиональных вредностей не отмечал. Пребывание в местах лишения свободы отрицает. Обращает на себя внимание длительный стаж курения (50 пачка-лет) и наличие сопутствующей патологии: язвенной болезни желудка (резекция 2/3 желудка в 1973 г.), хронического вирусного гепатита В, ишемической болезни сердца, стенокардии напряжения II–III функционального класса, гипертонической болезни II степени с риском сердечно-сосудистых осложнений 3, начальная возрастная катаракта, ангиосклероз сетчатки.
При анализе истории заболевания выяснилось, что в 2007 г. больной имел семейный контакт с сыном, умершим от туберкулеза спустя год. Изменения в легких впервые были выявлены у больного при профилактической флюорографии в 2013 г. в виде образования в S5 левого легкого. При обследовании по месту жительства пациента данных, свидетельствующих о туберкулезе и онкопатологии, не получено. Рекомендовано динамическое наблюдение с последующим контрольным рентгенологическим обследованием. Рекомендации больной не выполнял.
Повторно обратился за медицинской помощью в конце 2015 г. в связи с жалобами на колющие боли в грудной клетке, одышку инспираторного характера. По результатам обследования по месту жительства по данным МСКТ ОГК от февраля 2016 г. отмечено нарастание инфильтративных изменений в левом легком. С целью верификации процесса выполнялась чрезбронхиальная и трансторакальная биопсия легкого (05.05.2016 и 12.05.2016 соответственно). Патоморфологическое заключение: опухолевые структуры не обнаружены, фрагменты плевры с эпителиоидно-клеточными гранулемами, с лимфоэпителиоидным компонентом, с единичными гигантскими многоядерными клетками Лангханса. Морфологическая картина гранулематозного воспаления, возможно туберкулезного генеза. При окраске по Цилю–Нильсену кислотоустойчивые бактерии не выявлены. При повторной биопсии обнаружены фрагменты казеозного некроза, таким образом верифицирован диагноз туберкулеза, данных за опухолевый процесс не получено.
По данным МСКТ ОГК (30.06.2016) с контрастированием отмечалась дальнейшая отрицательная динамика легочных изменений. В корневом отделе слева дифференцировалось дополнительное образование с пониженным накоплением контрастного препарата размерами 23×34×40 мм, плотно прилегающее к средостению с подозрением на обтурацию нижней легочной вены до уровня впадения в левое предсердие. Отмечалось также нарушение проходимости нижнедолевого бронха с частичным обтурационным ателектазом базальных сегментов левого легкого. В язычковых сегментах левого легкого определялось округлое образование с полостью распада с четкими наружными контурами 53×39×35 мм. Визуализировались полиморфные очаги диссеминации в обоих легких и внутригрудная лимфоаденопатия слева.
С целью дообследования и установления диагноза пациент госпитализирован в дифференциально-диагностическое отделение ФГбУ «СПб НИИФ» Минздрава России в июне 2016 г.
Данные объективного обследования: состояние больного удовлетворительное. Больной достаточного питания. Кожные покровы чистые, обычной окраски. Костно-мышечная система без видимой патологии. Периферические лимфоузлы не увеличены. Грудная клетка правильной формы. Аускультативно: дыхание жесткое, выслушиваются влажные разнокалиберные хрипы в правой половине грудной клетки. Частота дыхания 16 в минуту. Тоны сердца приглушены, ритмичные. АД 130/80 мм рт.ст. Пульс 80 уд./мин. Живот мягкий, безболезненный. Печень не увеличена. Диурез в норме.
По результатам проведенного комплекса диагностических мероприятий выявлен плевральный выпот слева, выполнена пункция плевральной полости (анализ цитограммы плевральной жидкости: нейтрофилы 2%, лимфоциты 98%, белок 5,0, плотность 1,005, глюкоза 2,8, аденозиндезаминаза 50,3 ед./л, 2-дезоксиаденозиндезаминаза 17,6 ед./л, обнаружена ДНК Mycobacterium tuberculosis complex). В анализе мокроты методом люминесцентной микроскопии выявлены МБТ, ДНК МБТ и при молекулярно-генетическом исследовании определены мутации методом ПЦР, ведущие к устойчивости к рифампицину (R). При бронхологическом осмотре определялись признаки увеличения внутригрудных лимфатических узлов, перибронхиальное образование левого легкого в бронхах базальной пирамиды с переходом на шестой сегментарный бронх, верхнедолевой бронх слева и медиальную стенку левого главного бронха. С целью гистологической верификации выявленного образования проведена биопсия шпоры 9, 10 сегментарных бронхов левого легкого. Патоморфологическое заключение: фрагменты стенки бронха; данных, свидетельствующих об опухолевом росте, не выявлено.
Таким образом, на основании полученных данных у больного подтвержден диссеминированный туберкулез легких в фазе инфильтрации и распада, МБТ(+), МЛУ МБТ, в связи с чем переведен в терапевтическое отделение для получения основного курса химиотерапии. Однако с учетом данных лучевого и эндоскопического исследования сохранялась онкологическая настороженность: подозрение на наличие центрального рака левого легкого, рекомендовано проведение повторной биопсии подозрительного участка левого нижнедолевого бронха.
Пациенту была назначена химиотерапия согласно данным спектра лекарственной чувствительности МБТ (определена устойчивость к стрептомицину (S), изониазиду (H), рифампицину (R), пиразинамиду (Z), этионамиду (Et) — методом посева Bactec). Пациент получал 6ПТП — этамбутол (E) 0,8, левофлоксацин (Lfx) 0,75, циклосерин (Cs) 0,75, парааминосалициловую кислоту (PAS) 12,0, канамицин (Cm) 1,0, тиоуреидоиминометилпиридиния перхлорат (перхлозон, Трр) 600 мг. Переносимость противотуберкулезных препаратов удовлетворительная, выраженных побочных реакций не отмечалось за весь период стационарного лечения.
В связи с наличием сопутствующей сердечной патологии после дообследования выполнена коронаровентрикулография (23.09.2016). Результаты исследования: левая коронарная артерия: кальциноз устья ствола. Стеноз устья — 30%. Передняя межжелудочковая ветвь: диффузно стенотически изменена после отхождения крупной диагональной ветви с максимальным стенозом — 60%. Протяженные стенотические изменения в дистальном сегменте — 60%. Огибающая ветвь: без гемодинамически значимых стенозов. Правая коронарная артерия: малого калибра. Окклюзия ретровентрикулярной ветви с ретроградным заполнением из бассейна ЛКА. Показания к эндоваскулярной реваскуляризации не установлены, рекомендована медикаментозная терапия, абсолютных противопоказаний к предполагаемым хирургическим вмешательствам со стороны сердечнососудистой системы не выявлено.
С целью продолжающегося диагностического поиска больному дважды выполнялась фибробронхоскопия с биопсией подозрительного участка нижнедолевого бронха левого легкого. При первом исследовании (11.08.2016) (рис. 1) данных за опухолевый процесс не было получено, и только при повторной бронхоскопии с биопсией (28.10.2016) были выявлены группы атипичных умеренно полиморфных клеток немелкоклеточного рака.
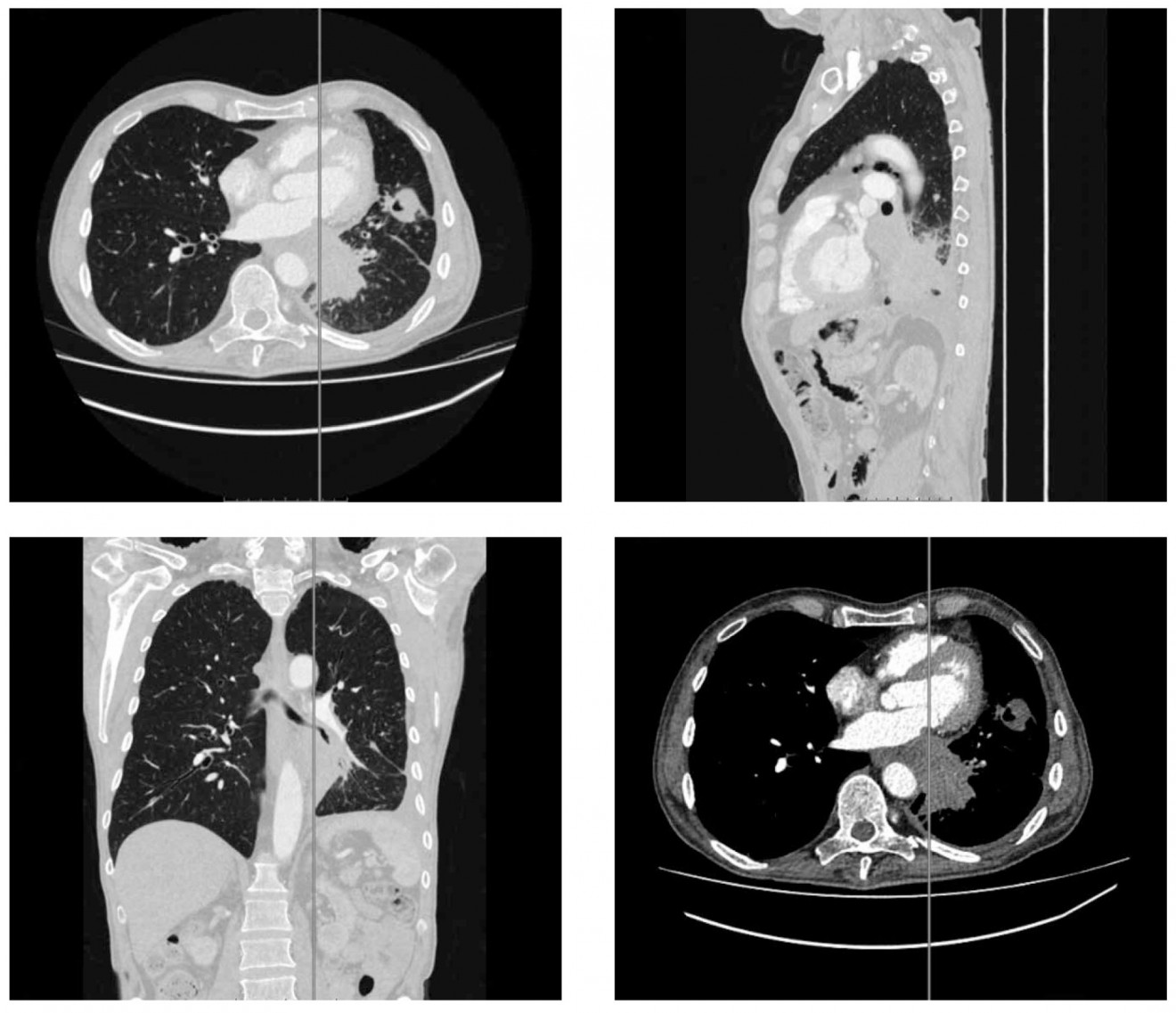 Рис. 1. Мультиспиральная компьютерная томография с внутривенным контрастированием
Рис. 1. Мультиспиральная компьютерная томография с внутривенным контрастированием
Через два месяца на фоне проводимой терапии в мокроте МБТ не обнаружены методом бактериоскопии, к сентябрю 2016 г., по данным МСКТ отмечалось уменьшение объема деструктивных изменений.
МСКТ ОГК (24.10.2016): отмечается уменьшение количества жидкости в левом гемитораксе. Частичная регрессия явлений бронхиолита в обоих легких. Уменьшается в объеме каверна в Sяз (S4–5) левого легкого. В нижней доле сохраняются явления лимфангиита, центральное образование в ее медиальном отделе. Слева в плевральной полости определяется жидкость полосой 9 мм. В полости перикарда накапливается жидкость (до 5 мм).
Заключение: КТ-картина частичного обратного течения фиброзно-кавернозного туберкулеза на фоне центрального рака в левом легком.
КТ-ангиопульмонография (08.11.2016): центральное прикорневое образование слева, сужающее просвет нижнедолевого бронха до нитевидного, с распространением перибронхиального роста на бронхи язычковой группы и дистальный отдел левого главного бронха, В1–2, В3. Субсегментарные бронхи В9, В10 не прослеживаются. Образование обрастает нижнедолевую ветвь легочной артерии, сужая ее до нитевидной, подрастает к левому предсердию, с конической ампутацией левой нижнедолевой ветви в проксимальном отделе. Подозрение на прорастание к нисходящему отделу аорты, по переднелатеральной стенке на протяжении 2,0 см.
С целью N-стадирования выполнена УЗИ-ФБС (EBUSTNBA, 14.11.2016): проведена визуализация нижних паратрахеальных групп лимфоузлов, в бифуркационной зоне увеличение лимфоузлов до 20 мм. Из групп 7, 4L выполнена аспирационная биопсия. Заключение гистологического исследования: клетки воспалительного ряда, большое количество эозинофильных лейкоцитов, данных за опухолевый процесс в лимфатических узлах нет.
Выполнен шестиминутный тест ходьбы (6MWT): пройденная дистанция 334,5 м (должный показатель 490 м), SO2 98% до нагрузки, 88% после пройденной дистанции. Заключение: II функциональный класс.
ЭКГ (08.11.2016): синусовый ритм с ЧСС 69 уд./мин, горизонтальное положение электрической оси сердца с поворотом против часовой стрелки (левым желудочком кпереди), гипертрофия левого желудочка, диффузные изменения процессов реполяризации.
Эхокардиография (07.11.2016): аорта не расширена, уплотнена, камеры не расширены, сократимость не нарушена, фракция выброса левого желудочка 65%, систолическое давление в легочной артерии 17 мм рт.ст.
Комплексное исследование функции внешнего дыхания (спирометрия, бодиплетизмография, исследование диффузионной способности легких, 08.11.2016): проходимость дыхательных путей в пределах нормы (ОФВ1 3,06 л, 93% должного, ОФВ1/ФЖЕЛ 82,5%), умеренное повышение остаточного объема легких (135% должной величины), наличие значимого невентилируемого объема легких (1,04 л), умеренное снижение легочного газообмена, частично за счет гипогемоглобинемии (диффузионная способность легких 64,2% должного, с коррекцией по гемоглобину 97 г/л — 77,5% должного).
Фиброгастродуоденоскопия (07.11.2016): оперированный желудок по Бильрот-1, недостаточность кардии, рефлюкс-эзофагит, поверхностный гастрит.
Больной обсужден на хирургическом совете, и принято решение о выполнении оперативного вмешательства.
перация 05.12.2016 г.: торакотомия слева. Плеврэктомия, декортикация левого легкого. Интраоперационно выявлено: свободная плевральная полость отсутствует в связи с тотальным заращением. Легкое выделено в экстраплевральном слое. В нижних отделах и над диафрагмой париетальная плевра резко утолщена до 1,0 см, местами плотно сращена с висцеральной, выполнена декортикация легкого, удален протяженный участок плевры с осумкованной жидкостью. При пальпаторной ревизии: в прикорневой зоне нижней доли опухолевый конгломерат, плотно спаянный с перикардом, нисходящим отделом аорты, множественные очаговые поражения легкого, имеющие разную степень плотности. В верхней доле пальпировалось плотноэластическое образование размерами 3×4 см — по рентгенологическим данным зона деструкции в окружении плотных очагов. Распространения опухоли на ствол левой легочной артерии, на проксимальную часть левого главного бронха, на экстраперикардиальную часть верхней легочной вены не выявлено. В области грудного отдела аорты — прорастание адвентициальной оболочки. После полного выделения легкого пальпаторно выяснилось, что опухоль распространялась на нижнюю легочную вену до интраперикардиальной части. Вскрыт перикард. Распространение опухолевого процесса до левого предсердия, с интрапредсердным распространением (рис. 2), занимающим более обширную часть, что требовало бы резекции предсердия. Принято решение о левосторонней пневмонэктомии с резекцией предсердия и адвентициальной оболочки аорты с предварительным подключением АИК.
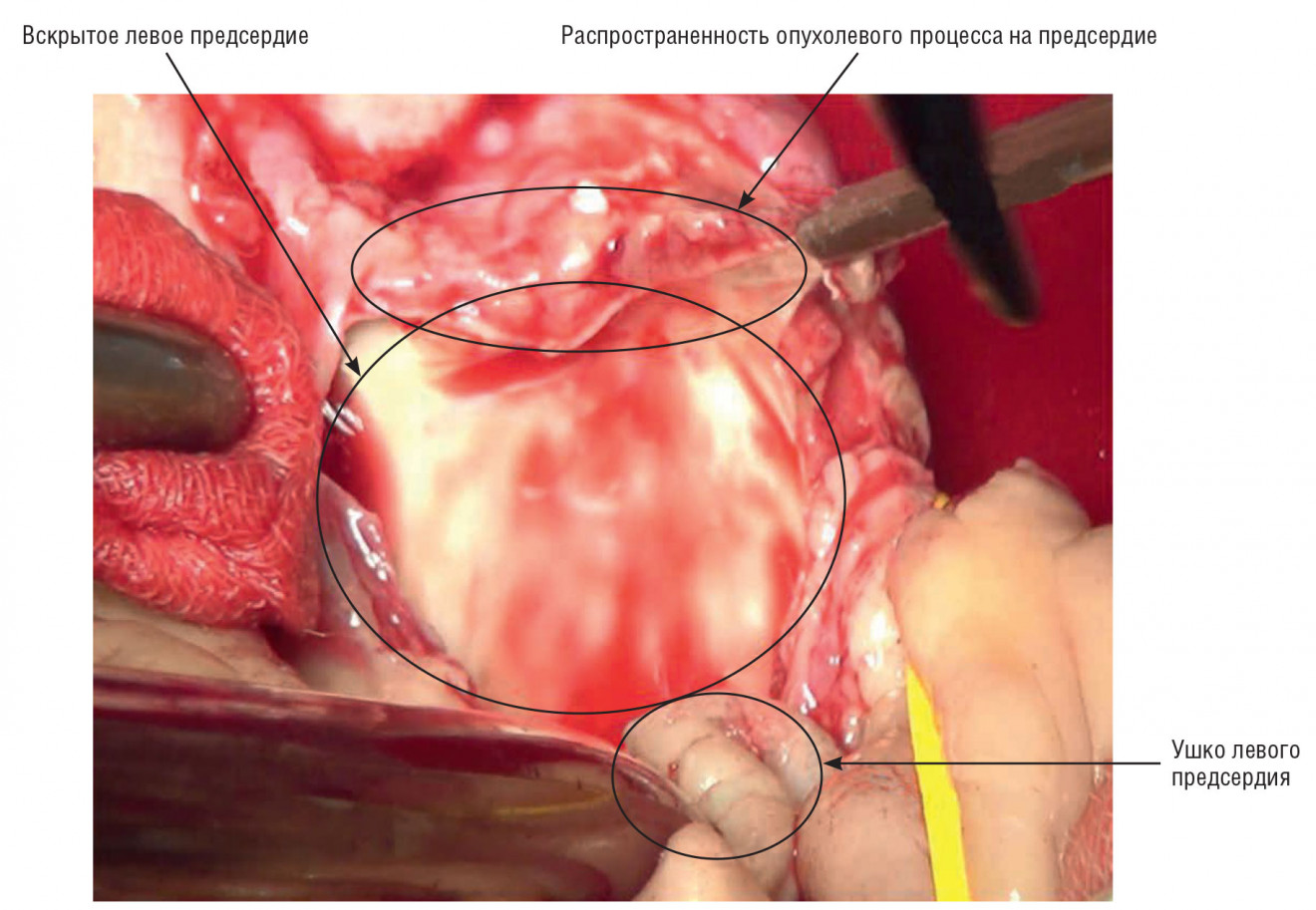 Рис. 2. Интраоперационное фото: вскрытое предсердие, участок прорастания опухолевого процесса в стенку предсердия
Рис. 2. Интраоперационное фото: вскрытое предсердие, участок прорастания опухолевого процесса в стенку предсердия
С учетом травматичного выделения легкого, высокого риска внутриплеврального кровотечения на этапе работы АИК принято решение о завершении операции дренированием плевральной полости, выполнении второго этапа операции из стернотомного доступа с бригадой кардиохирургов. Таким образом, ввиду распространенного опухолевого процесса и вовлечения в процесс предсердия показано выполнение расширенной, комбинированной, левосторонней плевропневмонэктомии в условиях искусственного кровообращения из дополнительного стернотомного доступа. Время между операциями позволит достигнуть оптимального гемостаза — и биологического, и медикаментозного — после экстраплеврального выделения легкого, так как подключение АИК предполагает введение больших доз антикоагулянтов, что может вызвать внутриплевральное кровотечение [13].
Операция 09.12.2016 г.: выполнена стернотомия, подключен АИК, выполнена комбинированная, расширенная левосторонняя плевропневмонэктомия с резекцией левого предсердия.
Гистологическое исследование удаленного участка осумкованного плеврита от 05.12.2016 г.: фрагменты плевры с фиброзом, смешанно-клеточной воспалительной инфильтрацией, эпителиоидно-клеточными гранулемами с гигантскими многоядерными клетками Лангханса, участками казеозного некроза. При окраске по Цилю–Нильсену МБТ(+). Заключение: морфологическая картина туберкулезного воспаления плевры, МБТ(+).
Гистологическое исследование операционного материала от 09.12.2016 г.: участок предсердия — среди жировой ткани группы кардиомиоцитов с очаговой гипертрофией и дистрофическими изменениями; опухоль врастает в стенку прилежащей вены на всю толщину стенки; бронх (резекция) и перибронхиальный лимфатический узел — стенка бронха типичного строения, в лимфатическом узле гистиоцитоз синусов, полнокровие; опухоль (5,5 см) — среди фиброзной ткани мелкие пласты и псевдожелезистые структуры, образованные атипичными полиморфными клетками плоскоклеточного рака с эндо- и периневральным ростом. Туберкулезный инфильтрат, окруженный фиброзной и грануляционной тканью с распадом, по периферии компактные лимфонодули; при окраске по методу Циля–Нильсена типичных МБТ не выявлено. Гистологическое заключение: плоскоклеточный рак T4N0Mх, G2; фиброзно-кавернозный туберкулез, степень активности специфического процесса 2–3, МБТ(+).
Окончательный послеоперационный диагноз:
- центральный плоскоклеточный рак нижнедолевого бронха левого легкого T4N0M0, G2, IIIA стадия с прорастанием в нижнюю легочную вену, стенку перикарда, левого предсердия, адвентицию аорты;
- фиброзно-кавернозный туберкулез левого легкого в фазе инфильтрации, МБТ(+), МЛУ (SH R Eth Z), А15.
Сопутствующий диагноз: атеросклероз с поражением коронарных артерий. Гипертоническая болезнь II степени. Риск сердечно-сосудистых осложнений 3. Ишемическая болезнь сердца. Стеноз 60% передней межжелудочковой ветви левой коронарной артерии. Окклюзия задней межжелудочковой ветви правой коронарной артерии. Стенокардия напряжения II–III функционального класса. Язвенная болезнь желудка, ремиссия. Оперативное лечение от 1973 г. — резекция 2/3 желудка. Хронический гепатит В, вне обострения. Начальная возрастная катаракта, ангиосклероз сетчатки.
Результаты и их обсуждение
Таким образом, у больного имело место сочетание центрального рака легкого с активным туберкулезным процессом. Отмечались трудности на этапе диагностики: пациенту длительное время не был установлен диагноз, несмотря на достаточный спектр проводимых диагностических мероприятий. Выявленные визуальные эндобронхиальные изменения при фибробронхоскопии, подозрительные на наличие онкологического процесса, не были сразу подтверждены данными гистологического исследования. Такие макроскопические изменения могут соответствовать как туберкулезу бронха, так и перибронхиальноузловой форме рака легкого. Патоморфологические признаки рака легкого при ФБС биопсии подозрительного участка нижнедолевого бронха в данном случае обнаружены в материале, полученном только с четвертой попытки!
При МСКТ органов грудной клетки выявлены увеличенные лимфатические узлы, что требовало обязательного инвазивного стадирования, так как при сочетанной патологии лимфаденопатия средостения может иметь как онкологическую, так и туберкулезную этиологию. В ходе обследования данного пациента признаков опухолевого поражения лимфоузлов средостения не выявлено по результатам гистологического исследования биоптатов, полученных при EBUS-TBNA.
При рентгенологическом исследовании сложность представляли картина распространения опухолевого и туберкулезного процессов и оценка степени вовлечения в процесс смежных структур. В данном случае это были нисходящая часть аорты, нижняя легочная вена, левое предсердие. Только полное экстраплевральное выделение легкого и вскрытие полости перикарда с целью пальпаторной ревизии позволило адекватно оценить степень вовлечения в процесс соседних органов и структур.
Одномоментное выполнение левосторонней комбинированной пневмонэктомии с резекцией предсердия после травматичного тотального экстраплеврального выделения легкого с подключением АИК потребовало выполнения операции в два этапа для предотвращения массивной кровопотери и гематогенного распространения специфической инфекции.
Заключение
Данный случай демонстрирует возможности радикального лечения сочетания местнораспространенного рака и деструктивного туберкулеза легкого с МЛУ МБТ. Сложности на этапах диагностики потребовали неоднократного проведения диагностических процедур. При правильном подходе на диагностическом и лечебном этапе этой категории больных может быть проведено успешное лечение в специализированном стационаре. Демонстрируемый случай подтверждает необходимость более внимательного наблюдения и тщательной диагностики у длительно болеющих больных туберкулезом, особенно в старшей возрастной группе, имеющих длительный стаж курения и сопутствующую патологию. Степень распространенности процесса требует привлечения специалистов разных сфер, в том числе и кардиохирургов.
Пациенты, которым предстоит перенести расширенное хирургическое вмешательство с резекцией крупных сосудистых структур, должны быть подготовлены к таким операциям, даже если вмешательство проводится в два этапа. В данном случае принято решение о выполнении двухэтапного хирургического вмешательства в связи с наличием у больного туберкулезного плеврита и высоким риском гематогенного распространения инфекции. Двухэтапность хирургического вмешательства представлена как вынужденная мера, так как объем операции с тотальной плеврэктомией в сочетании с антикоагулянтной терапией при подключении АИК вызвал бы обильную кровопотерю, если бы не удалось достигнуть адекватного гемостаза.
В данном случае комбинированное лечение — операция в два этапа — явилось оптимальным методом выбора. Вмешательство выполнялось на фоне полноценной химиотерапии до и после операции.





