Сальважная лимфаденэктомия у пациентов с рецидивом рака предстательной железы после радикальной простатэктомии
Отдельную группу больных, перенесших радикальную простатэктомию, составляют пациенты с изолированным рецидивом рака в лимфатических узлах, ограниченных регионарными и/или забрюшинными лимфатическими узлами. В качестве варианта лечения данной группы пациентов может быть применена лимфаденэктомия открытым или лапароскопическим (робот-ассистированным) доступом. Проведенный анализ источников литературы указывает на увеличение безрецидивной выживаемости таких пациентов при проведении лимфаденэктомии. Доступные методы визуализации, такие как мультипараметрическая магнитно-резонансная томография и позитронно-эмиссионная томография, позволяют более точно идентифицировать поражение лимфатических узлов у пациентов с биохимическим рецидивом рака предстательной железы после радикальной простатэктомии.
Введение
По данным разных авторов, биохимический рецидив (БР) после перенесенной радикальной простатэктомии может появляться в 40 % случаях1. Традиционными методами лечения пациентов с БР принято считать сальважную лучевую терапию (в случае локализованного рецидива) и гормональную терапию (в случае диссеминации процесса). Прогрессивное развитие медицинских технологий позволило выделить группу пациентов с БР рака предстательной железы (РПЖ), в лимфатических узлах (ЛУ).
Согласно рекомендациям Европейской ассоциации урологов 2017 г.2 проведение расширенной тазовой лимфаденэктомии (ТЛАЭ) оправдано у пациентов с локализованным РПЖ, если риск метастатического поражения ЛУ превышает 5 %, а также при РПЖ высокого риска. При принятии решения о выполнении расширенной ТЛАЭ большинство специалистов полагаются на номограммы, основанные на дооперационных биохимических маркерах, данных биопсии (процент пораженных биоптатов).
При расширенной ТЛАЭ выполняют удаление:
• ЛУ по ходу наружной подвздошной артерии и вены;
• ЛУ в запирательной ямке, расположенных краниально и каудально относительно запирательного нерва;
• ЛУ, расположенных медиально и латерально от внутренней подвздошной артерии;
• общих подвздошных ЛУ до перекреста с мочеточником;
• пресакральных ЛУ (у больных с высоким риском).
По мнению G. Giovacchini и соавт., пациенты с изолированным рецидивом рака ЛУ имеют более благоприятный прогноз по сравнению с больными с метастазами РПЖ в кости или внутренние органы3. Отметим, что рецидив в ЛУ может быть следствием неадекватной лимфаденэктомии при первичном лечении. Опыт последних десятилетий показывает, что большинству пациентов, перенесших радикальную простатэктомию, либо выполняли ограниченную диссекцию ЛУ (чаще в области запирательной ямки), либо лимфаденэктомию не проводили вовсе4. В этой связи клинический рецидив рака в ЛУ может быть прямым следствием неоптимальной тазовой диссекции ЛУ на начальном этапе лечения.
Материалы и методы
На кафедре урологии МГМСУ им. А.И. Евдокимова была проведена расширенная спасительная ТЛАЭ 3 пациентам, ранее перенесшим радикальную простатэктомию с верифицированным БР. В 2 случаях операция выполнена с помощью роботической системы da Vinci, в 1 случае – открытым доступом (табл. 1). Всем пациентам была проведена гормональная терапия препаратами из группы агонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ), на фоне которой средний уровень простатического специфического антигена (ПСА) составил 0,91 нг/мл. При позитронно-эмиссионной томографии/компьютерной томографии (ПЭТ/КТ) с 11С-холином, выполненной на догоспитальном этапе, во всех 3 случаях выявлено патологическое накопление препарата по ходу наружных подвздошных ЛУ слева (рис. 1), тазовых ЛУ с обеих сторон (рис. 2) и в группе запирательных ЛУ слева (рис. 3).
Таблица 1. Основные характеристики пациентов
| Показатель | Пациент №1 | Пациент №2 | Пациент №3 |
|---|---|---|---|
| Оперативное пособие | ОЛАЭ |
РАЛАЭ |
РАЛАЭ |
| Уровень ПСА, нг / мл* |
5,70 |
6,60 |
9,08 |
| Сумма баллов по шкале Глисона по данным биопсии |
7 (3 + 4) |
7 (4 + 3) |
7 (4 + 3) |
| Клиническая стадия РПЖ после первичного лечения |
pT3aN0 |
pT3aN0 |
pT3aN0 |
|
Сумма баллов по шкале Глисона по данным патогистологического заключения |
8 (4 + 4) |
7 (4 + 3) |
7 (4 + 3) |
|
Количество положительных лимфатических узлов по данным ПЭТ / КТ с 11С-холином |
3 |
7 | 5 |
| Уровень ПСА, нг / мл** |
2,20 |
1,60 |
5,37 |
| Уровень ПСА, нг / мл*** |
0,75 |
0,56 |
1,42 |
*До первичного лечения. **До проведения гормональной терапии. ***После проведения гормональной терапии. Примечание. ОЛАЭ – открытая лимфаденэктомия; РАЛАЭ – робот-ассистированная лимфаденэктомия; ПСА – простатический специфический антиген; РПЖ – рак предстательной железы; ПЭТ / КТ – позитронно-эмиссионная томография / компьютерная томография.
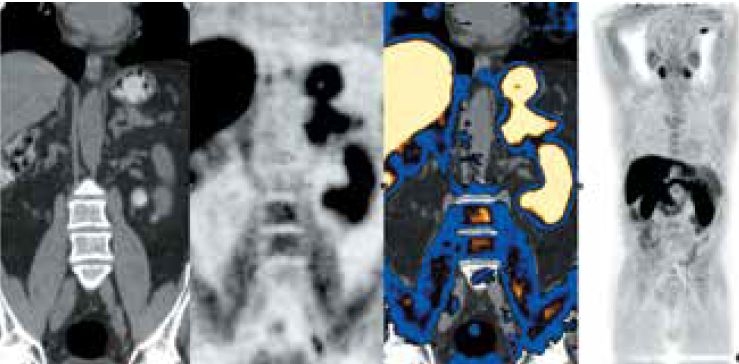 Рис. 1. Пациент № 1: позитронно-эмиссионная томография / компьютерная томография с 11С-холином. Определяется накопление препарата в наружных подвздошных лимфатических узлах
Рис. 1. Пациент № 1: позитронно-эмиссионная томография / компьютерная томография с 11С-холином. Определяется накопление препарата в наружных подвздошных лимфатических узлах
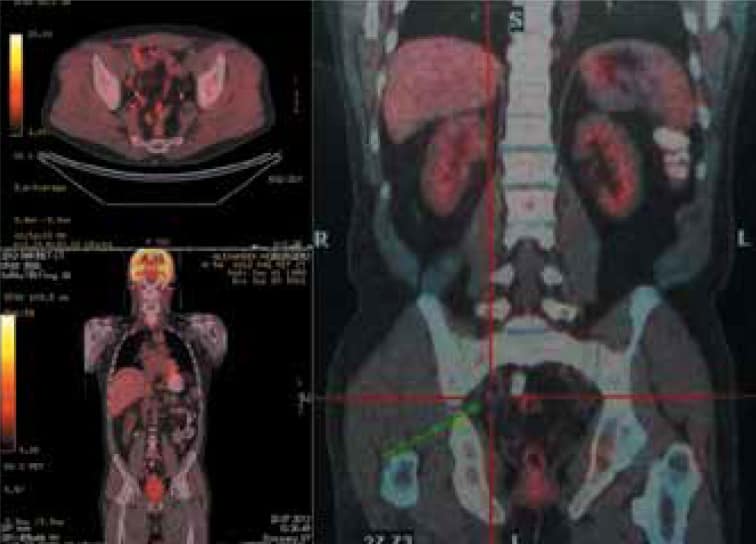
Пациент № 2: позитронно-эмиссионная томография / компьютерная томография с 11С-холином. Определяется накопление препарата в тазовых лимфатических узлах с обеих сторон (больше справа).
Отсутствие накопления препарата в ложе удаленной предстательной железы и парааортальных лимфатических узлах
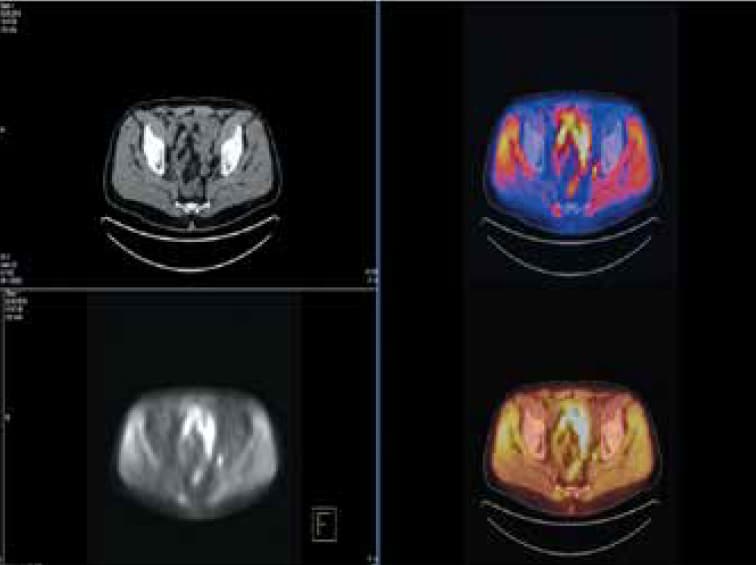
Рис. 3. Пациент № 3: позитронно-эмиссионная томография / компьютерная томография с 11С-холином. Определяется накопление препарата в запирательных лимфатических узлах (преимущественно слева) диаметром до 8 и 10 мм. Отсутствие накопления холина в ложе удаленной предстательной железы
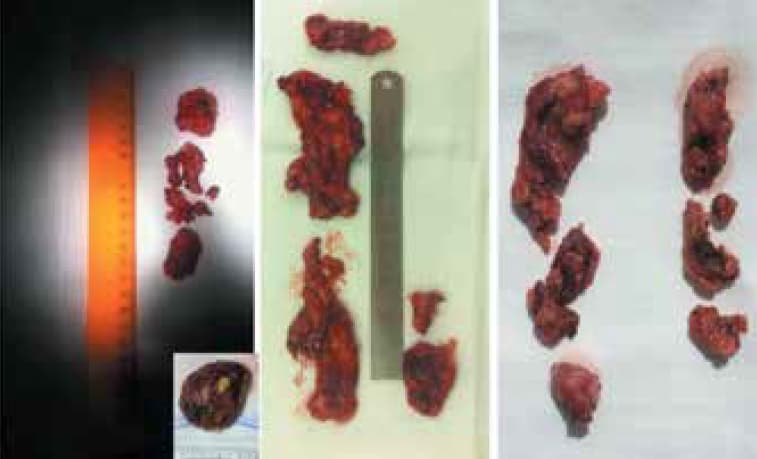 Рис. 4. Макроскопическая картина удаленных лимфатических узлов
Рис. 4. Макроскопическая картина удаленных лимфатических узлов
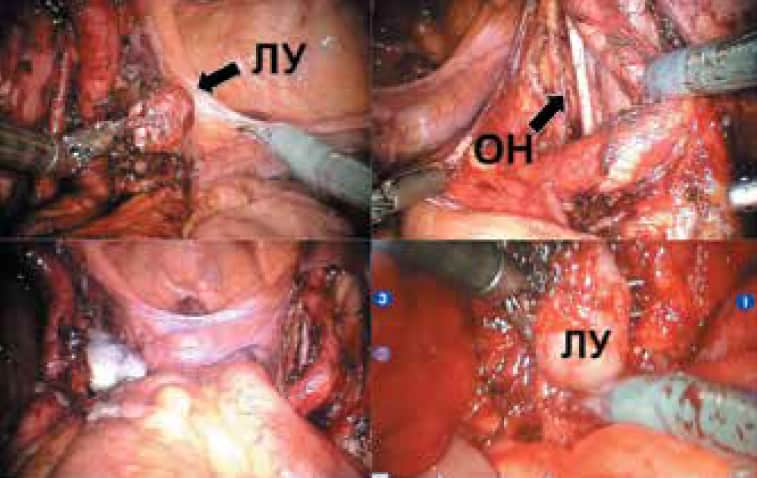
Рис. 5. Интраоперационная картина выполнения тазовой лимфаденэктомии с помощью хирургической системы da Vinci. ЛУ – лимфатический узел; ОН – обтураторный нерв
Результаты и обсуждения
В нашей серии всем пациентам сальважная ТЛАЭ была выполнена по расширенной методике с удалением всех резидуальных ЛУ в зоне лимфаденэктомии (рис. 4). Положение пациентов на операционном столе, расположение троакаров и использование роботических инструментов (монополярных ножниц, биполярного пинцета, граспера) были такими же, как при проведении робот-ассистированной простатэктомии (рис. 5). Средняя продолжительность хирургического вмешательства составила 72,6 мин (табл. 2). Периоперационных осложнений не отмечено.
Таблица 2. Результаты собственного исследования
| Показатель | Пациент №1 | Пациент №2 | Пациент №3 | Среднее значение |
|---|---|---|---|---|
|
Выполнение лимфаденэктомии до операции |
Проводилась |
Нет данных |
Нет данных |
– |
|
Количество удаленных лимфа- тических узлов (1) |
6 |
Нет данных |
8 |
7 |
|
Количество удаленных лимфа- тических узлов (2) |
11 |
18 |
16 |
15 |
|
Количество пораженных лимфатических узлов |
4 | 9 | 5 | 6 |
| Длительность операции, мин |
65,0 |
73,0 |
80,0 |
72,6 |
(1) При ранее выполненной радикальной простатэктомии. (2) При сальважной лимфаденэктомии.
Примечание. Пациенты № 1 и 3 ранее перенесли открытую и робот-ассистированную радикальную простатэктомию в клинике урологии МГМСУ им. А. И. Евдокимова, пациент № 2 – робот-ассистированную радикальную простатэктомию в другом лечебно-профилактическом учреждении г. Москвы.
На следующий день после вмешательства всем пациентам был удален уретральный катетер, восстановлено самостоятельное мочеиспускание. Страховая дренажная трубка удалена в среднем на 3-и сутки. При патогистологическом исследовании у всех больных в удаленных ЛУ выявлен рецидив аденокарциномы. С учетом данных результатов всем пациентам продолжено гормональное лечение.
Существовавшие до недавнего времени ультразвуковые и компьютерные методы визуализации не позволяли в должной степени достоверно определить наличие и / или отсутствие лимфаденопатии. В качестве перспективных методов компьютерной диагностики в настоящее время рассматривают ПЭТ / КТ и мультипараметрическую магнитно-резонансную томографию [2].
Благодаря наличию в клеточной мембране опухолевых клеток фосфатидилхолина происходит поглощение радиоактивного препарата 11С-холина, что в последующем позволяет обнаруживать данный препарат при ПЭТ. Чувствительность такого метода, по мнению ряда авторов, определена в интервале от 38 до 98 % [5–7]. Достаточно широкий диапазон связан главным образом с неоднородностью обследованных групп пациентов. F. Abdollah и соавт. представили результаты мультицентрового исследования по сравнению данных ПЭТ / КТ с последующим гистологическим подтверждением [1]. Результаты наиболее крупных исследований с применением 11С- и 18F-холина представлены в табл. 3. Проведенные исследования позволили авторам определить чувствительность (73–95 %), специфичность (40–93 %), положительную прогностическую ценность (86–92 %), отрицательную прогностическую ценность (61–87 %) и специфичность (84–90 %), что доказало высокую эффективность данного метода визуализации в диагностике поражения ЛУ.
Таблица 3. Данные ПЭТ / КТ в диагностике лимфаденопатии у больных РПЖ и / или рецидива РПЖ [2, 8–11]
| Автор, год |
Число пациентов |
Чувствительность, % |
Специфичность, % |
|---|---|---|---|
| R. A. Heesakkers и соавт., 2008 [8] |
375 | 34,0 | 97 |
| F. E. Lecouvet и соавт., 2012 [9] |
100 | 82 | 96 |
| M. G. Harisinghani и соавт., 2003 [10] |
80 | 100 | 96 |
| L. Wang и соавт., 2006 [11] |
411 | 27 | 98 |
Примечание. В исследования вошли пациенты с недавно диагностированным РПЖ с локализацией опухоли в лимфатических узлах. Магнитно-резонансный тип изображения. Относительно селективности данных нет. ПЭТ / КТ – позитронно-эмиссионная томография / компьютерная томография; РПЖ – рак предстательной железы.
D. Schilling и соавт., проанализировав результаты лечения 10 пациентов, перенесших лучевую терапию или радикальную простатэктомию с последующей лапароскопической диссекцией ЛУ, подозрительных при ПЭТ / КТ с 11С-холином, пришли к выводу, что лишь 7 больных по данным патогистологического заключения действительно имели рецидив РПЖ [12].
J. Winter и соавт. представили результаты сальважной ТЛАЭ 6 пациентов с диагностированным поражением 1 ЛУ по данным ПЭТ / КТ. Средний уровень ПСА составил 2,04 (0,67–4,51) нг / мл. У всех пациентов при патогистологическом заключении удаленных ЛУ был верифицирован РПЖ. При медиане наблюдения 24 (21–35) мес у 2 пациентов уровень ПСА не превышал 0,01 нг / мл, у 1 – 0,03 нг / мл [13].
Результаты сальважной ТЛАЭ 15 больных, имевших по данным ПЭТ / КТ рецидив РПЖ в ЛУ, представили L. Rinnab и соавт. Ни у одного пациента не было данных о наличии местного рецидива или отдаленных метастазов. Средний уровень общего ПСА составил 1,7 нг / мл, среднее число ЛУ, удаленных при ТЛАЭ, – 13,9. При медиане наблюдения 13,7 мес у 1 из 15 пациентов уровень ПСА не превышал 0,1 нг / мл; у 3 больных в последующем были обнаружены костные метастазы [14].
Возможность достоверной визуализации рецидива РПЖ в ЛУ при проведении ПЭТ / КТ с 11C-холином, по всей видимости, зависит от нескольких факторов, в том числе от уровня ПСА до проведения исследования. Так, по мнению I. de Jong и соавт., пациентам с уровнем ПСА < 5,0 нг / мл не следует назначать ПЭТ / КТ из-за высоких ложноотрицательных результатов [5]. Тем не менее в последующих работах, оценивающих применение ПЭТ / КТ у больных с уровнем ПСА < 0,5 нг / мл, данные о ложноотрицательных результатах не получены [15]. M. Mamede и соавт. отметили, что помимо уровня ПСА на результат исследования также влияет наличие проводимого гормонального лечения [16]. Выполненные исследования показывают, что независимо от количества положительно идентифицированных ЛУ по данным ПЭТ / КТ лимфаденэктомия должна проводиться по расширенной методике [17].
В 2011 г. P. Rigatti и соавт. оценили результаты лечения 72 пациентов, перенесших сальважную ТЛАЭ. У всех больных, которым ранее была выполнена радикальная простатэктомия, зарегистрированы признаки БР, однако отсутствовали данные о наличии местного рецидива и отдаленных метастазов [18]. Результаты этого и других наиболее крупных исследований последних 5 лет представлены в табл. 4.
| Автор, год |
Число пациентов |
Средний уровень ПСА до операции, нг /мл |
Среднее количество удаленных ЛУ |
Среднее количество пораженных ЛУ |
Сумма баллов по шкале Глисона |
Медиана наблюдения, мес. |
5-летняя БРВ, % |
5-летняя ВБП, % |
5-летняя РСВ, % |
|---|---|---|---|---|---|---|---|---|---|
|
L. Rinnab и соавт., 2008 [14] |
15 | 1,7 |
13,9 |
н / д |
н / д |
13,7 |
н / д |
н / д |
н / д |
|
P. Rigatti и соавт., 2011 [18] |
72 | 3,7 |
30,6 |
9,8 |
2–6 (18 %) 7 (44,4 %) 8–10 (37,6 %) |
39,4 |
19,0 |
34,0 |
75,0 |
|
C. A. Jilg и соавт., 2012 [19] |
52 | 3,9 |
23,3 |
9,7 |
2–6 (23 %) 7 (46 %) 8–10 (31 %) |
35,5 |
9,0 |
26,0 |
78,0 |
|
N. Suardi и соавт., 2013 [20] |
162 | 3,6 |
24,6 |
6,1 |
н / д |
29,2 |
40,0 | 47,0 |
86,0 |
|
N. Suardi и соавт., 2015 [21] |
59 | 3,9 |
29,5 |
8,9 |
2–6 (20,3 %) 7 (44,1 %) 8–10 (35,6 %) |
81,1 |
29,4 |
52,0 |
89,1 |
Примечание. ПСА – простатический специфический антиген; ЛУ – лимфатические узлы; БРВ – безрецидивная выживаемость; ВБП – выживаемость без прогрессирования; РСВ – раковоспецифическая выживаемость; н / д – нет данных.
Робот-ассистированная простатэктомия с расширенной ТЛАЭ может сопровождаться повышением общей частоты хирургических осложнений [22]. Так, по мнению P. Rigatti и соавт., C. A. Jilg и соавт., наиболее частыми осложнениями после перенесенной сальважной ТЛАЭ являются лимфорея (15,3 %), лихорадка (14,5 %) и кишечная непроходимость (11,2 %). В редких случаях были травмы мочеточника (0,8 %) и необходимость повторных вмешательств (1,6 %) [18, 19]. Иногда после перенесенной лимфаденэктомии можно встретить лимфоцеле и отек нижних конечностей.
Выводы
В настоящее время имеющиеся данные литературы показывают, что проведение сальважной радикальной ТЛАЭ наиболее оправдано у пациентов c уровнем ПСА < 4 нг / мл, суммой баллов по шкале Глисона ≤ 7, а также при условии отсутствия сведений о наличии местного рецидива и отдаленных метастазов. Выполнение тако- го вида сальважного лечения позволяет большинству пациентов отсрочить назначение гормональной терапии, что теоретически может уменьшить стоимость лечения. Больным с подозрением на рецидив РПЖ могут быть рекомендованы ПЭТ / КТ и мульти параметрическая магнитно-резонансная томография. Дальнейшее проведение проспективных рандомизированных исследований позволит рекомендовать сальважную лимфаденэктомию большему числу пациентов.







