Робот-ассистированная тазовая лимфаденэктомия с использованием ICG-диагностики у пациентов с раком предстательной железы
Введение
Радикальная простатэктомия (РПЭ) у пациентов с локализованными формами рака предстательной железы (РПЖ) обеспечивает длительный онкологический контроль 1, 2. Робот-ассистированная РПЭ в последние годы наряду с открытой и лапароскопической РПЭ рассматривается в качестве стандарта лечения локализованного РПЖ 3, 4.
Необходимо отметить, что метастазирование в лимфатические узлы связано с уменьшением как выживаемости без биохимического рецидива, так и общей продолжительности жизни. При этом основной проблемой остается точность стадирования онкологического процесса 5. Чувствительность современных методов предоперационной диагностики для оценки метастатического поражения тазовых лимфатических узлов не превышает 40 % 6–8.
По данным исследований, РПЭ в сочетании с тазовой лимфаденэктомией (ТЛАЭ) дает преимущество в выживаемости у больных с метастатическим поражением регионарных лимфатических узлов. Так, при стадии РПЖ Т1а метастазы в регионарных лимфатических узлах наблюдают в 0–3 % случаев, при Т1b – в 3,3– 24,0 %, при Т2а – в 5,3–12,0 %, при Т2b – в 9,7– 43,0 %, а при опухолях Т3 лимфогенное метастазирование выявляют у 44–60 % больных 9.
В рекомендациях урологических ассоциаций существуют разногласия, касающиеся показаний к выполнению ТЛАЭ и ее объему, кроме того, предложены различные критерии отбора пациентов для проведения лимфаденэктомии 10, 11.
Значимым технологическим продвижением стало включение в роботизированную платформу флуоресцентного мониторинга в ближней инфракрасной (ИК) области спектра с использованием индоцианина зеленого (ICG) (система FireFly (Novadaq Technologies Inc.), встроенная в роботическую систему DaVinci Si), который на сегодняшний день активно изучается в различных областях хирургии, включая урологию. После первого сообщения S. Tobis и соавт. в 2012 г. об использовании флуоресценции в ближней ИК-области спектра и ICG в качестве маркера в роботизированной резекции почки метод стали применять и в других областях хирургии 12.
Цель исследования – изучение возможности применения флуоресцентного исследования при робот - ассистированной РПЭ с использованием ICG-диагностики во время ТЛАЭ у пациентов с локализованным РПЖ.
Материалы и методы
При оперативном вмешательстве использовали стандартный набор роботических инструментов, включая ножницы DaVinci Hot Shears, зажим Maryland, фенестрированный зажим ProGrasp, клипсы Hem-o-Lock, аспиратор Elefant (Coloplast). Техника робот-ассистированной ТЛАЭ с применением ICG не отличается от стандартной. Этап ТЛАЭ выполняли перед РПЭ.
Было проведено интрапростатическое трансперинеальное введение ICG под трансректальным ультразвуковым контролем в количестве 0,4 мл в каждую долю за 15 мин до начала оперативного вмешательства. Использовали карту флуоресценции, разработанную T. B. Manny и соавт., согласно которой время до начала флуоресценции в тазовых лимфатических узлах составляет 20–35 мин. При этом среднее время достижения флуоресценции для «сигнальных» лимфатических узлов – 25 мин (рис. 1) 13.
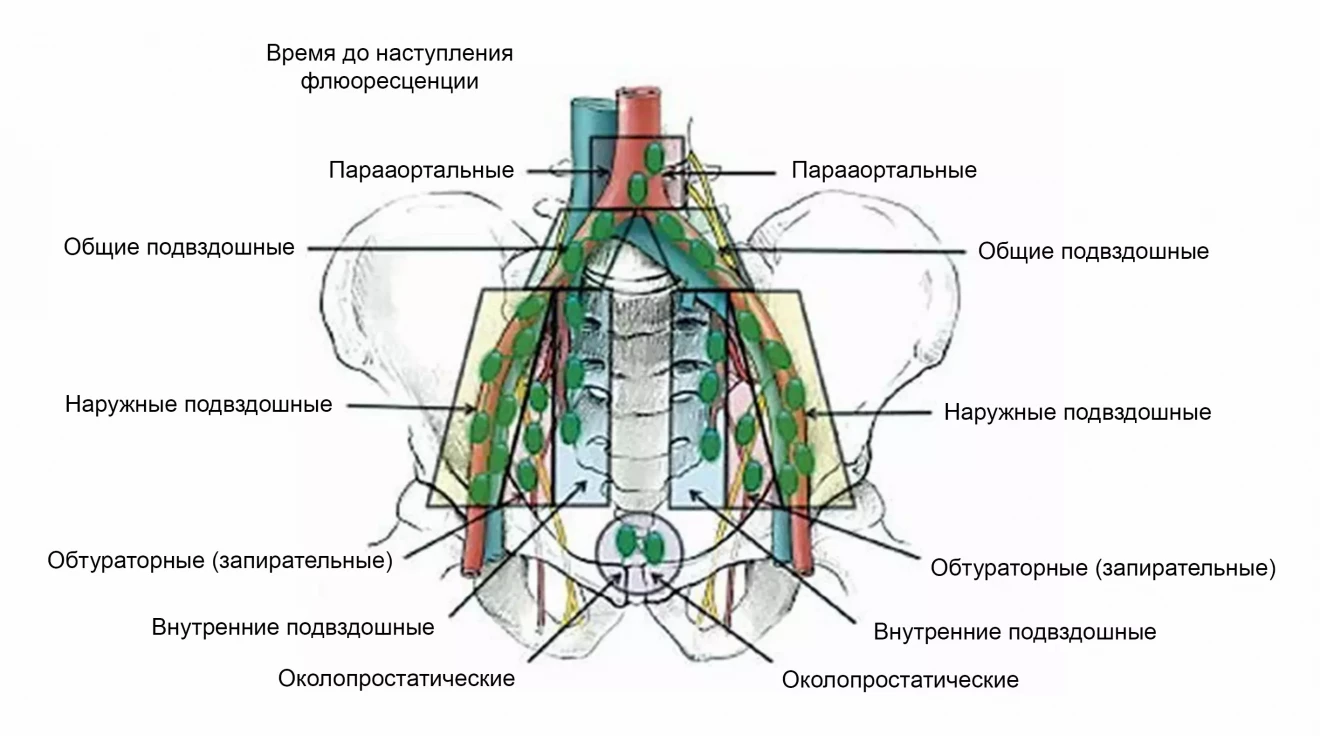 Рис. 1. Карта флуоресценции тазовых лимфатических узлов после интрапростатического введения индоцианина зеленого
Рис. 1. Карта флуоресценции тазовых лимфатических узлов после интрапростатического введения индоцианина зеленогоВсем пациентам выполняли стандартную робот-ассистированную ТЛАЭ. После доступа в Ретциево пространство третьим манипулятором производили медиальную тракцию мочевого пузыря. После активации режима FireFly проводили оценку флуоресценции лимфатических узлов. В зависимости от паттерна флуоресценции определяли характер накопления ICG, наличие «сигнальных» лимфатических узлов. При наличии «сигнального» лимфатического узла выполняли лимфаденэктомию с использованием режима FireFly (рис. 2). В случае диффузного характера флуоресценции ТЛАЭ с применением данной опции не проводилась.
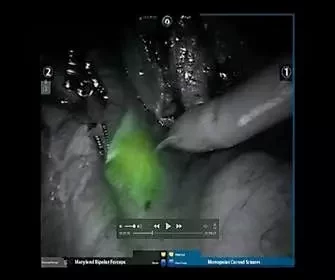 Рис. 2. Флуоресценция «сигнального» лимфатического узла при активации режима FireFly на роботической системе DaVinci Si
Рис. 2. Флуоресценция «сигнального» лимфатического узла при активации режима FireFly на роботической системе DaVinci SiПри выявлении флуоресценции выполняли преимущественно «острую» диссекцию лимфатической ткани. После деликатной препаровки лимфатического узла поочередно активировали режим FireFly (рис. 3) и стандартный осветитель (рис. 4). Удаление лимфатического узла проводили единым блоком.
 Рис. 3. Мобилизация «сигнального» лимфатического узла с использованием режима FireFly
Рис. 3. Мобилизация «сигнального» лимфатического узла с использованием режима FireFly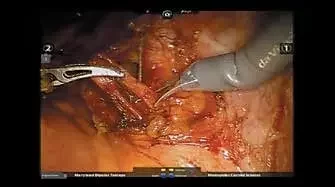 Рис. 4. Мобилизация «сигнального» лимфатического узла при стандартном освещении
Рис. 4. Мобилизация «сигнального» лимфатического узла при стандартном освещенииПри этом выполняли селективное выделение и клипирование лимфатических сосудов, выявленных при флуоресцентной лимфангиографии. Мы использовали клипсы Hem-o-Lock 10 мм (рис. 5).
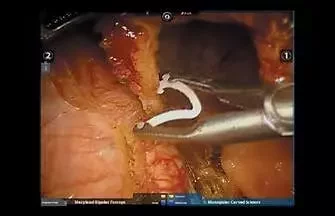 Рис. 5. Клипирование лимфатических протоков с использованием клипс Hem-o-Lock 10 мм
Рис. 5. Клипирование лимфатических протоков с использованием клипс Hem-o-Lock 10 ммЭтап лимфаденэктомии завершали раздельным извлечением лимфатических узлов с маркировкой для последующего гистологического исследования. Следует отметить, что сторожевые лимфатические узлы маркировали отдельно, с указанием стороны локализации.
Результаты
Всем больным была проведена двусторонняя робот-ассистированная ТЛАЭ с последующей робот-ассистированной РПЭ. Оперативные вмешательства выполнены 3 хирургами. Средняя продолжительность операции составила 128 мин, конверсий не потребовалось ни в одном случае. В период с 1 января 2017 г. по 1 декабря 2017 г. были прооперированы 35 пациентов с локализованным РПЖ. Средний возраст пациентов, включенных в исследование, составил 62,0 ± 6,5 года (41–68 лет), средний уровень простатического специфического антигена до операции – 15,6 ± 11,3 нг/мл (1,5–27,0 нг/мл). У 28 пациентов диагностирован РПЖ промежуточного риска, у 8 – высокого риска. По данным магнитно-резонансной томографии малого таза у 30 пациентов отсутствовали признаки тазовой лимфаденопатии, у 6 отмечалось увеличение лимфатических узлов от 15 до 23 мм. Индекс массы тела составил 25 кг/м2. Число удаленных лимфатических узлов составило от 6 до 18 с обеих сторон, в среднем 14. При лимфаденэктомии мы проводили двустороннее удаление обтураторных наружных и вну- тренних подвздошных лимфатических узлов.
Локализация флуоресцирующих «сигнальных» лимфатических узлов, выявленная при интраоперационном использовании режима FireFly, представлена в таблице.
Локализация флуоресцирующих лимфатических узлов
| Локализация | Число пациентов, n |
| Запирательные лимфатические узлы | 21 |
| Лимфатический узел Клоке | 1 |
| Наружные подвздошные лимфатические узлы | 5 |
| Внутренние подвздошные лимфатические узлы | 2 |
| Диффузная флуоресценция | 6 |
Во всех случаях нами идентифицированы лимфатические протоки, дренирующие предстательную железу. У 6 (17 %) пациентов выявлено множественное накопление ICG в лимфатических узлах (диффузная флуоресценция). При послеоперационном исследовании в 7 (20 %) случаях обнаружены микрометастазы в лимфатических узлах. «Сигнальные» лимфатические узлы выявлены у 29 пациентов. При интраоперационном исследовании в 6 (17 %) случаях обнаружены метастазы в «сигнальном» лимфатическом узле, в остальных (83 %) случаях метастазы отсутствовали. При морфологическом исследовании у 5 (83 %) из 6 пациентов с поражением «сигнального» лимфатического узла обнаружены микрометастазы в других лимфатических узлах. У пациентов с отсутствием поражения «сигнального» лимфатического узла не выявлено микрометастазов в других лимфатических узлах.
Осложнения ТЛАЭ включали лимфоцеле у 3 (8 %) больных, длительное сохранение отделяемого по дренажам у 5 (14 %).
Обсуждение
В 3 крупных исследованиях показано преимущество РПЭ над выжидательной тактикой и активным наблюдением у мужчин с РПЖ низкого и промежуточного риска 14–16. При этом в рекомендациях Европейской ассоциации урологов предложены различные критерии отбора пациентов для выполнения ТЛАЭ. Так, согласно рекомендациям Национальной всеобщей онкологической сети США (NCCN, 2017) ТЛАЭ не показана при вероятности поражения лимфатических узлов <2 %, рассчитанной по номограмме. В рекомендациях Европейской ассоциации урологов этот порог составляет 5 %; кроме того, ТЛАЭ показана всем пациентам группы высокого риска (T2с, или сумма баллов по шкале Глисона 8–10, или уровень простатического специфического антигена >20 нг/ мл) 10. Разногласия сводятся к определению группы риска заболевания, для которой необходимо выполнение процедуры, а также к обсуждению объема диссекции.
Существуют разногласия по объему лимфаденэк- томии 17. Ее преимущества при локализованных
формах РПЖ включают 18:
- точное прогнозирование риска отдаленного метастазирования;
- оценку необходимости адъювантной терапии.
При рассмотрении преимуществ расширенной лимфаденэктомии необходимо также учитывать увеличение риска развития осложнений по сравнению с ограниченной диссекцией. Число пораженных и удаленных лимфатических узлов, объем опухоли и пер- форация капсулы лимфатического узла являются прогностическими факторами развития раннего рецидива после РПЭ у пациентов с метастатическим поражением 19. Несмотря на очевидные преимущества, рядом исследований продемонстрирован высокий риск расширенной лимфаденэктомии, при которой доля осложнений может достигать 22 % 20. При этом частота осложнений и длительность госпитализации зависят от количества удаленных лимфатических узлов 18, 21. Кроме того, H.G. van der Poel и соавт. предположили вероятность более низкого восстановления половой функции у пациентов после ТЛАЭ 22.
С учетом высокого риска развития осложнений исследователи ведут поиски оптимальных методов, снижающих частоту неблагоприятных последствий ТЛАЭ. Одно из перспективных направлений данного поиска – внедрение режима FireFly для ICG-диагностики в роботические системы DaVinci Si.
Индоцианин зеленый – водорастворимое контрастное вещество, преимуществами которого являются низкая токсичность и возможность обнаружения флуоресцентной камерой в ближней ИК-области спектра. Данное вещество может эффективно применяться во время простатэктомии, что обусловлено его способностью маркировать простатическую ткань, при этом действуя как препарат лимфангиографии, визуализирующий региональное лимфатическое дренирование предстательной железы. По данным опубликованных исследований, доза ICG 1 мг (0,4 мл) в каждую долю оказалась связанной с адекватной флуоресценцией лимфатических узлов. Методика дозировки препарата обоснована и протестирована впервые T.B. Manny и соавт. на 60 пациентах. Кроме того, по данным H.G. van der Poel и соавт., ICG оказался специфичным у 76 % пациентов при определении «сигнальных» лимфатических узлов, а также высокоспецифичным у 100 % пациентов при определении регионарного метастазирования 13, 23–26.
В нашем исследовании всем пациентам проводилась ТЛАЭ с интраоперационным введением ICG. В случае выявления «сигнального» узла выполняли раздельное от других лимфатических узлов удаление последнего в целях оценки метастатического поражения. По результатам проведенного нами исследования можно заключить о 100 % частоте встречаемости метастатического поражения «сигнальных» узлов при наличии метастатического поражения других лимфатических узлов.
С учетом риска развития осложнений, связанных с ТЛАЭ, перспективным подходом может являться отказ от расширенных подходов к данной процедуре при отсутствии метастатического поражения «сигнального» лимфатического узла, выявляемого при интраоперационном морфологическом исследовании.
Необходимо отметить, что всесторонняя оценка ICG-диагностики в определении лимфогенного метастазирования возможна после проведения многоцентровых исследований с включением большего числа пациентов.
Заключение
Робот-ассистированная ТЛАЭ продолжает оставаться операцией высокой степени сложности, со значительным потенциалом развития осложнений. Инициальный опыт нашей клиники показывает воспроизводимость и низкий профиль осложнений флуоресцентного мониторинга в ближней ИК-области спектра с использованием ICG-диагностики при выполнении робот-ассистированной ТЛАЭ. В условиях непрерывного увеличения количества выполняемых робот-ассистированных РПЭ ICG-диагностика является перспективным минимально-инвазивным методом оценки регионарного метастазирования, позволяющим выявить «сигнальный» лимфатический узел с последующем его удалением для морфологического исследования. Данный подход позволяет снизить количество осложнений, связанных с ТЛАЭ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проведено без спонсорской поддержки.
Информированное согласие. Все пациенты подписали информированное согласие на участие в исследовании.
Для цитирования: Абоян И.А., Пакус Д.И., Пакус С.М. и др. Робот-ассистированная тазовая лимфаденэктомия с использовани- ем ICG-диагностики у пациентов с раком предстательной железы. Онкоурология 2018;14(3):51–7.
Контакты: Сергей Михайлович Пакус sergejj.pakus@rambler.ru
МБУЗ «Клинико-диагностический центр «Здоровье» города Ростова-на-Дону»; Россия, 344011 Ростов-на-Дону, пер. Доломановский, 70/3










