Робот-ассистированная резекция почки при опухолях T1b: результаты трифекты
Нефрон-сберегающая хирургия (НСХ) остается наиболее предпочтительным хирургическим подходом для лечения пациентов с опухолями почек в стадиях T1a (≤ 4 см), T1b (4–7 см), когда это технически возможно. Большинство урологов согласятся с тем, что НСХ сейчас более предпочтительна, чем радикальная нефрэктомия 1. Минимально инвазивная хирургия, с применением робота или без него, имеет много преимуществ перед традиционной открытой хирургией: небольшие надрезы обеспечивают значительно меньшую боль, более быстрое восстановление, менее продолжительное пребывание пациента в больнице и скорое возвращение к обычной жизни 2, 3. Кроме того, в настоящее время эволюция в развитии лапароскопии способствовала внедрению роботизированных платформ, что позволило перенести опыт из лапароскопических операций к этой новой технологии, а робот-ассистированная резекция почки (РАРП) заменила стандартную лапароскопию во многих центрах 4. Постепенно более крупные и более сложные опухоли почек были оперированы при помощи роботических систем, что дало обнадеживающие результаты 5, 6.
Термин «трифекта» (3 основных фактора) – относительно новая концепция, используемая в литературе при оценке результатов радикальной простатэктомии, она была применена, для того чтобы сообщить об итогах резекции почки. Впервые данный термин использовали A.J. Hungи соавт. в 2013 г. 7, он включал достижение отрицательного хирургического края, минимальное снижение функции почек и отсутствие осложнений. Поскольку сохранение функции почек коррелирует со временем тепловой ишемии (ВТИ), некоторые авторы считают, что ВТИ ≤ 25 мин является составной частью трифекты 8, 9. Таким образом, после первого упоминания использовали различные критерии трифекты. В некоторых исследованиях она определялась как отсутствие осложнений, отрицательный хирургический край и ВТИ ≤ 25 мин 8, 9. Трифекта не стандартизирована, в современной литературе имеются редкие данные, сообщающие о таких результатах по робот-ассиcтированным резекциям почек (РАРП) в стадиях T1a, T1b. В данном исследовании для более точной оценки сохранения функции почек учитывали как ВТИ, так и скорость клубочковой фильтрации (СКФ) спустя 30 сут после оперативного вмешательства. Пациенты с отсутствием осложнений II степени и выше по модифицированной классификации Clavien–Dindo, ВТИ ≤ 25 мин, послеоперационным изменением СКФ ≤ 15% и отрицательным хирургическим краем подходили под строгие критерии трифекты. Чтобы доказать более широкое применение РАРП в стадиях T1a, T1b и ее безопасность, необходимы дальнейшие стандартизированные доказательства, потому что в литературе представлены результаты исследований на небольших группах, в основном мелких опухолей почек (≤ 4 см) с нестандартизированной оценкой результатов. В настоящей статье представлены данные одной из крупнейших одноцентровых серий РАРП, с точки зрения (строгих) критериев трифекты при лечении опухолей в стадии T1b.
Материал и методы
Дизайн исследования. Ретроспективный анализ пациентов, которым РАРП были выполнены одним хирургом с января 2014 г. по февраль 2018 г. Из этой когорты были выбраны пациенты с диаметром опухоли от 4 до 7 см (стадия T1b). Показатели предоперационной характеристики включали возраст, индекс массы тела (ИМТ), оценку физического состояния Американского общества анестезиологов (ASA), сопутствующие заболевания, уровни гемоглобина и креатинина в сыворотке, СКФ, размер и локализацию опухоли и балл по нефрометрической системе ABC. Интра- и послеоперационные данные включали время оперативного вмешательства, ВТИ, состояние хирургического края, предполагаемую кровопотерю (ПК), продолжительность пребывания в стационаре, длительность стояния дренажа и уретрального катетера, интра- и послеоперационные осложнения, послеоперационные уровни креатинина сыворотки крови и гемоглобина, СКФ, гистологический тип и градацию по Fuhrman (если можно применить) и последующий период. Уровень СКФ оценивали спустя 1 мес после операции 9. Шкалу ABC использовали для классификации пациентов в соответствии с их индивидуальными анатомическими особенностями 10.
Пациентам выполняли компьютерную (КТ) или магнитно-резонансную томографию (МРТ) до операции, подробно изучали сосудистую анатомию почек на изображениях. Стоит отметить, что РАРП выполняли даже в тех случаях, когда опухоль была полностью интрапаренхимной, располагалась вблизи ворот почки, в проекции верхнего сегмента задней поверхности и превышала 7 см в диаметре. Осложнения, возникающие в первые 90 сут после операции, фиксировали и классифицировали по модифицированной системе Clavien–Dindo. Наблюдение за пациентом состояло из посещений через 1 и 3 мес, далее каждые 3 мес в течение первого года, в последующем каждые 6 мес в течение 2–3 лет. Физикальный осмотр и ультразвуковую визуализацию выполняли при каждом посещении, при 12-месячном контроле выполняли КТ.
Пациенты с отсутствием осложнений II степени и выше по модифицированной классификации Clavien–Dindo, ВТИ ≤ 25 мин, послеоперационном изменении СКФ ≤ 15% и отрицательным хирургическим краем достигали строгих критериев трифекты. Статистическуюобработкурезультатов выполняли с использованием программ Excel (Microsoft) и Statistica 6.0 (StatSoft).
Техника операции
Все операции выполнял один хирург, имеющий большой хирургический опыт, с помощью роботизированной системы. Операции выполняли с использованием 2 хирургических систем da Vinci (SС, Si; Intuitive Surgical, Sunnyvale, California, USA) на протяжении многих лет. Пациента располагали в модифицированном фланговом положении больной стороной вверх, без разлома операционного стола с целью сохранения анатомичности. Пневмоперитонеум создавали доступом по Хассoну (Hasson). Использовали 5-портовую конфигурацию, добавлен еще один порт для ретракции печени при опухоли правой почки (см. рисунок).
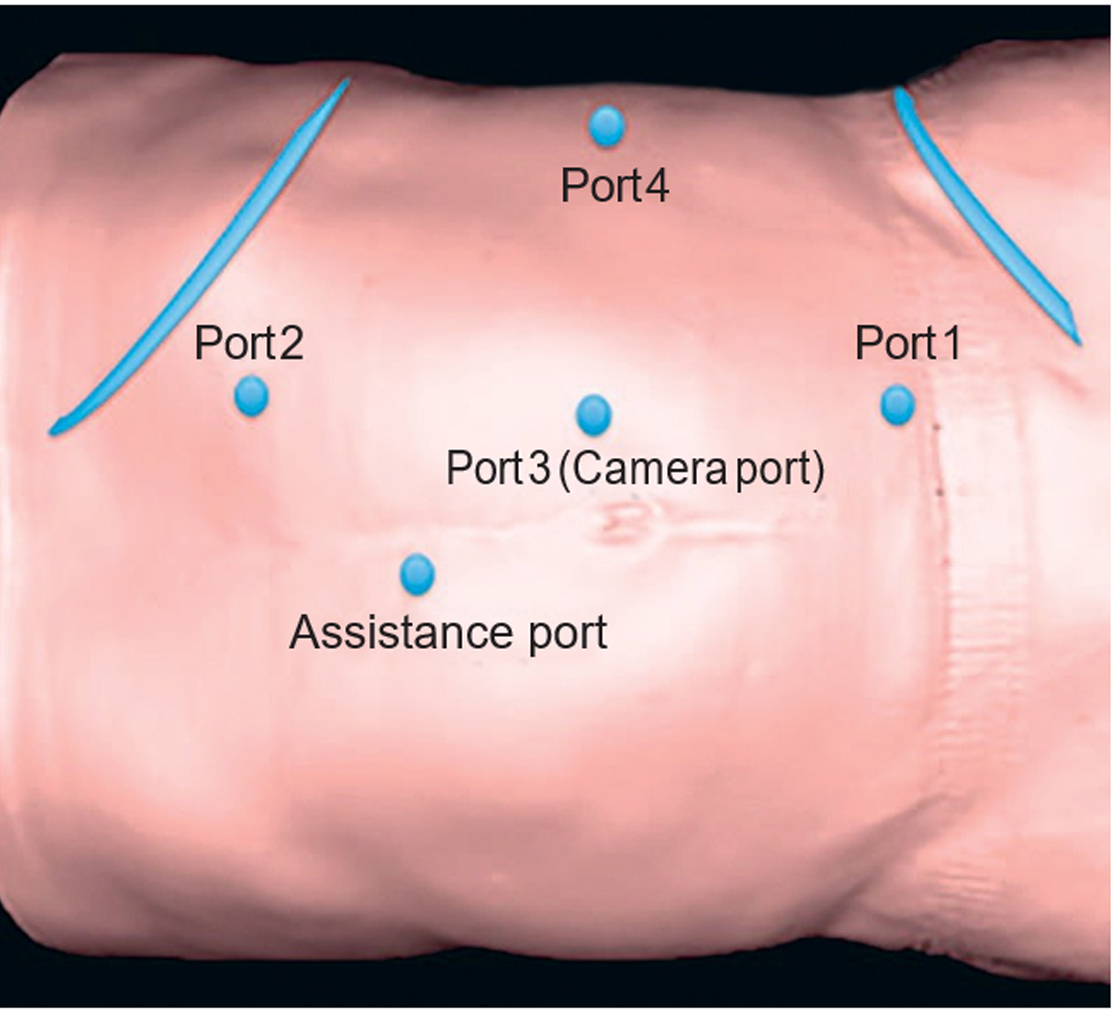 Операционное поле: 5-портовая конфигурация
Операционное поле: 5-портовая конфигурацияПосле мобилизации кишки выполняли диссекцию почечной ножки. Почечную артерию визуализировали, обрабатывали и подготавливали для наложения сосудистой клеммы. Под контролем интраоперационного ультразвукового исследования (УЗИ) на поверхности почки выполняли разметку границ опухоли, а также оценивали ее близость к собирательной системе почки. Почечную артерию пережимали 1 или 2 сосудистыми зажимами типа «бульдог» (Scanlan International, St. Paul, Minnesota, USA). Затем опухоли вырезали, используя резекцию, энуклеацию или комбинацию обоих способов – энуклеорезекцию, в зависимости от индивидуальной анатомии. Дефект паренхимы почки ушивали двухрядным, в ряде случаев однорядным обвивным швом с помощью шовного материала 3/0 V-Loc (Medtronic, Minneapolis, Minnesota, USA) с целью создания гемостаза и герметичности собирательной системы почки (если вскрывалась). Натяжение швов контролировали скользящими клипсами Hem-o-Lok (Teleflex, Morrisville, North Carolina, USA). Дополнительный гемостаз в области резекции осуществляли коагуляцией и гемостатическим материалом, затем зажим типа «бульдог» удаляли, а хирургическое поле контролировали на кровотечения. Интраоперационное дренирование верхних мочевых путей внутренним j-j-стентом не проводилось ни одному пациенту.
Результаты
Основу работы составляют результаты хирургического лечения 109 пациентов с опухолями почек, потребовавших выполнения РАРП. Представленные данные фокусируются на 41 пациенте, размер выявленной опухоли у них составлял 4–7 см. Средний возраст и ИМТ этих пациентов составляли 57,7± 4,5 года и 25,3±5,8 кг/м2, соответственно. Средний размер опухоли в макроскопическом образце – 52,12±9,26 мм. Левая почка оказалась стороной поражения у 20 пациентов, правая – у 21 пациента. Из 41 пациента с опухолью pT1b у 37 пациентов были сопутствующие заболевания (у 33 гипертоническая болезнь, у 2 сахарный диабет, еще у 2 сердечно-сосудистые заболевания); средняя оценка операционно-анестезиологического риска по ASA – 1,9±0,7. Средняя оценка по шкале ABC: 2 пациента – 1; 12 пациентов – 2; 3 пациента – 3h; 24 пациента – 3s.
Характеристики пациентов и операционные данные приведены в табл. 1.
Таблица 1. Характеристики пациента и оперативные данные
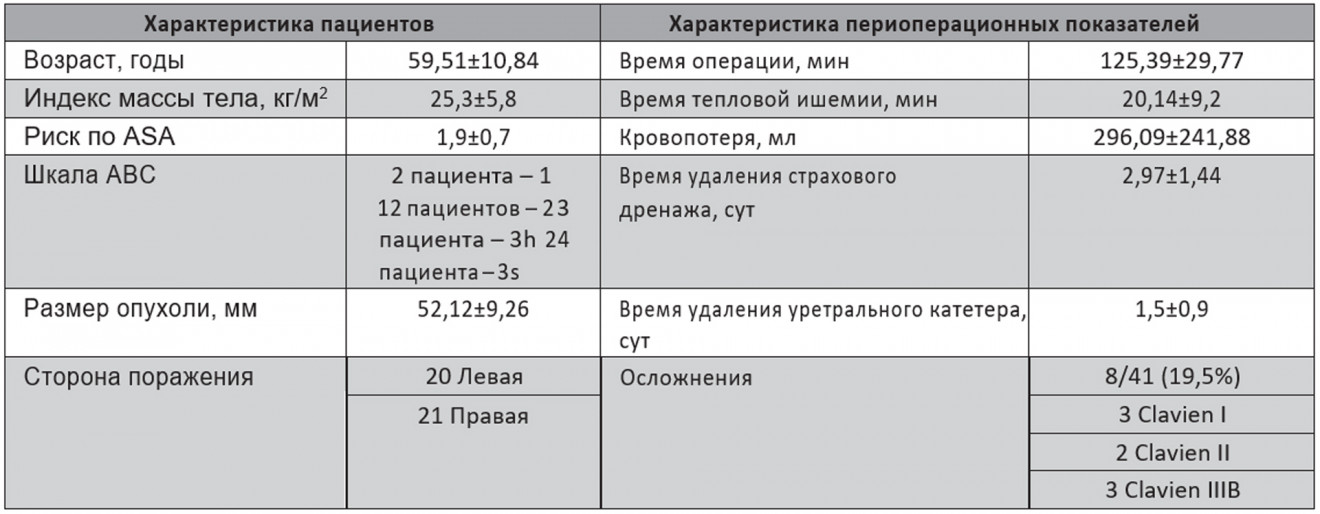
Средняя продолжительность операции составила 125,39±29,77 мин, средний показатель ВТИ – 20,14±9,2 мин, средний объем кровопотери – 296,09±241,88 мл. ВТИ >25 мин наблюдалось у 11 (26,8%) пациентов. Патоморфологическая оценка соответствовала светлоклеточной карциноме у 30 (73,1%), папиллярной карциноме 1-го типа у 1 (2,4%), папиллярной карциноме 2-го типа у 3 (7,3%) и хромофобной карциноме у 3 (7,3%). У 1 (2,4%) пациента гистологически диагностирована ангиомиолипома, у 2 (4,8%) верифицирована онкоцитома, у 1 (2,4%) – муцинозная карцинома почки. Хирургический край был отрицательным у всех пациентов. Анализ со срочным гистологическим исследованием замороженных срезов проводили у 4 (9,75%) пациентов во время операции, чтобы подтвердить наличие отрицательного хирургического края. Осложнения наблюдались у 8 (19,5%) пациентов (3 Clavien I; 2 Clavien II; 3 Clavien IIIB). I степень включает осложнения минимального риска, не требующие лечения. К данной группе осложнений мы отнесли послеоперационное кровотечение, которое наблюдалось у 2 больных, а также у 1 пациента отмечалась гематома подкожно-жировой клетчатки с выраженной имбибицией, после проведения консервативной терапии данный процесс купирован. У 2 пациентов послеоперационное кровотечение потребовало гемотрансфузии (Clavien II), у 1 пациента развитие псевдоаневризмы среднесегментарной почечной артерии справа через 5 дней после операции потребовало проведения успешной селективной эмболизации ветвей среднесегментарной правой почечной артерии (Clavien IIIB). Еще в 1 случае через сутки диагностировано кровотечение пострезекционной зоны левой почки, дополнительный гемостаз и прошивание почки в условиях инфильтрированных тканей были нецелесообразны, выполнена нефрэктомия слева (Clavien IIIB). У 1 пациентки наблюдалась экстравазация контрастного вещества за пределы чашечно-лоханочной системы, ей выполнено дренирование верхних мочевых путей j-j-стентом (Clavien IIIB). Среднее время удаления страховочного дренажа и уретрального катетера составили 2,97±1,44 и 1,5±0,9 сут соответственно, средняя продолжительность пребывания в стационаре – 7,73± 2,33 сут. Средние предоперационные уровни креатинина и гемоглобна, а также средние значения СКФ – 0,93±0,3 мг/дл и 132,13±14,47 г/л, 75,67±21,5 мл/мин/1,73 м2 соответственно. Средний послеоперационный уровень креатинина и значение СКФ через 1 мес составляли 1,24±0,62 мг/дл и 64,67±22,39 мл/мин/1,73 м2 соответственно; средний послеоперационный уровень гемоглобина – 115,51±16,73 г/л. Пред- и послеоперационные различия были статистически значимы в пользу предоперационных значений с p=0,001 и 0,001, 0,004 для уровней креатинина и гемоглобина, а также СКФ соответственно (табл. 2).
Таблица 2. Сравнительная характеристика пред- и послеоперационных показателей почечной функции и уровня гемоглобина
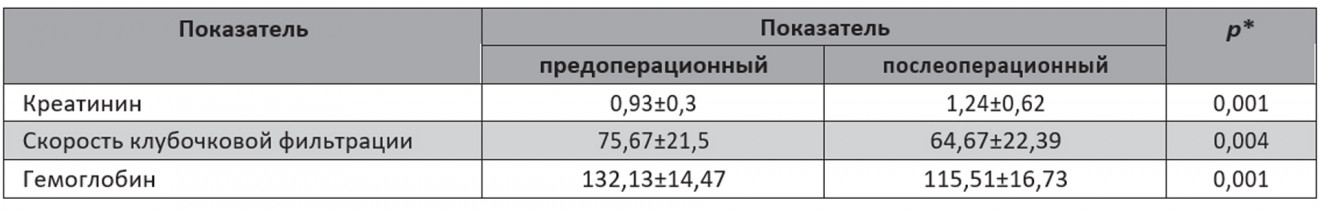
У 12 (29,3%) пациентов после операции наблюдалось снижение СКФ на 15%. Среднее время наблюдения составило 45,1±28,3 мес.
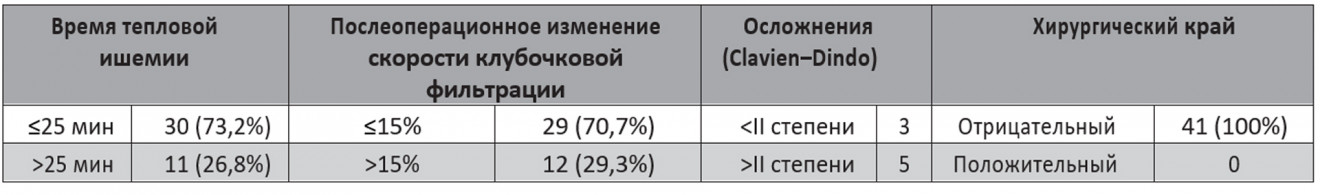
23 (60%) пациента подходят под строгие кри- терии трифекты. Поскольку во всех случаях хирургический край был отрицательным, в критерии трифекты включали ВТИ, послеоперационное изменение СКФ и отсутствие осложнений. 5 (12,2%) пациентов имели осложнения II степени и выше по Clavien–Dindo, у 11 (26,8%) пациентов ВТИ превысило 25 мин, послеоперационное уменьшение СКФ
>15% наблюдалось у 12 (29,3%) пациентов. 3 пациента с послеоперационным снижением СКФ >15% имели осложнения II степени и выше по Clavien–Dindo, а также у 1 пациента с послеоперационным снижением СКФ >15% ВТИ превысило 25 мин (табл. 3).
Таблица 3. Строгие критерии трифекты
Обсуждение
НСХ с использованием роботизированных платформ приобретают повсеместную популярность во многих центрах по всему миру, а показания к ней постоянно расширяются. Пациенты, имеющие опухоли почек большого диаметра, со сложным анатомическим расположением, считаются кандидатами на РАРП, проблемы безопасности и онкологических исходов становятся более очевидными. Использование термина «трифекта» для описания успехов и результатов РАРП относительно новое, возможно, оно поможет внести стандартизированную оценку результатов 6. Критерии трифекты в литературе различаются, но в основном в них включают отсутствие осложнений, отрицательный хирургический край и минимальное уменьшение почечной функции. Согласно литературным источникам, ВТИ=25 мин ассоциируется с предвестником IV стадии хронической болезни почек 6, поэтому в данной серии рубеж в 25 мин был установлен как отсечка для ВТИ. Кроме того, для оптимальной оценки сохранения функции почек послеоперационное изменение СКФ ≤15% тоже было включено как критерий трифекты, т.е. использовали 2 критерия оценки сохраннности функции почек. В нашем исследовании 41 пациент с отсутствием осложнений II степени и выше по модифицированной классификации Clavien–Dindo, ВТИ ≤25 мин, послеоперационным изменением СКФ ≤15% и отрицательным хирургическим краев попадали под строгие критерии трифекты.
M.N. Patel и соавт. 12 первыми продемонстрировали безопасность выполнения РАРП у 15 пациентов с опухолями ≤4 см, сравнивая пациентов, перенесших РАРП при опухолях T1a, с пациентами, перенесшими РАРП при опухолях T1b. Медиана времени работы консоли составила 275 мин. Несмотря на то что показатели ВТИ (25 мин) и серьезных осложнений (19,8%) были значительно бо'льшими для опухолей T1b, продемонстрирована осуществимость этой операции 12. Аналогично G.N. Gupta и соавт. 13 сообщили о среднем значении ВТИ в 36 мин, более продолжительном времени работы консоли (390 мин) и более низкой степени тяжелых осложнений (6%) для опухолей T1b. По мере увеличения опыта работы с роботизированной хирургией результаты РАРП улучшались. Совсем недавно были опубликованы данные исследований с участием более крупных когорт и многоцентрового опыта, свидетельствующие о весьма многообещающих результатах 5, 14–16. Тем не менее основной уровень осложнений составляет 4,7% 5. В нашей серии у 8 (19,5%) пациентов были осложнения (3 Clavien I; 2 Clavien II; 3 Clavien IIIB). Следовательно, уровень осложнений ≤2 Clavien–Dindo в нашей серии наблюдался в 12% случаев. Что касается строгих критериев трифекты и исключая осложнения Clavien–Dindo IV, частота осложнений составила 7,3% (3 пациента). Строгие критерии трифекты были достигнуты в 23/41 (60%) случаях. Сравнение нашего опыта в РАРП для опухолей T1a и T1b выходит за рамки этой статьи. Тем не менее было бы интересно отметить, что в нашей когорте пациентов с опухолями T1a, которым мы проводили РАРП, средний показатель ВТИ составлял 16,88 мин, средняя продолжительность операции – 118,4 мин, а кровопотеря – 247,7 мл, что демонстрирует тенденцию к достижению эквивалентных результатов между группами пациентов с опухолями T1a и T1b. Безусловно, более подробный статистический анализ и сопоставление результатов между двумя группами обязательны для принятия безопасных решений.
Потенциальное воздействие положительного хирургического края на частоту рецидивов и общую выживаемость при почечном раке остается спорным. Исследования большого объема не подтверждают четкую корреляцию 18, 19. Тем не менее некоторые исследования продемонстрировали, что положительный хирургический край влияет на рецидив опухоли 20, 21 но, по-видимому, не отражается на канцерспецифической выживаемости 22. Сообщалось о распространенности положительного хирургического края при НСХ в диапазоне 4,9–8,1% для открытого и лапароскопического доступа 22. Другие литературные данные свидетельствуют, что диапазон положительного хирургического края составляет 0–8,7% для робот-ассиcтированных резекций 5, 11–16, 23. В нашей серии в гистологическом заключении положительный хирургический край мы не встретили.
Очевидно, применение нескольких интраоперационных методов помогает достичь отрицательного хирургического края. На наш взгляд, интраоперационное УЗИ имеет решающее значение. Его роль для лучшей визуализации глубины и краев опухоли доказана 23, мы использовали его в каждом случае. Пережатие почечной ножки обеспечивает более качественную визуализацию границы опухоли в относительно бескровной зоне (за счет ишемии). Несмотря на то что в некоторых исследованиях не продемонстрирована разница в частоте положительного хирургического края между операциями в условиях кровотока и при его выключении 24, мы уверены, что превосходная визуализация значительно увеличивает прецизионную диссекцию и резекцию. Пережатия почечной ножки не было в 2 случаях в серии, оба имели отрицательный хирургический край. Как и при любой другой хирургической процедуре, опыт хирурга является ключевым критерием для оптимального оперативного и онкологического исхода 25. Хирург в данной серии обладал большим опытом открытых, лапароскопических и робот-ассистированных резекций почек. Таким образом, можно сказать, что частота положительного хирургического края, прогрессивно убывает с наработкой опыта. Наконец, некоторые новые методы, такие как флуоресценция ближнего инфракрасного излучения после внутривенной инъекции индоцианинового зеленого (ICG), могут быть полезны при получении интраоперационной информации о степени инвазии опухоли и ее сосудистой архитектонике, кроме того, они снижают частоту положительного хирургического края, но их эффективность пока не доказана 26. Ввиду отсутствия вышеуказанных технологий неразумно комментировать их применение.
Важным итогом для НСХ является степень сохранения почечной функции. Неудивительно, что в большинстве исследований было показано снижение СКФ и увеличение уровня креатинина в сыворотке крови. СКФ – один из наиболее распространенных используемых показателей функции почек, в литературных источниках сообщается об ухудшении показателей между 5,6 и 14,7% до и после РАРП 5, 12–16. В данном исследовании ВТИ ≤25 мин, послеоперационное изменение СКФ ≤15% включались как строгие критерии трифекты для обеспечения оптимальной сохранности функции почек. Хотя до- и послеоперационные различия уровня креатинина и СКФ были статистически значимы по сравнению с предоперационными значениями, снижения СКФ 6% невелики и соответствуют вышеприведенным результатам в литературе, подтверждающим хорошие функциональные результаты РАРП в опухолях T1b спустя 1 мес после операции.
У пациентов в этой серии были опухоли со средней оценкой по шкале ABC: 2 пациента – 1; 12 пациентов – 2; 3 пациента – 3h; 24 пациента – 3s, наиболее распространенные, более сложные анатомические особенности опухолей имеют эндофитное расположение и опасную близость к собирательной системе, а также к воротам почки.
Анатомические особенности опухоли оценивали до операции, и РАРП выполняли при полностью эндофитных опухолях, расположенных в проекции почечных сосудов или по задней поверхности почки, размеры которых превышали 7 см в диаметре. Таким образом, во время наблюдения рецидивов не выявлено.
Мы признаем, что у данного исследования есть определенные ограничения, в том числе небольшое количество пациентов. Несмотря на это его результаты можно использовать при оценке РАРП для опухолей T1b. Кроме того, оценка результатов РАРП по строгим критериям трифекты может содействовать стандартизированной отчетности. Сроки наблюдения ограничиваются 48 мес. Время оценки СКФ при наблюдении составило 1 мес, может быть, слишком рано анализировать окончательный результат функции почек в эти сроки. РАРП при опухолях T1b может быть безопасна при выполнении опытным хирургом. Оптимальные критерии трифекты и частота рецидивов достижимы. Строгие критерии трифекты могут способствовать стандартизированной оценке результатов.
Строгие критерии трифекты были достигнуты в 23/41 (60%) случаях. У 3 пациентов было послеоперационное изменение СКФ >15% и отсутствие осложнений II степени и выше по Clavien–Dindo, у 1 пациента было послеоперационное изменение СКФ >15% и ВТИ >25 мин.
Сканируя данный QR-код, вы имеете возможность посмотреть видеозапись операции.

Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Для цитирования: Погосян Р.Р., Малхасян В.А., Семенякин И.В., Прокопович М.А., Пушкарь Д.Ю. Робот-ассистированная резекция почки при опухолях T1b: результаты трифекты // Клин. и эксперимент. хир. Журн. им. акад. Б.В. Петровского. 2019. Т. 7, № 2. С. 15–23. doi: 10.24411/2308-1198-2019-12002.
Для корреспонденции: Прокопович Максим Александрович – аспирант кафедры урологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва, Россия)
E-mail: spasourology@mail.ru
https://orcid.org/0000-0002-8035- 3206








