Раннее восстановление функции удержания мочи после робот-ассистированной радикальной простатэктомии
Резюме
Актуальность. Недержание мочи после радикальной простатэктомии беспокоит пациентов и приводит к ухудшению качества их жизни. Восстановление функции удержания мочи является наиболее важным функциональным исходом лечения больных рака предстательной железы.
Цель. Оценить эффективность сохранения анатомических структур, окружающих предстательную железу, для раннего восстановления функции удержания мочи.
Материалы и методы. Исследовались 142 пациента, перенесших с 2011 по 2015 гг. робот-ассистированную радикальную простатэктомию (РАРП). Больные были разделены на 3 группы: РАРП с сохранением сосудисто-нервных пучков полового члена (Н-РАРП, n = 44), РАРП с сохранением сосудисто-нервных пучков полового члена, тазовой фасции, пубо-простатических связок и пубо-промежностной мышцы (РАРП-А, n = 64) и РАРП с сохранением анатомических структур малого таза без сохранения сосудисто-нервных пучков полового члена (РАРП-Б, n = 34).
Результаты. Группы не различались по длительности операции (р = 0,17), объему кровопотери (p = 0,77), частоте интраоперационных (p > 0,1) и послеоперационных осложнений (p = 0,64). Сразу после удаления катетера и через 1 месяц после операции в группах Н-РАРП, РАРП-А и РАРП-Б частота удержания мочи составила, соответственно, 53,9, 79,7 и 54,6% (р = 0,012) и 61,4%, 87,5 и 84,6% (р = 0,005). Была установлена взаимосвязь сохранения анатомических структур, окружающих предстательную железу, и восстановления континенции сразу после удаления уретрального катетера (p = 0,019) и через 1 месяц после операции (p = 0,001).
Заключение. Тщательное сохранение анатомии малого таза позволяет добиться ранней континенции у больных после радикальной простатэктомии.
Список сокращений
- Н-РАРП — нервосберегающая робот-ассисти- рованная радикальная простатэктомия;
- РАРП — робот-ассистированная радикальная простатэктомия;
- РАРП-А — робот-ассистированная радикальная простатэктомия с сохранением анатомических структур малого таза, участвующих в механизме удержания; мочи;
- РАРП-Б — робот-ассистированная радикальная простатэктомия с сохранением анатомических структур малого таза, без сохранения сосудисто-нервных пучков полового члена;
- РПЖ — рак предстательной железы.
Введение
Распространенность рака предстательной железы (РПЖ) в России за последние 10 лет увеличилась в 3 раза и в 2015 г. составила 128,4 на 100 000 населения. В 2015 г. было выявлено 35 540 новых случаев заболевания, из которых 55,2% — в локализованной форме. Летальность составила 5,4% [1]. Всего в мире в 2012 г. насчитывалось 1,1 млн новых случаев РПЖ [2], причем более 70% из них было выявлено в экономически развитых странах. Хирургическое вмешательство является рекомендованным методом лечения пациентов с локализованным РПЖ. Операция может быть выполнена открытым, лапароскопическим и робот-ассистированным способами. В 2015 г. в России из 12 960 случаев хирургического лечения РПЖ доля робот-ассистированной радикальной простатэктомии составила 8,4% (в Европе — 40%, в США — 86%) [1, 3]. Робот-ассистированная, лапароскопическая и открытая радикальная простатэктомия обеспечивают сопоставимые и высокие онкологические результаты лечения: 10-летняя опухоль-специфическая выживаемость больных после РАРП составляет 98,8% [4, 5, 6, 7]. Недержание мочи после радикальной простатэктомии является наиболее беспокоящей пациентов проблемой и приводит к ухудшению качества их жиз- ни [8, 9]. Восстановление функции удержания мочи после радикальной простатэктомии является наиболее важным функциональным исходом лечения больных РПЖ [10, 11]. Спустя 1 год после вмешательства 84% пациентов удерживают мочу. Робот-ассистированная радикальная простатэктомия обеспечивает лучшее восстановление функции удержания мочи по сравнению с открытой (92,5 и 88,7%, p = 0,03) и лапароскопической (95 и 90,4%, p = 0,006) радикальной простатэктомией [12, 13]. При этом показатели восстановления функции удержания мочи в раннем послеоперационном периоде, в т.ч. сразу после удаления уретрального катетера, остаются на низком уровне 30–35% [14, 15]. В связи с низкими показателями удержания мочи в раннем послеоперационном периоде, интерес представляет изучение факторов, способствующих улучшению этого результата лечения. В литературе встречаются данные о необходимости сохранения ряда анатомических структур малого таза, таких как сосудисто-нервный пучок предстательной железы и пубо-простатические связки, для раннего восстановления функции удержания мочи [16]. В таких исследованиях обращает на себя внимание совершенствование отдельных этапов операции, а не комплексная оптимизация техники радикальной простатэктомии. Также этот вопрос недостаточно полно освещен с позиции роботической хирургии, которая раскрывает возможности точной и тонкой работы с тканями в условиях ограниченного пространства малого таза. Возможный путь достижения более высоких показателей удержания мочи в раннем послеоперационном периоде заключается в более тщательном сохранении анатомических структур малого таза, участвующих в механизме удержания мочи [17].
Материалы и методы
С 2011 по 2015 гг. на базе отделения хирургических методов лечения онкологических больных ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России нами было выполнено 279 робот-ассистированных радикальных простатэктомий (РАРП) у пациентов с локализованным РПЖ (стадия T1-T2N0M0). Диагноз РПЖ у всех больных был установлен на основании гистологического исследования препаратов, полученных путем выполнения трансректальной мультифокальной биопсии предстательной железы. Основанием для выполнения биопсии служило повышение уровня простат-специфического антигена (ПСА) крови выше 4 нг/мл или подозрение на наличие рака предстательной железы при пальцевом ректальном исследовании предстательной железы. Перед выполнением мультифокальной биопсии предстательной железы всем больным выполнялось МРТ органов малого таза с контрастированием. Также в стандарт обследования до хирургического вмешательства входило выполнение рентгенографии грудной клетки и остеосцинтиграфия.
Критериями исключения из исследования были первые 50 случаев РАРП (этот объем вмешательств был отнесен к периоду обучения и освоения методики хирургического вмешательства), выраженная сердечно-сосудистая патология (инфаркт миокарда, аорто-коронарное шунтирование или стентирование коронарных артерий в анамнезе), сахарный диабет, операции на предстательной железе в анамнезе (трансуретральная резекция простаты, брахитерапия), большой объем предстательной железы (более 100 см3), наличие вдающейся в просвет мочевого пузыря средней доли предстательной железы, предшествующие значительные хирургические вмешательства на брюшной полости, неоадъювантная гормональная терапия, недержание мочи до операции.
После применения критериев исключения для дальнейшего исследования были отобраны 142 пациента. Больные были разделены на 3 группы в соответствии с применяемой техникой РАРП: группу РАРП с сохранением сосудисто-нервных пучков полового члена (Н-РАРП, n = 44), группу РАРП с сохранением анатомических структур малого таза, участвующих в механизме удержания мочи: сосудисто-нервных пучков полового члена, тазовой фасции, пубо-простатических связок и пубо-промежностной мышцы (РАРП-А, n = 64) и группу РАРП с сохранением анатомических структур малого таза без сохранения сосудисто-нервных пучков полового члена (РАРП-Б, n = 34). Все хирургические вмешательства выполнялись одной хирургической бригадой, состоящей из опытного роботического хирурга и опытного хирурга-ассистента. По возрасту, индексу массы тела, исходному уровню ПСА, сумме баллов по шкале Глисона, объему предстательной железы, сумме баллов по шкале IPSS (Международная шкала оценки симптомов при заболеваниях предстательной железы), показателю качества жизни группы значимо не различались (табл. 1). Частота удержания мочи оценивалась сразу после удаления уретрального катетера, через 1, 3 и 12 месяцев после операции. Удержанием мочи мы считали отсутствие необходимости у пациента в использовании страховочной прокладки на протяжении всего дня. Оценка этого параметра в условиях стационара осуществлялась на основании устного опроса больных и визуального осмотра, а после выписки больных — на основании телефонного опроса.
Таблица 1. Предоперационные показатели
| Н-РАРП (n = 44) | РАРП-А (n = 64) |
РАРП-Б (n = 34) |
р | |
| Возраст, лет | 63,60 ± 1,23 | 62,00 ± 0,79 | 62,08 ± 2,10 | 0,59 |
| ИМТ, кг/м2 | 27,19 ± 0,62 | 28,11 ± 0,51 | 27,54 ± 1,17 | 0,32 |
| ПСА, нг/мл | 14,18 ± 2,31 | 12,14 ± 1,34 | 14,53 ± 1,52 | 0,08 |
| Глисон, сумма баллов | 6,15 ± 0,13 | 6,07 ± 0,14 | 6,58 ± 0,29 | 0,21 |
| Объем простаты, см3 | 54,33 ± 5,54 | 53,48 ± 2,69 | 47,00 ± 5,62 | 0,46 |
| IPSS | 16,77 ± 1,10 | 15,13 ± 0,96 | 14,38 ± 2,67 | 0,33 |
| Качество жизни | 3,25 ± 0,21 | 3,25 ± 0,18 | 3,08 ± 0,47 | 0,83 |
Н-РАРП выполнялась под эндотрахеальным наркозом трансперитонеальным доступом в крутом положении Тренделенбурга (35–40є). Для доступа использовались 3 рабочих 8-мм роботических троакаров, один оптический 12-мм роботический троакар и один ассистентский 12-мм троакар. Троакары устанавливались в брюшную полость по полуокружности, обращенной центром к малому тазу. Оптический троакар устанавливался над или под пупком, что определялось конституцией больного, по одному рабочему 8-мм роботическому троакару устанавливалось на 2-3 см краниально и медиально относительно передней верхней оси подвздошных костей, один 8-мм троакар располагался по полуокружности на середине расстояния между оптическим и левым рабочим роботическими троакарами, а ассистентский 12-мм троакар располагался симметрично ему на правом фланге живота. Из роботических инструментов применялись бинокулярный лапароскоп Intuitive Surgical, монополярные ножницы, биполярный диссектор и граспер EndoWrist, из ассистентских лапароскопических инструментов — клипаторы Hem-O-Lok, ножницы, иглодержатель. В ходе оперативного приема производилось высокое и широкое рассечение париетальной брюшины на передней брюшной стенке. Разрез продолжался до проекции наружных отверстий паховых каналов с справа и слева; острым и тупым путем выполнялась диссекция предпузырной жировой клетчатки, выделялась передняя поверхность мочевого пузыря и предстательной железы, тазовая фасция и пубо-простатические связки. Тазовая фасция надсекалась справа и слева от предстательной железы, разрез продлевался до пубо-простатических связок слева и справа. Пубо-простатические связки частично пересекались, после чего дорсальный сосудистый комплекс прошивался и перевязывался с использованием самозатягивающихся нитей V-Loc. Предстательная железа отсекалась от мочевого пузыря, после чего производилась тщательная диссекция задней поверхности предстательной железы, выделялись семенные пузырьки, клипировались и пересекались ножки предстательной железы. Тупым и острым путем выполнялось вы- деление сосудисто-нервных пучков полового члена, так называемой «вуали Венеры». Следующим этапом предстательная железа отсекалась от дор- сального сосудистого комплекса спереди. После этого выполнялась диссекция в области верхушки предстательной железы, предстательная железа отсекалась от мембранозной уретры и помещалась в эвакуатор. Пузырно-уретральный анастомоз накладывался непрерывно с использованием нитей V-Loc. Следующим этапом у пациентов высокого риска выполнялась расширенная тазовая лимфаденэктомия. Операция завершалась установкой в зону пузырно-уретрального анастомоза дренажей. Препараты извлекались из брюшной полости через разрез по средней линии живота (как продолжение разреза для оптического троакара), а при больших объемах предстательной железы — через разрез по Пфанненштилю. Выполнялась обработка и послойный шов раны и наложение асептических повязок, после чего пациент переводился в отделение реанимации.
РАРП-А включала в себя ряд существенных изменений, которые позволили описать этот способ выполнения радикальной простатэктомии как новое хирургическое вмешательство. Этапы доступа к предпузырному пространству повторяли ход Н-РАРП, но после выделения передней поверхности мочевого пузыря и предстательной железы, тазовой фасции и пубо-простатических связок выполнялось отделение выделение боковых поверхностей предстательной железы от тазовой фасции тупым способом, без рассечения последней.
Этапы отсечения простаты от мочевого пузыря, выделения ее задней поверхности, мобилизации семенных пузырьков и ножек предстательной железы повторяли таковые при Н-РАРП. На этапе, когда задняя и боковые поверхности предстательной железы были полностью мобилизованы до уровня верхушки, производилось выделение передней поверхности предстательной железы путем поступательного отсечения от нее дорсального сосудистого комплекса. Благодаря такому приему не требовалось выполнять пересечение пубо-простатических связок и тем самым выполнялось сохранение связочно-фасциального аппарата малого таза. После отсечения дорсального сосудистого комплекса от предстательной железы на него в поперечном на- правлении накладывался непрерывный шов, что обеспечивало надежный гемостаз. Следующим важным этапом являлась тщательная диссекция тканей в области верхушки предстательной железы. Использование монополярной и биполярной энергии на всех этапах выделения предстательной железы было сведено к минимуму, а при выделении верхушки простаты коагуляция не использовалась вовсе. Это позволяло точно контролировать границы предстательной железы, обеспечить сохранение максимально возможной длины мочеиспускательного канала, сохранение пубо-промежностной мышцы, и минимизировать вероятность возникновения положительного хирургического края в этой зоне (рис. 1). После того как препарат помещался в мешок-эвакуатор, выполнялось наложение пузырно-уретрального анастомоза, а сам оперативный прием в малом тазу завершался реконструкцией тазовой фасции и фиксацией ее к стенке мочевого пузыря.
РАРП-Б повторяла описанную выше методику РАРП-А за тем исключением, что сосудисто-нервные пучки, идущие по заднелатеральным поверхностям предстательной железы, не сохранялись, а удалялись единым блоком с предстательной железой. Результаты исследования. Среднее время операции в группах Н-РАРП, РАРП-А и РАРП- Б не различалось и составило, соответственно, 157,4 ± 8,4 мин, 145,6 ± 5,2 мин и 123,5 ± 6 мин (р = 0,17). Также в группах не было получено различий в среднем объеме кровопотери (p = 0,77), койко-дне в отделении реанимации (р = 0,41), частоте интраоперационных (p>0,1) и послеоперационных осложнений (p = 0,64), длительности госпитализации (p = 0,41) (табл. 2). Конверсий не было. Задержка мочи наблюдалась у 2 больных из группы РАРП-А и одного больного из группы РАРП-Б. Послеоперационных стриктур уретры за весь период наблюдения пациентов выявлено не было. Частота ПХК в группах не различалась значимо и составила 14,29, 17,19 и 14,71%, соответственно, для Н-РАРП, РАРП-А и РАРП-Б (p = 0,82). За весь период наблюдения биохимический рецидив был отмечен у 6% пациентов, от прогрессии опухоли не умер ни один больной.
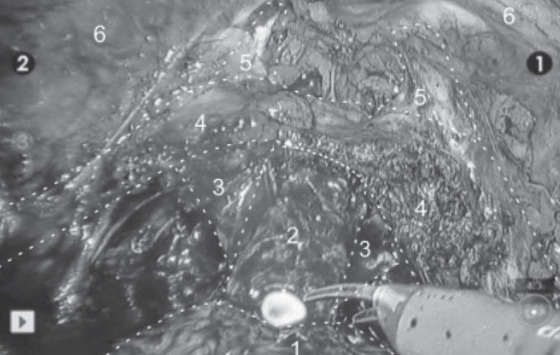 Рисунок 1. Диссекция верхушки предстательной железы при РАРП-А. Обозначения: 1 — предстательная железа, 2 — уретра, 3 — пубо-промежностная мышца, 4 — тазовая фасция, 5 — пубо-простатические связки, 6 — лонные кости.
Рисунок 1. Диссекция верхушки предстательной железы при РАРП-А. Обозначения: 1 — предстательная железа, 2 — уретра, 3 — пубо-промежностная мышца, 4 — тазовая фасция, 5 — пубо-простатические связки, 6 — лонные кости.
Таблица 2. Интраоперационные и послеоперационные показатели
| Н-РАРП (n = 44) | РАРП-А (n = 64) | РАРП-Б (n = 34) | р | |
| Время операции, мин | 157,44 ± 8,43 | 145,58 ± 5,21 | 123,46 ± 6,05 | 0,17 |
| Кровопотеря, мл | 124,09 ± 8,49 | 120,94 ± 5,05 | 119,62 ± 9,14 | 0,77 |
| Койко-день в реанимации | 1,00 | 1,06 ± 0,04 | 1,00 | 0,41 |
| Общий койко-день | 10,20 ± 0,37 | 10,83 ± 0,61 | 10,23 ± 0,51 | 0,41 |
| Интраоперационные осложнения, % | 2,27 | 1,56 | 0 | >0,1 |
| Послеоперационные осложнения, % | 20,45 | 26,57 | 23,07 | 0,64 |
Таблица 3. Частота восстановления функции удержания мочи в группах в послеоперационном периоде
| Н-РАРП (N = 34) |
РАРП-А (N = 64) | РАРП-Б (N = 34) | р | |
| После удаления уретрального катетера, % | 53,9 | 79,7 | 54,6 | 0,012 |
| Через 1 мес, % | 61,4 | 87,5 | 84,6 | 0,005 |
| Через 3 мес, % | 63,6 | 91,1 | 90,0 | <0,001 |
| Через 12 мес, % | 98,4 | 100 | 100 |
>0,1 |
Общая тенденция восстановления удержания мочи после хирургического вмешательства по всей выборке больных представлена на рис. 2. Результаты восстановления функции удержания мочи в послеоперационном периоде в группах Н-РАРП, РАРП-А, РАРП-Б представлены в табл. 3. На рис. 3 показана динамика восстановления функции удержания мочи в исследованных группах. В группе РАРП-А сразу после удаления уретрального катетера удержание мочи отмечало 79,7% пациентов, что было значимо большим, чем в группах Н-РАРП и РАРП-Б (р = 0,012). Уже спустя 1 месяц после вмешательства в группах РАРП-А и РАРП-Б этот показатель равнялся соответственно 87,5 и 84,6%, что было значимо большим, чем в группе Н-РАРП (р = 0,005). Спустя 3 месяца после операции в группах РАРП-А и РАРП-Б удерживало мочу, соответственно, 91,1 и 90,0% пациентов. Показатель удержания мочи спустя 12 месяцев после РАРП по всей выборке не различался и составил 98,4, 100 и 100% для групп Н-РАРП, РАРП-А и РАРП-Б (p > 0,1). Среднее время до полного восстановления функции удержания мочи в группах Н-РАРП, РАРП-А и РАРП-Б составило 3,30 ± 0,66 месяца, 0,77 ± 0,30 месяца и 0,83 ± 0,28 месяца (р = 0,0018).
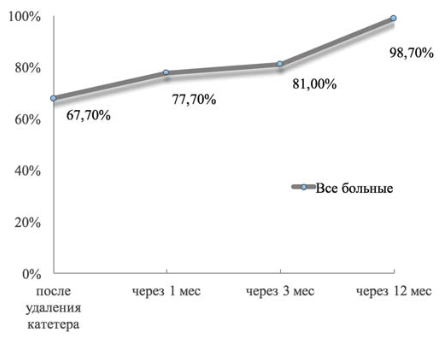 Рисунок 2. Частота восстановления удержания мочи в послеоперационном периоде по всей выборке больныхi.ru/doktoram/edit/309
Рисунок 2. Частота восстановления удержания мочи в послеоперационном периоде по всей выборке больныхi.ru/doktoram/edit/309
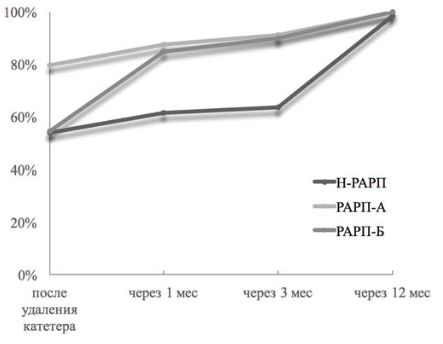 Рисунок 3. Динамика восстановления удержания мочи в послеоперационном периоде в группах
Рисунок 3. Динамика восстановления удержания мочи в послеоперационном периоде в группах
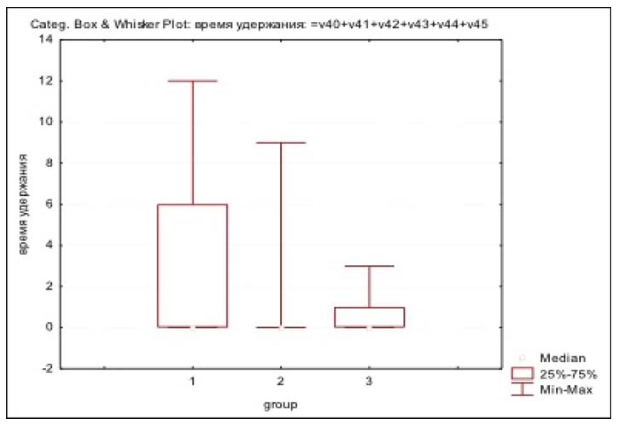 Рисунок 4. Среднее время до восстановления функции удержания мочи в группах. Обозначения: 1 — Н-РАРП, 2 — РАРП-А, 3 — РАРП-Б. Примечания: различия между группами статистически значимы, p = 0,0018.
Рисунок 4. Среднее время до восстановления функции удержания мочи в группах. Обозначения: 1 — Н-РАРП, 2 — РАРП-А, 3 — РАРП-Б. Примечания: различия между группами статистически значимы, p = 0,0018.
Была установлена взаимосвязь сохранения тазовой фасции, пубо-простатических связок, пубо-промежностной мышцы и удержания мочи сразу после удаления уретрального катетера (х2 = 5,534888, df = 1, p = 0,01864, рис. 4а) и через 1 месяц после операции (х2 = 10,62649, df = 1, p = 0,00112, рис. 4). Сохранение только сосудисто-нервных пучков полового члена не влияло на восстановление функции удержания мочи сразу после удаления катетера (р = 0,35, рис. 5а) и спустя 1 месяц после операции (р = 0,73, рис. 5б). Обсуждение. Через 12 месяцев после вмешательства удержание мочи в группах составляло от 98% до 100%. Это соотносится с данными других исследователей [18]. В нашем исследовании критерием удержания мочи служило отсутствие потребности пациента в использовании страховочных прокладок. Такого определения придерживаются многие специалисты, занимающиеся хирургическим лечением РПЖ [19, 20]. Иными словами, использование хотя бы 1 страховочной прокладки приравнивалось к недержанию мочи. В задачи исследования не входило изучение особенностей и характера недержания мочи после операции, поэтому дополнительных обследований в послеоперационном периоде не проводилось.
В нашем исследовании среднее время до восстановления нормальной континенции было наибольшим в группе, где была выполнена стандартная не- рвосберегающая РАРП, и наименьшим — в группе, где было выполнено максимальное сохранение перипростатической анатомии. В работе Berg K.D. et al. [19] у пациентов, перенесших стандартную нервосберегающую РАРП, среднее время до восстановления функции составило 6,2 мес. В исследовании Kumar A. et al. [21] среднее время до полного восстановления удержания мочи составляло от 2,4 до 3,4 месяца, в зависимости от сложности хирургического вмешательства. Можно сделать вывод, что сохранение анатомических структур, участвующих в удержании мочи, обеспечивает значительно более раннее восстановление нормальной функции мочеиспускания. На завершающем этапе операции мы выполняли внутреннюю фиксацию стенки мочевого пузыря к тазовой фасции, что являлось надежной хирургической профилактикой пролапса мочевого пузыря, а значит и стрессового недержания мочи.
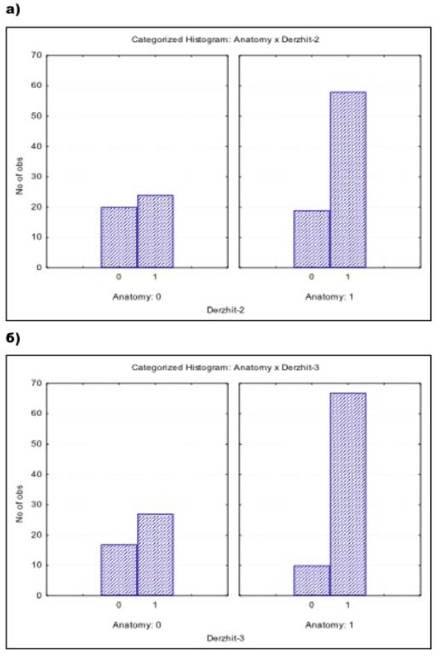 Рисунок 5. Взаимосвязь сохранения тазовой фасции, пубо-простатических связок, пубо-промежностной мышцы и удержания мочи. а) сразу после удаления уретрального катетера, б) через 1 месяц после удаления уретрального катетера. Обозначения: Anatomy 0 — без сохранения вышеуказанных структур; Anatomy 1 — с сохранением вышеуказанных структур.
Рисунок 5. Взаимосвязь сохранения тазовой фасции, пубо-простатических связок, пубо-промежностной мышцы и удержания мочи. а) сразу после удаления уретрального катетера, б) через 1 месяц после удаления уретрального катетера. Обозначения: Anatomy 0 — без сохранения вышеуказанных структур; Anatomy 1 — с сохранением вышеуказанных структур.
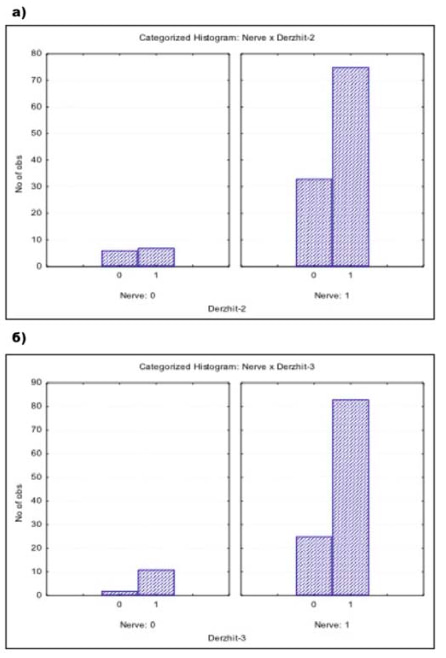
Рисунок 6. Взаимосвязь сохранения сосудисто-нервных пучков полового члена и удержания мочи. а) сразу после удаления уретрального катетера, б) через 1 месяц после удаления уретрального катетера.
Выводы
В механизме удержании мочи значительная роль отводится не только сосудисто-нервным пучкам полового члена, но также функционированию тазовой фасции, пубо-простатических связок и пубо-промежностной мышцы. Их сохранение в ходе РАРП ассоциировано с восстановлением функции удержания мочи сразу после удаления уретрального катетера и в течение 1 месяца после вмешательства. Сохранение только сосудисто-нервных пучков полового члена не влияло на восстановление функции удержания мочи в течение первого месяца после РАРП.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Информация об авторах
- Мосоян Мкртич Семенович, д.м.н., заведующий кафедрой урологии с курсом роботической хирургии, руководитель центра роботической хирургии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, профессор кафедры урологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России;
- Ильин Дмитрий Михайлович, ассистент кафедры урологии с курсом роботической хирургии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России;








