Предикторы недержания мочи у пациентов после радикальной робот-ассистированной простатэктомии: результаты одноцентрового исследования
Аннотация
Введение. Рак предстательной железы занимает ведущие позиции в структуре онкологической заболеваемости среди мужчин во всем мире. “Золотым стандартом” лечения локализованных форм рака простаты является радикальная простатэктомия, при этом в последние годы всё чаще оперативное пособие выполняется робот-ассистированно. Одним из негативных последствий операции для пациента является возникновение недержания мочи, что встречается достаточно часто и существенно снижает качество жизни. По этой причине крайне важно выделить факторы, которые влияют на возникновение недержания мочи.
Цель исследования. Выявить факторы риска возникновения недержания мочи у больных, перенёсших робот-ассистированную простатэктомию.
Материалы и методы. В клинике урологии Российского Университета Медицины проведено проспективное когортное исследование по изучению факторов риска недержания мочи у пациентов, перенёсших роботассистированную радикальную простатэктомию. Контрольными точками наблюдения были установлены 1-е, 3-и, 7-е сутки после удаления уретрального катетера и на 1-й, 3-й, 6-й, 12-й месяцы после операции. Проанализированы анамнестические данные и результаты инструментальных методов исследования и проведён статистический анализ, включающий логистический регрессионный анализ с построением уравнения регрессии.
Результаты. В раннем послеоперационном периоде недержание мочи возникло у 87 (70,3%) пациентов, но к 12-му месяцу наблюдения его частота снизилась до 15 (11%) случаев. Возраст, индекс массы тела, длина мембранозной уретры, размер m. levator ani, перенесённые операции на предстательной железе в анамнезе и симптомы гиперактивного мочевого пузыря являлись предикторами недержания мочи. На основе результатов созданы номограммы для расчёта вероятности недержания мочи на 7-е сутки и через 1, 3, 6, 12 месяцев после удаления уретрального катетера.
Заключение. Отрицательное влияние инконтиненции на качество жизни пациентов перенёсших РПЭ очевидно. Среди выявленных нами предикторов выделена модифицируемая группа факторов риска недержания мочи. Это позволяет снизить риск и степень тяжести недержания мочи после операции, что благотворно скажется на качестве жизни после операции.
Введение
Рак предстательной железы (РПЖ) занимает ведущие позиции в структуре онкологической заболеваемости среди мужчин во всем мире [1]. «Золотым стандартом» лечения локализованных форм рака простаты является радикальная простатэктомия (РПЭ) [2]. В последние годы всё чаще оперативное пособие выполняется роботически по причине ряда преимуществ перед позадилонной и лапароскопической РПЭ. Стоит упомянуть меньший объём кровопотери, как правило, менее продолжительный период дренирования уретральным катетером, уменьшение потребности в обезболивающих препаратах и, как следствие, более быструю реабилитацию пациентов [3, 4].
Одним из негативных последствий операции для пациента является возникновение недержания мочи. Недержанием мочи определяют как патологическое состояние, характеризующееся любым непроизвольным выделением мочи из уретры [5]. Подавляющее большинство пациентов, столкнувшихся с данных осложнением, отмечают существенное ухудшение качества жизни [6]. По данным литературы, до 65% оперированных больных отмечают инконтиненцию [7]. По этой причине крайне важно понимать, какие факторы негативно сказываются на возникновении недержания мочи и возможно ли их избежать.
Цель исследования. Выявить факторы риска возникновения недержания мочи у больных, перенёсших роботассистированную радикальную простатэктомию.
Материалы и методы
Проспективное когортное исследование проведено на кафедре урологии ФГБОУ ВО «Российский университет медицины» Минздрава России (ранее — «МГМСУ им. А. И. Евдокимова»). Осуществлена оценка результатов лечения 126 пациентов с РПЖ с целью изучения факторов риска (предикторов) и разработки прогностических номограмм недержания мочи при выполнении робот-ассистированной РПЭ.
Исследование проводили в период с 2021 года по 2022 год. Робот-ассистированную РПЭ выполняли на роботизированных хирургических эндоскопических комплексах Da Vinci SI и XI с сохранением или без сохранения сосудисто-нервных пучков (с одной или обеих сторон) два хирурга клиники с опытом работы более 30 лет. Изучали наиболее распространённые, по данным литературы, предикторы недержания мочи: возраст пациента, индекс массы тела (ИМТ), ряд МРТ-критериев (для оценки использовалась программа RadiAnt DICOM Viewer v.2023.1): длина мембранозного отдела уретры, объём и конфигурация предстательной железы, толщина шейки мочевого пузыря, толщина m. levator ani и m. obturtatorius int.; операции на предстательной железе в анамнезе, наличие гиперактивного мочевого пузыря (анамнестически, валидизированный опросник International Prostate Symptom Score – IPSS).
Предоперационное обследование пациентов. Всем пациентам выполняли мультидисциплинарное исследование, включающее подробный сбор анамнеза болезни и жизни, определение ИМТ, измерение под руководством врача лучевой диагностики различных параметров структур и органов малого таза (объём простаты (см3) и её конфигурации, толщина шейки мочевого пузыря (мм), длина мембранозного отдела уретры (мм), толщина m. obturtatorius int. (мм) и толщина m. levator ani (мм)).
Наблюдение в постоперационном периоде. Всем пациентам в постоперационном периоде проводили комплексную этиопатогенетическую терапию (цефалоспорины, нестероидные противовоспалительные средства, инфузионная терапия). На 5-е сутки после операции для определения герметичности уретро-шеечного анастомоза выполняли цистографию. В подавляющем большинстве случаев (91,0%) отмечали отсутствие затёка контрастного вещества. В случае несостоятельности анастомоза в индивидуальном порядке определяли повторный срок выполнения исследования и при положительном исходе уретральный катетер удаляли. Ни в одном случае срок дренирования мочевого пузыря не превышал 14 суток.
После удаления уретрального катетера для оценки степени недержания мочи пациенты использовали урологические прокладки, совместно с больным подсчитывали необходимое количество прокладок за одни сутки. Наиболее распространёнными ситуациями возникновения недержания мочи являлись кашель, физическая нагрузка, изменение положения тела. В дальнейшем посредством контрольных визитов и телефонного опроса оценивали количество используемых прокладок за 24 часа на 7-е сутки, 1-й, 3-й, 6-й и 12-й месяцы после удаления уретрального катетера. Пациенты заполняли валидизированный опросник Международная консультация по вопросам недержания мочи — Краткая комплексная форма по недержанию мочи / International Consultation on Incontinence Questionnare – Urinary Incontinence Composite Short Form (ICIQ-UI SF). Удержание мочи, согласно рекомендациям Международного общества по континенции / International Continence Society (ICS), определяли как отсутствие выделения мочи в покое или при физической активности с возможным использованием одной прокладки в сутки в качестве «страховочной».
Статистический анализ. Статистический анализ проводили при помощи программного обеспечения Statistica v10.0 (“StatSoft Inc.”, Tulsa, OK, USA) и Medcalc v20.104 (“MedCalc Software Ltd.”, Ostend, Belgium). Для верификации нормальности распределения применяли критерий Shapiro-Wilk. Все описанные клинические и демографические качественные параметры представлены в виде распределений (n) и простых процентных соотношений (%), в то время как количественные признаки описывались в виде среднего (М) ± стандартного отклонения (SD). При сравнении двух независимых групп с ненормальным распределением использовали Mann-Whitney U test для количественных признаков, Pearson’s chi-square — для качественных признаков. Для параметров, имеющих ненормальное распределение, использовали непараметрический коэффициент корреляции Spearman. Проведён анализ зависимости между сохранением сосудисто-нервных пучков во время радикальной робот-ассистированной РПЭ и развитием недержания мочи. Выполнено сравнение двух групп пациентов (в первую группу отобраны пациенты, у которым операцию выполняли без сохранения сосудисто-нервных пучков, во вторую — с сохранением). Для выявления критериев, связанных с развитием недержания мочи в послеоперационном периоде проведён логистический регрессионный анализ с построением уравнения регрессии. Для определения соотношения значений чувствительности и специфичности полученных прогностических моделей использовали ROC анализ. Статистически достоверными считали различия при уровне p < 0,05. Каждую контрольную точку наблюдения за пациентом в постоперационном периоде оценивали отдельно, выявляли связь между конкретным фактором и недержанием мочи, после чего получены коэффициенты для дальнейшего построения уравнения логистической регрессии. На основании данных вновь для каждой контрольной точки строили уравнение логистической регрессии. Затем для удобного визуального восприятия полученных данных в программной среде R были построены прогностические номограммы.
Результаты
Средний возраст пациентов, участвующих в исследовании, составил 64,77 ± 6,06 лет. Средний показатель ИМТ — 28,1 ± 4,19 кг/м2. Средний объём предстательной железы был равен 52,17 ±25,17 см3. Толщина шейки мочевого пузыря в общей группе рассчитана в 3,8 ± 0,63 мм. Средняя длина мембранозного отдела уретры составила 12,8 ± 9,07 мм. Средняя толщина m. obturtatorius int. — 20,8 ± 3,1 мм; толщина m. levator ani — 4,7 ± 1,57 мм (табл. 1).
В раннем послеоперационном периоде недержание мочи возникло у 87 (70,3%) пациентов, но к 12-му месяцу наблюдения его частота существенно снизилась (до 15 (11,9%) случаев). Также с течением времени снизилось количество используемых абсорбирующих средств с 2,59 ± 1,56 штук на 1-е сутки после удаления уретрального катетера до 0,54 ± 0,96 на 12-й месяц после операции соответственно. Нас интересовало, с какими показателями пациенты продолжали страдать недержанием мочи на 12-й месяц после операции, включая возраст, индекс массы тела, объем простаты и другие (табл. 2). Следует отметить, что с течением времени отмечалось снижение степени тяжести недержания мочи, о чём свидетельствует прогрессивное снижение суммы баллов по результатам валидизированного опросника ICIQ-SF с 11,36 ± 1,41 до 1,95 ± 0,73 (табл. 3).
Нами было проведено сравнение возникновение недержания мочи у двух групп пациентов (с сохранением сосудистонервных пучков и без такового). Установлено, что в случае сохранения сосудистонервных пучков пациентам требовалось меньшее количество абсорбирующих средств, однако статистически значимых подтверждений получено не было (табл. 4).
В качестве метода для предварительного анализа математических зависимостей между признаками была выбрана корреляция Спирмена (r), которая является непараметрической статистической мерой. Была выявлена положительная корреляция между возрастом больного с такими показателями, как наличие гиперактивного мочевого пузыря (r = 0.5) и объёмом предстательной железы (r = 0.51). Коэффициент корреляции позволил выявить, что более возрастным пациентам требовалось использовать большее количество прокладок а сутки в течение послеоперационного периода наблюдения (7-е сутки (r = 0,64); 1-й месяц (r = 0,61); 12-й месяц (r = 0,54)). Также с увеличением ИМТ росло количество используемых прокладок за сутки (7-е сутки (r = 0,45); 1-й месяц (r = 0,36); 12-й месяц (r = 0,37)). В том числе при повышении объёма предстательной железы увеличивалось количество используемых прокладок за сутки (7-е сутки (r = 0,48); 1-й месяц (r = 0,44); 12-й месяц (r = 0,45)).
Таблица 1. Клиническая характеристика пациентов
| Характеристики |
Значения (M ± SD) |
| Возраст, лет | 64,76 ± 6,06 |
| Индекс массы тела, кг/м2 | 28,11 ± 4,19 |
| Объём простаты, см3 | 52,17 ± 25,17 |
| Толщина шейки мочевого пузыря, мм | 3,82 ± 0,63 |
| Длина мембранозного отдела уретры, мм | 12,86 ± 9,07 |
| Толщина внутренний запирательной мышцы, мм | 20,85 ± 3,10 |
| Толщина мышцы, поднимающей задний проход, мм | 4,76 ± 1,57 |
| n (%) | |
| Гиперактивный мочевой пузырь | 48 (38,1) |
| Операции на предстательной железе в анамнезе | 33 (26,2) |
| Сохранение сосудисто-нервных пучков Без сохранения С одной стороны С обеих сторон |
57 (45,2) 15 (11,9) 54 (42,9) |
| Типы верхушки простаты по Lee A B C D |
33 (26,2) 33 (26,2) 27 (21,4) 33 (26,2) |
| Всего, n (%) | 126 (100) |
Таблица 2. Характеристика пациентов с недержанием мочи на 1-е сутки после удаления уретрального катетера и на 12-й месяц после операции
| Характеристики | 1-ые сутки | 12-й месяц |
| n (%) | ||
| Всего пациентов | 87 (69,1) | 15 (11,9) |
| M ± SD | ||
| Возраст, лет | 66,74 ± 5,71 | 71,66 ± 2,46 |
| Индекс массы тела, кг/м2 | 29,43 ± 4,06 | 30,15 ± 2,54 |
| Объем простаты, см3 | 58,63 ± 27,10 | 68,73 ± 27,10 |
| Толщина шейки мочевого пузыря, мм | 3,77 ± 0,60 | 3,53 ± 0,42 |
| Длина мембранозного отдела уретры, мм | 12,72 ± 10,90 | 11,34 ± 2,41 |
| Толщина внутренний запирательной мышцы, мм | 20,71 ± 2,82 | 22,21 ± 2,05 |
| Толщина мышцы, поднимающей задний проход, мм | 4,71 ± 1,78 | 4,22 ± 1,49 |
| Прокладок / сутки | 2,59 ± 1,56 | 0,54 ± 0,96 |
Таблица 3. Динамика степени тяжести недержания мочи по опроснику ICIQ-UI SF
| Сроки наблюдения | Баллы (M ± SD) |
| 7 суток | 11,36 ± 1,41 |
| 1 месяц | 7,05 ± 1,29 |
| 3 месяца | 5,24 ± 1,52 |
| 12 месяцев | 1,95 ± 0,73 |
Таблица 4. Сравнение характеристик пациентов с и без сохранения сосудисто-нервных пучков
| Характеристики |
Без сохранения сосудисто-нервных пучков |
С сохранением сосудисто-нервных пучков |
p |
| M ± SD | |||
| Возраст, лет | 65,58 ± 6,49 | 63,79 ± 5,39 | 0,09* |
| Индекс массы тела, кг/м2 | 28,32 ± 3,8 | 27,86 ± 4,65 | 0,45 |
| Объём простаты, см3 | 55,30 ± 26,68 | 48,39 ± 22,89 | 0,12 |
| Толщина шейки мочевого пузыря, мм | 3,79 ± 0,61 | 3,86 ± 0,66 | 0,58 |
| Длина мембранозного отдела уретры, мм | 12,12 ± 1,88 | 12,00 ± 1,58 | 0,66 |
| Толщина внутренний запирательной мышцы, мм | 20,98 ± 3,43 | 20,71 ± 2,69 | 0,89 |
| Толщина мышцы, поднимающей задний проход, мм | 4,56 ± 1,27 | 5,02 ± 1,87 | 0,27 |
| Операции на простате, n (%) | 21 (30,4) | 12 (21,1) | 0,23** |
| Гиперактивный мочевой пузырь, n (%) | 29 (43,4) | 18 (31,5) | 0,22 |
| 1 сутки, прокладок / сутки | 2,70 ± 1,69 | 2,47 ± 1,40 | 0,76* |
| 3 сутки, прокладок / сутки | 2,57 ± 1,65 | 2,32 ± 1,23 | 0,61 |
| 7 сутки, прокладок / сутки | 2,35 ± 1,70 | 1,95 ± 0,95 | 0,34 |
| 1 месяц, прокладок / сутки | 1,74 ± 1,37 | 1,26 ± 0,97 | 0,08 |
| 3 месяц, прокладок / сутки | 1,26 ± 1,43 | 1,00 ± 1,04 | 0,58 |
| 6 месяц, прокладок / сутки | 0,87 ± 1,16 | 0,47 ± 0,68 | 0,14 |
| 12 месяц, прокладок / сутки | 0,70 ± 1,17 | 0,37 ± 0,59 | 0,47 |
Примечания: * — критерий Манна-Уитни, ** — Хи-квадрат
Каждую контрольную точку наблюдения за пациентом в постоперационном периоде оценивали отдельно, выявляли связь между конкретным фактором и недержанием мочи, после чего получены коэффициенты для дальнейшего построения уравнения логистической регрессии. На основании полученных результатов вновь для каждой контрольной точки строили уравнение логистической регрессии. Далее для удобного визуального восприятия полученных данных в программной среде R составлены прогностические номограммы. В качестве предикторов по результатам проведённого мультивариантного анализа были включены: наличие операций на предстательной железе в анамнезе (да / нет), наличие симптомов гиперактивного мочевого пузыря (да / нет), возраст пациента (лет), ИМТ (кг/м2), толщина шейки мочевого пузыря (мм), объём предстательной железы (см3), длина мембранозного отдела уретры (мм), толщина внутренней запирательной мышцы (мм) и толщина мышцы, поднимающая задний проход (мм).
Следует отметить, что крайне важным для пациента является раннее формирование удержания мочи, поэтому ниже в качестве примера приводится построение номограммы на 7-е сутки после удаления уретрального катетера (рис. 1).
Ниже приводим пример расчёта вероятности возникновения недержания мочи на 7-е сутки после удаления уретрального катетера с помощью данной номограммы (рис. 2).
Пример расчёта. Пациент, 54 года (17 баллов), с ИМТ 24,5 кг/м2 (10 баллов) и толщиной m. levator ani 4,0 мм (58 баллов). В полученном ранее уравнении логистической регрессии коэффициент возраста и ИМТ имел положительное значение, а коэффициент размера m. levator ani получил отрицательное значение, по этой причине схематичное изображение расчёта первичной суммы баллов выглядит следующим образом: [возраст] + [ИМТ] – [толщина m. levator ani]. Общая сумма составила -31 баллов. Вероятность недержания мочи составит 20%. По такому же принципу были построены номограммы для всех контрольных точек наблюдения.
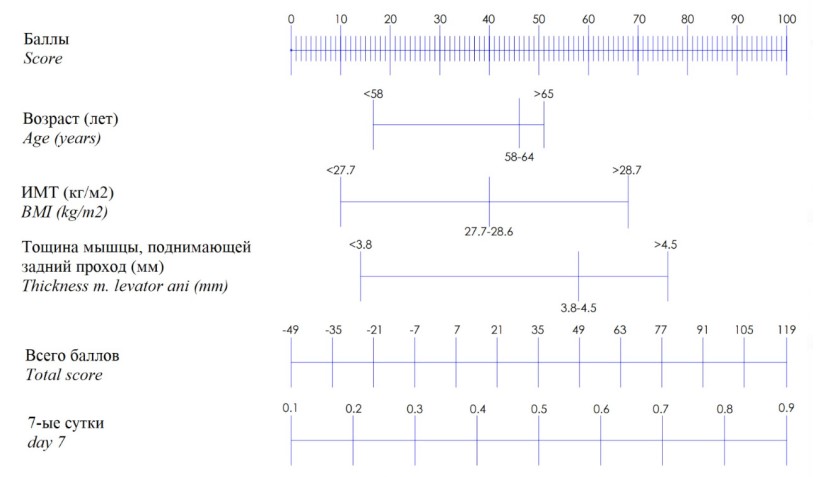 Рисунок 1. Номограмма на 7-е сутки после удаления уретрального катетера
Рисунок 1. Номограмма на 7-е сутки после удаления уретрального катетера
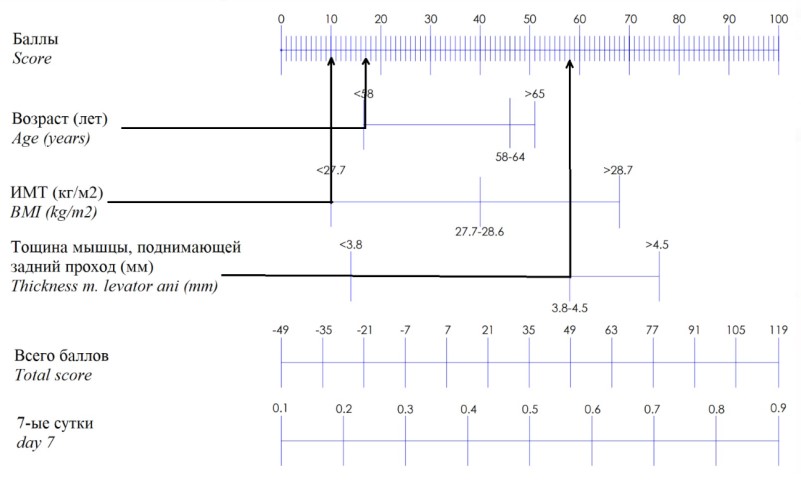 Рисунок 2. Пример расчёта вероятности недержания мочи на 7-е сутки после удаления уретрального катетера
Рисунок 2. Пример расчёта вероятности недержания мочи на 7-е сутки после удаления уретрального катетера
Обсуждение
Робот-ассистированная РПЭ во всём мире признана «Золотым стандартом» лечения локализованных форм рака простаты, она имеет ряд неоспоримых преимуществ перед позадилонной или лапароскопической РПЭ [8, 9]. Число роботассистированных РПЭ неуклонно растёт, и вместе с этим закономерно увеличивается количество постоперационных осложнений, при этом недержание мочи является социально значимым последствием перенесённой операции, значительно ухудшающим качество жизни, в связи с чем данная проблема глубоко изучается [10, 11]. Следует учитывать, что по данным литературы возникновение недержания мочи носит полиэтиологический характер, начиная от индивидуальных особенностей пациента и заканчивая неточностями в действиях хирурга во время проведения оперативного вмешательства [11]. Факторы риска недержания мочи изучались во множестве исследований. Так S.F. Mungovan et al. (2021) к ним отнесли пожилой возраст, высокие показатели индекса массы тела и малую длину мембранозного отдела уретры [12].
По результатам нашего исследования установлено, что при медиане наблюдения 12 месяцев недержание мочи оставалось у 11,9% больных, что сопоставимо с результатами международных исследований [7]. Нельзя не отметить тот факт, что степень недержания мочи уменьшалась в течение периода наблюдения. Так, среднее количество используемых прокладок на 1-е сутки после операции составило 2,59 шт / сутки, а на 12-й месяц наблюдения это число сократилось до 0,54 шт / сутки. Схожие результаты по снижению количества используемых абсорбирующих средств после операции были получены в других исследованиях [13, 14].
Целью нашего исследования являлось определение факторов риска недержания мочи после перенесённой робот-ассистированной РПЭ. Результаты, полученные в ходе исследования, позволили разработать способ прогнозирования недержания мочи, который был зарегистрирован в государственном реестре изобретений (Патент РФ RU2804289C1). При этом с помощью наших номограмм представляется возможным определять риски недержания у отдельных пациентов. К примеру, при наличии гиперактивного мочевого пузыря операций на предстательной железе в анамнезе, в возрасте более 66 лет, ИМТ больше 28,62 кг/м2, толщине мышцы, поднимающей задний проход, менее 4,15 мм, объёме предстательной железы более 62,8 см3, длине мембранозного отдела уретры менее 11,9 мм, толщине шейки мочевого пузыря менее 3,9 мм риски возникновения недержания мочи после радикальной робот-ассистированной простатэктомии повышаются вплоть до 100%.
Нельзя не отметить тот факт, что среди исследуемых параметров можно выделить группу модифицируемых факторов риска. Так, снижение индекса массы тела и выполнение упражнений, укрепляющих мышцы тазового дна, вызывающих гипертрофию m. levator ani позволят снизить риски возникновения недержания мочи. Полученные нами результаты во многом сопоставимы с данными международных исследователей [15 – 18].
Таким образом, полученные данные демонстрируют хорошие результаты радикального лечения в объёме роботассистированной РПЭ по поводу рака предстательной железы не только в онкологическом, но и в функциональном плане, а лучшее понимание принципов возникновения недержания мочи в постоперационном периоде позволит снизить вероятность её появления.
Заключение
Несмотря на развитие хирургических методик и всё лучшее понимания анатомии органов и структур малого таза, недержание мочи после робот-ассистированной простатэктомии встречается довольно часто. При этом отрицательное влияние инконтиненции на качество жизни очевидно. Однако с течением времени степень тяжести недержания мочи уменьшается и через год после операции недержание мочи встречается у небольшого числа больных. Часто пациенты имеют завышенные ожидания от результатов операции и использование разработанных нами номограмм в рутинной практике поможет врачам-урологам обсудить с больным риски недержания мочи в каждом конкретном случае. Среди выявленных предикторов можно выделить модифицируемую группу, когда с помощью собственных усилий сам пациент может снизить риск и степень тяжести недержания мочи после операции.










