Мультипараметрическая МРТ в планировании анатомосберегающей робот-ассистированной радикальной простатэктомии при локализованном раке предстательной железы низкого и промежуточного риска прогрессирования
Введение
Робот-ассистированная радикальная простатэктомия (РАРП) с той или иной нервосберегающей модификацией является методом выбора хирургического лечения локализованного рака предстательной железы (РПЖ) у пациентов с низким и, в меньшей степени, промежуточным риском онкопрогрессии. Нежелательными последствиями РАРП являются положительный хирургический край (ПХК), эректильная дисфункция и длительное восстановление континенции. Впервые Mani Menon и соавт. продемонстрировали модификацию анатомосберегающей РАРП, которая отличалась сравнительно высокими показателями быстрого (1-й месяц) и немедленного (1-я неделя после удаления уретрального катетера) восстановления континенции и эректильной реабилитации после проведенной операции [1]. Подобные результаты во многом были обусловлены «буквально вылущиванием» простаты из собственного ложа с полным сбережением фасциального покрова, в том числе и передней поверхности простаты (Veil of Aphrodite, «вуаль Афродиты») [2, 3]. Аналогичные функциональные результаты оказались достижимы также при иной разновидности анатомосберегающей РАРП – Ретциус-сберегающей робот-ассистированной простатэктомии [2].
Последующие исследования [3] установили, что подобное тотальное анатомосбережение «компрометирует» результаты радикального хирургического лечения РПЖ, сопровождаясь повышением уровня ПХК, преимущественно по передней поверхности органа. Такие результаты могут быть обусловлены сравнительно высоким поражением передних отделов предстательной железы (ПЖ) и отсутствием четкой границы с передним фасциальным покровом железы.
Предоперационная мультипараметрическая магнитно-резонансная томография (мпМРТ) при планировании операции позволяет детализировать локацию ракового поражения, предоставляя хирургу возможность индивидуального планирования анатомосбережения и, в случае поражения передних отделов железы, отказа от сохранения «вуали Афродиты» или выбора в пользу ее редуцированного сбережения с сохранением лишь основного опорного компонента, располагающегося на безопасном расстоянии от апекса ПЖ. Подобный подход может содействовать оптимизации онкологических результатов операции при сохранении немедленной континенции и эректильной реабилитации на достойном уровне.
Mультипараметрическая магнитно-резонансная томография продемонстрировала многообещающие результаты в диагностике и топической детализации локализованного РПЖ [4–6]. Внедрение методик, позволяющих с большей достоверностью определить степень Глисона на предоперационном этапе в сравнении с патоморфологическим заключением, позволит улучшить диагностику РПЖ и благоприятно повлияет на результаты лечения [7].
Тем не менее определение групп риска онкопрогрессии для локализованного РПЖ по критериям Национальной объединенной онкологической сети (National Comprehensive Cancer Network, NCCN) заключается в оценке уровня простатического специфического антигена (ПСА) крови, степени Глисона по результатам биопсии, клинической Т-стадии, а также результатов трансректального ультразвукового исследования, и до сих пор не включает результаты мпМРТ [8].
Такая концепция часто приводит к более радикальной стратегии лечения, однако 30–50 % мужчин в группах низкого и промежуточного риска имеют локализованное заболевание и, соответственно, могут рассчитывать на по- лучение фасцио- и нервосберегающего хирургического пособия [9, 10]. По данным исследования Bong Hee Park и соавт., до 57 % выполняемых простатэктомий на основании данных мпМРТ могут быть проведены с анатомосберегающей техникой [11]. Так, недавние исследования отражают прогностическую значимость экстракапсулярной экстензии (ЭКЭ) по данным мпМРТ у пациентов с различным риском онкопрогрессии согласно критериям D’Amico; также обращено внимание на возможность изменения хирургической стратегии на основе предварительно проведенной мпМРТ [12, 13].
Поскольку РАРП предполагает положительный онкологический результат у пациентов с pT1–pT2- заболеванием, предоперационная мпМРТ должна быть сосредоточена не только на прогнозировании ЭКЭ, но и на подборе хирургического вмешательства, направленного на оптимальное сохранение качества жизни (сохранение фасциально-связочного аппарата и сосудисто-нервных пучков) и отсутствие ПХК. В предыдущем, пилотном, исследовании мы оценили высокую степень совпадений фокусов РПЖ по данным мпМРТ и результатам патоморфологического заключения, однако полученные данные считали предварительными, так как имела место малая выборка наблюдений [10].
В данной работе мы планируем оценить значимость дооперационной мпМРТ в планировании анатомосберегающей РАРП на основании большей выборки.
Цель исследования – изучить роль мпМРТ, спрогнозировать ЭКЭ, инфильтрацию семенных пузырьков, сосудисто-нервных пучков и статус ПХК при РАРП с фасцио- и нервосберегающей методикой и редуцированной анатомосберегающей методикой у больных с низким и промежуточным онкологическим риском; оценить безопасность РАРП с анатомосберегающими методиками с точки зрения онкологических результатов у указанной категории пациентов.
Материалы и методы
Выборка пациентов
Пациенты были внесены в проспективную базу данных Первого МГМУ им. И. М. Сеченова для анализа результатов мпМРТ с оценкой по PI-RADS v. 2, включая результаты трансректальной биопсии ПЖ. Все пациенты дали соответствующее письменное информированное согласие.
Мы ретроспективно проанализировали данные 54 пациентов, которым была выполнена мпМРТ органов малого таза с контрастным веществом с последующей трансректальной или фьюжн-биопсией. Во всех случаях была выполнена разновидность анатомосберегающей РАРП с фасцио- и нервосбережением (n = 21 (38,9 %)) (патент на изобретение № 2694219) или анатомосберегающая РАРП с редуцированным анатомосбережением (n = 33 (61,1 %)) (патент на изо- бретение № 2745711). Всем пациентам была выполнена мпМРТ из-за повышенного уровня ПСА и / или положительного результата биопсии. Пациенты были разделены на группы низкого риска (ПСА ≤10 нг / мл, комбинированный балл Глисона ≤(3 + 3) и клиническая стадия T1–2a (n = 21)), а также промежуточного риска (ПСА 10–20 нг / мл и / или балл по Глисону ≤(3 + 4), и / или клиническая стадия T2b–T2c (n = 33)) в соответствии с критериями NCCN. Проведен анализ результатов мпМРТ и патогистологического исследования путем сравнения наиболее крупных очагов опухоли, выявленных при мпМРТ (см. раздел «Патоморфологическое исследование»). Критериями исключения являлись: высокий онкологический риск, поражение семенных пузырьков, ЭКЭ, метастазы в регионарные лимфатические узлы.
Методика мпМРТ и интерпретация данных
Все исследования выполняли на аппарате с напряженностью магнитного поля 3 Тесла (Siemens Magnetom Verio) с использованием многоканальной поверхностной катушки.
Анализу подвергли T2-, Т1-взвешенные изображения, диффузионно-взвешенные изображения, карту диффузии, а также изображения, полученные после динамического контрастного усиления. Исследование интерпретировали радиологи экспертного уровня. Итоговую оценку локализации и характеристик выявленных поражений проводили с использованием зональной схемы ПЖ (рис. 1) и классификации PI-RADS v. 2.
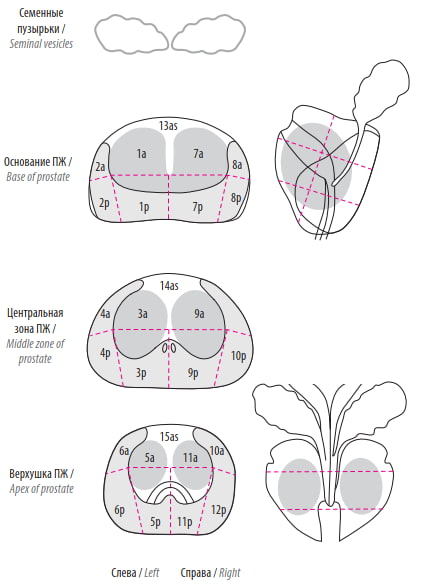 Рис. 1. Зональная схема предстательной железы (ПЖ). Точками на схеме ПЖ отмечались наиболее значимые очаги опухоли. Благодаря такому наглядному схематическому отражению локализации поражения специалисты-патоморфологи имеют возможность прицельно исследовать необходимые сегменты ПЖ и при необходимости выполнять секцию выделенной области более детально
Рис. 1. Зональная схема предстательной железы (ПЖ). Точками на схеме ПЖ отмечались наиболее значимые очаги опухоли. Благодаря такому наглядному схематическому отражению локализации поражения специалисты-патоморфологи имеют возможность прицельно исследовать необходимые сегменты ПЖ и при необходимости выполнять секцию выделенной области более детально
Благодаря мультипараметрическим данным не составляет труда интерпретировать любые изображения органов малого таза, даже у пациентов, перенесших биопсию ПЖ в течение последнего месяца (рис. 2).
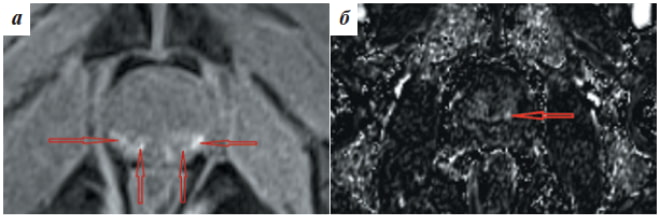 Рис.2. Магнитно-резонансные томограммы пациента А., 59 лет (состояние после биопсии): а – исследование без контрастирования, Т1-взвешенное изображение с подавлением сигнала от жировой ткани в аксиальной проекции. В периферической зоне предстательной железы визуали- зируются множественные высокоинтенсивные участки кровоизлияний (отмечены стрелками); б – исследование с контрастированием, Т1-взвешенное субтракционное изображение в аксиальной проекции. Определяется раннее накопление контрастного препарата в очаге аденокарциномы, локализованном в периферической зоне предстательной железы (отмечено стрелкой)
Рис.2. Магнитно-резонансные томограммы пациента А., 59 лет (состояние после биопсии): а – исследование без контрастирования, Т1-взвешенное изображение с подавлением сигнала от жировой ткани в аксиальной проекции. В периферической зоне предстательной железы визуали- зируются множественные высокоинтенсивные участки кровоизлияний (отмечены стрелками); б – исследование с контрастированием, Т1-взвешенное субтракционное изображение в аксиальной проекции. Определяется раннее накопление контрастного препарата в очаге аденокарциномы, локализованном в периферической зоне предстательной железы (отмечено стрелкой)
Хирургическая техника
Выполнено 54 (100 %) РАРП с использованием редуцированной анатомосберегающей техники, а также фасцио- и нервосберегающей методики. При РАРП с фасцио- и нервосбережением ПЖ и семенные пузырьки удаляли без вскрытия сухожильных дуг эндопельвикальной фасции таза, извлекая их из окружающих фасций через небольшое окно в висцеральной тазовой фасции и пубовезикальных связках. Мобилизацию железы начинали с задней поверхности, полностью сохраняя элементы пубовезикальных связок, прилежащих к передней поверхности органа и основного компонента дорсального венозного комплекса, покрытого висцеральным листком тазовой фасции («вуаль Афродиты»). В отличие от фасцио- и нервосберегающей методики при редуцированной анатомосберегающей технике выполняли резекцию «вуали Афродиты» и пубовезикальных связок (рис. 3, 4).
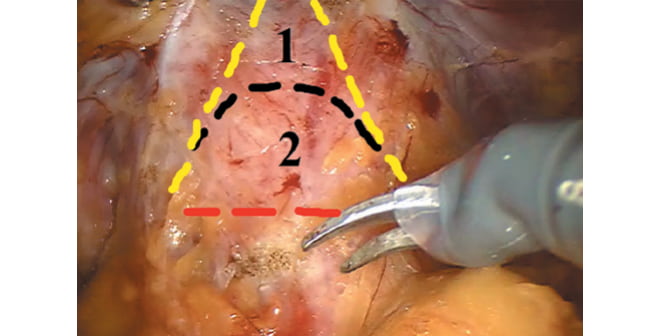
Рис. 3. Схематичное изображение резекции анатомических структур
при робот-ассистированной радикальной простатэктомии: 1 – редуцированная анатомосберегающая методика; 2 – фасцио- и нервосберегающая методика
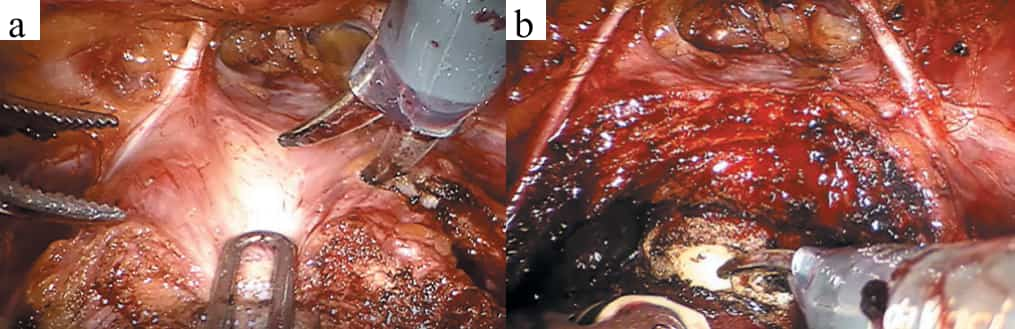 Рис. 4. Интраоперационные изображения: объем сохранения переднего покрова предстательной железы при фасцио- и нервосберегающей (а) и редуцированной анатомосберегающей (б) методиках робот-ассистированной радикальной простатэктомии
Рис. 4. Интраоперационные изображения: объем сохранения переднего покрова предстательной железы при фасцио- и нервосберегающей (а) и редуцированной анатомосберегающей (б) методиках робот-ассистированной радикальной простатэктомии
Все РАРП были выполнены опытным хирургом. Операции планировали в соответствии с данными мпМРТ. При локализации очага в апексе предусматривали удаление дополнительно 2–3 мм дистальной уретры, при преимущественном поражении базиса – полностью удаляли проксимальную уретру. При диссекции в области апекса принимали во внимание форму железы, представленную данными мпМРТ. На стороне большего поражения, в случае затруднений с дифференцировкой капсулы железы, выполняли экономную резекцию сосудисто-нервного пучка и последующее получение тканей для исследования на предмет хирургических краев.
Патоморфологическое исследование
Патоморфологическое исследование макропрепарата удаленной ПЖ выполняли специалисты с многолетним опытом в соответствии с международным стандартом, а также в соответствии с рекомендациями Международного общества уропатологов (International Society of Urological Pathology, ISUP). Все образцы макропрепаратов фиксировали в 10 % забуференном формалине в течение 24 ч. После фиксации всю поверхность макропрепарата, включая основание семенных пузырьков, окрашивали специальным гистологическим красителем для оценки наличия ПХК. Каждый макропрепарат был окрашен специальными тканевыми красителями и подвергнут ступенчатой секции согласно Стэнфордской процедуре. В отдельный цвет окрашивали часть «вуали Афродиты», прилежащую к базису ПЖ (группа с редуцированной анатомосберегающей техникой), или бывшее место ее фиксации на ПЖ (группа с фасцио- и нервосберегающей методикой) с целью определения безопасности предложенных анатомосберегающих методик. Фиксированная ПЖ нарезалась на 3–4-миллиметровые срезы с последующей окраской гематоксилином и эозином по общепринятой методике. Базис и апекс выделяли отдельно. Более детально прорабатывали участок поражения согласно данным мпМРТ. Локализацию опухоли на магнитно-резонансных томограммах в сравнении с данными гистологического исследования мы регистрировали как «отсутствие совпадения», «полное совпадение» или «частичное совпадение» [14, 15]. Полное совпадение обозначает, что расположение опухоли при патогистологическом исследовании совпадает с данными мпМРТ. Частичное совпадение означает отклонение местоположения до ближайшей соседней зоны. Например, поражена латеральная поверхность по данным патогистологического исследования и дорсолатеральная – по данным мпМРТ, что может возникнуть из-за усадки и деформации образца во время подготовки гистологических образцов. Определение патоморфологической рТ-стадии являлось решающим в отношении ЭКЭ для всех опухолей. Мы определяли ПХК как любую степень ПХК с длиной поля ≤3 мм (фокальное) или >3 мм (мультифокальное) [16].
Прицельно исследовались и сопоставлялись самые крупные очаги с наибольшей оценкой PI-RADS по данным мпМРТ и самые крупные очаги с наивысшим баллом Глисона. Пример окраски макропрепарата с полным сохранением «вуали Афродиты» и пубовезикальных связок представлен на рис. 5.
 Рис. 5. Макропрепарат. Удаленная в ходе операции предстательная железа с семенными пузырьками окрашена тканевым красителем в 2 цвета: оранжевый цвет – передняя поверхность предстательной железы, прилегающая (до удаления) к «вуали Афродиты», черный цвет – все остальные поверхности предстательной железы, включая семенные пузырьки
Рис. 5. Макропрепарат. Удаленная в ходе операции предстательная железа с семенными пузырьками окрашена тканевым красителем в 2 цвета: оранжевый цвет – передняя поверхность предстательной железы, прилегающая (до удаления) к «вуали Афродиты», черный цвет – все остальные поверхности предстательной железы, включая семенные пузырьки
Результаты
Группы пациентов проанализированы описательно. Осложнений РАРП при обеих модификациях выше 1–2-го класса по шкале Клавьен–Диндо не наблюдали.
Исследовано: наличие ЭКЭ, поражение семенных пузырьков, локализация и размеры наиболее значимых (крупных) очагов рака по данным мпМРТ. Результаты мпМРТ сопоставлены с патогистологическим заключением. Оценено наличие, локализация и размеры ПХК.
Средний возраст пациентов составил 58,0 лет, средний уровень пребиопсийного ПСА – 7,9 нг / мл, сред- ний объем ПЖ – 49 см3, PI-RADS – 2–4 балла. Во всех случаях по данным мпМРТ ЭКЭ выявлено не было. ПХК во всей выборке выявлен в 8 (14,8 %) случаях, из них 7 (12,9 %) размерами от 0,1 до 0,4 см. ПХК по передней поверхности зафиксирован в 3 наблюдениях в группе с тотальным анатомосбережением, в то время как в группе с редуцированной анатомосберегающей методикой ПХК по передней поверхности выявлено не было. В 1 случае выявлен мультифокальный ПХК размером более 3 мм по передней поверхности. Лишь в 1 случае по результатам патогистологического заключения выявлено поражение семенных пузырьков (pT3b), в то время как по данным мпМРТ таковое не зафиксировано. У 21 (38,9 %) пациента диагностирована клиническая стадия Т1с–Т2а, в 33 (61,1 %) случаях – Т2а–с. В 44 (81,5 %) случаях зафиксировано повышение стадии Т после проведенного патогистологического исследования. Однако повышение до стадии pT3 выявлено лишь в 2 (3,7 %) случаях, в 1 из них выявлен описанный ранее мультифокальный ПХК. Полное и частичное совпадение данных о локализации опухоли зафиксировано в 48 (88,9 %) наблюдениях, совпадение отсутствовало в 6 (11,1 %) наблюдениях (рис. 6). По результатам мпМРТ и гистологических заключений поражение передней поверхности (фибромускулярной стромы) обнаружено в 14 (25,9 %) и 11 (20,4 %) наблюдениях соответственно, в этих случаях зафиксировано полное совпадение локализации очагов. Немедленная континенция в общей выборке (1- я неделя после удаления катетера) зафиксирована в 39 (72,2 %) случаях.
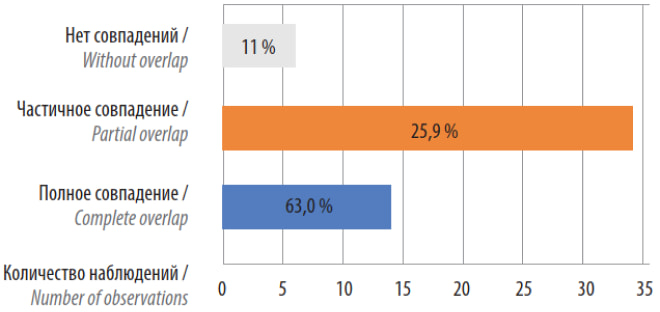 Рис. 6. Частота совпадений данных о локализации очагов рака предстательной железы по результатам мультипараметрической магнитно-резонансной томографии и по результатам патоморфологического заключения
Рис. 6. Частота совпадений данных о локализации очагов рака предстательной железы по результатам мультипараметрической магнитно-резонансной томографии и по результатам патоморфологического заключения
Обсуждение
Нервосберегающие и анатомосберегающие модификации интерфасциальной РАРП предполагают риск ЭКЭ, который может варьировать от 11,0–18,0 до 20,0– 30,0 % в группах низкого и среднего риска соответственно [15, 17–19]. Для оценки рисков ЭКЭ мы сопоставили результаты нашего исследования с недавними публикациями, демонстрируя, что предоперационная мпМРТ однозначно позволяет в значительной мере предсказать ЭКЭ у пациентов с низким и промежуточным риском онкопрогрессии [1 9, 20]. В отличие от стадирования на основании уровня ПСА, данных трансректального ультразвукового исследования, степени Глисона и результатов биопсии, мпМРТ позволяет определить риск ЭКЭ и с большой вероятностью предсказать наличие локализованного процесса [20]. Такой подход может играть решающую роль в оценке вероятности ПХК и ЭКЭ как на предоперационном, так и на интраоперационном этапе [21]. Известно, что мпМРТ благоприятно сказывается на решении хирурга о сбережении или удалении сосудисто-нервных пучков [22]. В аналогичных исследованиях частота ПХК варьирует от 15 до 20 % при анатомосберегающих РАРП [23, 24]. Результаты нашего исследования могут незначительно отличаться ввиду меньшей выборки.
Наши данные свидетельствуют о том, что проведение предоперационной мпМРТ, результаты которой лежат в основе планирования операции, может снижать процент ПХК после РАРП с анатомосбережением. В частности, снижение количества обширных (>3 мм) ПХК может предотвратить последующие биохимические рецидивы [25, 26]. Известно, что чувствительность и специфичность могут изменяться в зависимости от размера очага рака в ПЖ. Так, при размерах очагов 0,2–0,5 мл чувствительность и специфичность составляют 77 и 91 % соответственно, в то время как при размерах очага выше 0,5 мл – 90 и 88 % соответственно [21]. В связи с этим возрастает диагностическая ценность фьюжн-биопсии ПЖ по сравнению с традиционной биопсией из 12 точек.
Мультипараметрическая магнитно-резонансная томография также предрасполагает хирурга при выборе тактики оперативного пособия к решению в пользу анатомо- и нервосбережения. Благодаря данным мпМРТ хирургическая тактика может изменяться (до 75 % случаев среди пациентов низкого и промежуточного риска) в сторону анатомосберегающих методик [19, 27].
Известно, что при РАРП с анатомосбережением существует вероятность артефактных ПХК вследствие интраоперационной обработки препарата. Имеет место вариабельность и субъективность в оценке патоморфологами экстракапсулярного распространения и ПХК, что может быть связано с трудностями в выявлении капсулы ПЖ, особенно в области ее апекса [28, 29]. К сожалению, при анализе магнитно-резонансных томограмм существует риск ложноположительных данных о присутствии ЭКЭ, что может повлечь излишне радикальные оперативные пособия.
Наши данные свидетельствуют о том, что предоперационное выполнение мпМРТ следует использовать при выборе анатомосберегающих методик. В частности, при выявлении значимых очагов в фибромускулярной строме ПЖ следует воздержаться от тотального анатомосбережения в пользу редуцированной технологии. Подобная тактика позволит оптимизировать онкологические результаты без ущерба для функционального компонента. Помимо мпМРТ, интраоперационные замороженные срезы, как известно, способствуют снижению частоты ПХК и увеличению степени нервосбережения [30], а также могут стать способом улучшения как онкологического, так и функционального результатов. В нашем исследовании данная методика не выполнялась.
Заключение
На основании полученных в ходе исследования данных можно заключить, что мпМРТ должна быть неотъемлемой составляющей планирования РАРП с анатомосберегающими методиками. Также стоит обращать внимание на поражение передней поверхности ПЖ по данным мпМРТ, в случае поражения последней целесообразно отказаться от тотального анатомосбережения с целью минимизации рисков выявления ПХК. Таким образом, выбор модификации анатомосбережения основан на результатах мпМРТ. Опираясь на вышеуказанные выводы, можно утверждать, что РАРП с фасцио- и нервосберегающей методикой, а также редуцированной анатомо- и нервосберегающей методикой при дифференцированном подходе, основанном на предоперационной мпМРТ, значимо не отличаются с точки зрения онкологических результатов (ПХК). Наряду с этим, представленные анатомосберегающие методики позволяют добиться высоких показателей немедленной континенции при отсутствии значимых осложнений. Благодаря стандартизированному выполнению мпМРТ при низком и промежуточном риске онкопрогрессии в значительной степени возрастает вероятность выполнения обоснованных с онкологической точки зрения анатомосберегающих пособий, что несомненно оптимизирует и онкологический, и функциональный компоненты операции.









