Клинико-морфологическая оценка результатов стандартной робот-ассистированной нервосберегающей радикальной простатэктомии и с применением техники с сохранением ретциева пространства
Цель: сравнить периоперативные, функциональные и клинико-морфологические результаты стандартной робот-ассистированной нервосберегающей радикальной простатэктомии и с применением техники с сохранением Ретциева пространства. Материалы и методы. Проведен проспективный анализ двух групп пациентов (n=54), перенесших нервосберегающую робот-ассистированную радикальную простатэктомию с 2017 по 2018 г. В первую группу вошли 29 пациентов, которым была выполнена нервосберегающая роботассистированная радикальная простатэктомия с сохранением Ретциева пространства, во вторую – 25, прооперированных по стандартной методике двусторонней нервосберегающей радикальной простатэктомии. Все пациенты были сопоставимыми по исходным характеристикам. Во всех случаях больные имели гистологически верифицированный локализованный рак предстательной железы рТ2а–2с.
Результаты. При применении техники с сохранением Ретциева пространства отсутствует статистически значимая разница в продолжительности операции (243,60 мин vs 236,64 мин в 1-й и 2-й группах, p>0,05) и интраоперационной кровопотери (131,20 мл vs 122,57 мл в 1-й и 2-й группах, p>0,05). В отношении динамики восстановления функции удержания мочи техника со сбережением Ретциева пространства демонстрирует преимущества в скорости и частоте во все сроки наблюдения (54,13% vs 41,81%; 68,12% vs 59,21%; 94,15% vs 90,63%; 98,54% vs 97,12%; 98,62% vs 97,31%; 98,83% vs 97,82% – через неделю после удаления уретрального катетера, 1, 3, 6, 9 и 12 мес. в 1-й и 2-й группах соответственно). Частота восстановления эректильной функции через 12 мес. составила 82,17 и 71,14% в 1-й и 2-й группах соответственно. Выводы. Нервосберегающая робот-ассистированная радикальная простатэктомия с использованием техники с сохранением Ретциева пространства превосходит стандартную операцию в скорости и сроках восстановления удержания мочи и эректильной функции.
Авторы заявляют об отсутствии конфликта интересов. Для цитирования: Голубцова Е.Н., Велиев Е.И., Соколов Е.А., Паклина О.В., Кнышинский Г.В. Клинико-морфологическая оценка результатов стандартной робот-ассистированной нервосберегающей радикальной простатэктомии и с применением техники с сохранением Ретциева пространства. Урология. 2021;3:98–103 Doi: https: //dx.doi.org/10.18565/urology.2021.3.98-103
Авторы заявляют об отсутствии конфликта интересов. Для цитирования: Голубцова Е.Н., Велиев Е.И., Соколов Е.А., Паклина О.В., Кнышинский Г.В. Клинико-морфологическая оценка результатов стандартной робот-ассистированной нервосберегающей радикальной простатэктомии и с применением техники с сохранением Ретциева пространства. Урология. 2021;3:98–103 Doi: https: //dx.doi.org/10.18565/urology.2021.3.98-103
Введение. Актуальность проблемы лечения пациентов, страдающих раком предстательной железы (РПЖ), определяется продолжающимся ростом заболеваемости во многих странах. В России в настоящее время рак простаты – одно из наиболее частых злокачественных заболеваний у мужчин и занимает второе место в структуре заболеваемости после опухолей органов дыхательной системы [1]. Широкое внедрение ранней диагностики позволило повысить частоту выявления патологии на ранних стадиях. Это обстоятельство в свою очередь расширяет возможности радикального лечения пациентов. Несмотря на то что доступны различные методы лечения локализованного РПЖ, именно радикальная простатэктомия (РПЭ) позволяет выполнять полное удаление простаты с семенными пузырьками и существенно повышать шансы на безрецидивную выживаемость. Появившись около 2 десятилетий назад, роботическая хирургия активно развивается и занимает лидирующие позиции в лечении пациентов, страдающих РПЖ. Предложены различные хирургические техники, направленные на улучшение функциональных исходов робот-ассистированной радикальной простатэктомии (РРПЭ) [2]. Благодаря многократному увеличению зоны вмешательства и свободе движений в ней роботическая хирургия позволяет прецизионно исполнять нервосбережение, апикальную диссекцию и сохранение шейки мочевого пузыря. Именно эти моменты, по мнению большинства хирургов, являются ключевыми и во многом определяют скорость и качество восстановления удержания мочи в послеоперационном периоде [3–5]. По мере увеличения числа роботических операций предлагаются и внедряются различные реконструктивные техники. Так, в число наиболее активно используемых и обсуждаемых входит техника с сохранением Ретциева пространства. По результатам ряда крупных исследований этот прием позволяет значимо сокращать период недержания мочи (НМ) после операции [6–7].
Материалы и методы. Проспективному анализу были подвергнуты 54 пациента с клинически локализованной формой РПЖ, перенесших нервосберегающую робот-ассистированную радикальную простатэктомию (НС-РРПЭ) в клинике урологии и хирургической андрологии РМАНПО на базе 14-го урологического отделения ГКБ им. С. П. Боткина с 2017 по 2018 г. Пациенты с неоадъювантной терапией (лучевой и/или гормональной), хирургическими вмешательствами и травмой органов малого таза в анамнезе, злоупотреблявшие алкоголем, страдавшие системными заболеваниями нервной системы, были исключены из исследования. Все больные были разделены на две группы. Характеристика пациентов в группах представлена в табл. 1. В первой группе (n=29) пациентам была выполнена НС-РРПЭ с тотальным нервосбережением с сохранением Ретциева пространства, во второй (n=25) – стандартная НС-РРПЭ. Пациенты, которым планировалось сохранение сосудисто-нервных пучков (СНП), имели ПСА 10 нг/мл или меньше, процент поражения биоптатов <20%, сумму Глисона 6 баллов или меньше, отсутствие периневральной и экстракапсулярной инвазии (по данным биопсии предстательной железы) и магнитно-резонансной томографии (МРТ). В числе показаний к нервосберегающей технике следует отметить сохранную эректильную функцию (ЭФ), которая оценивалась как способность достигать и поддерживать эрекцию, достаточную для совершения полового акта. Все мужчины полностью удерживали мочу (отсутствие стрессового, ургентного или смешанного НМ).
В послеоперационном периоде пациенты получали программу пенильной реабилитации, направленную на восстановление ЭФ. Терапия включала назначение ингибиторов фосфодиэстеразы 5-го типа (иФДЭ-5) в малых дозах ежедневно на ночь и применение максимальных терапевтических доз иФДЭ-5 перед половым актом при появлении спонтанных эрекций.
Пациенты были оценены перед операцией, через 1 нед. после удаления уретрального катетера и через 1, 3, 6 и 12 мес. после НС-РРПЭ. Согласно критериям Международного общества удержания мочи (International Conitnence Society), понятие полного удержания мочи было определено как отсутствие подтекания мочи в покое или при физической нагрузке с возможным использованием одной прокладки в сутки в качестве страховочной. Легкая степень стрессового НМ предусматривала использование 1–2 прокладок в сутки, средняя – 3 прокладок в сутки, тяжелая – использование более 3 прокладок в сутки. ЭФ считалась восстановленной, если пациент на фоне приема иФДЭ-5 или без лекарственных средств был способен достигать и поддерживать эрекцию, достаточную для проведения полового акта.
Статистическая обработка получаемых данных осуществлялась с помощью компьютерных программ Microsoft Office Excel (2019, USA) и GraphPad Prism Version 8,0 (USA, 2018). В случае правильного распределения признаков данные представлялись в виде средних значений показателей (М) и среднеквадратических отклонений (SD). Если распределение признаков отличалось от нормального, данные представлялись в виде медианы и интерквартильного размаха (Ме [25 и 75% перцентиль]). Различия считали достоверными при р<0,05.
Операционный материал фиксировали в 10%-ном забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином. Для достоверной визуализации нервных волокон и подсчета их плотности проводили иммуногистохимическое исследование с использованием поликлональных антител к белку S100 (VENTANA, DAB), маркера клеток нейроэктодермального происхождения. Стеклопрепараты сканировали на гистоскане Ponoramic 3D Histotex.
Результаты. При гистологическом исследовании после РПЭ с сохранением Ретциева пространства нервные волокна в псевдокапсуле предстательной железы практически не определяются (рис. 1). При стандартной НС-РПЭ отмечается минимальное количество нервных волокон в виде тонкого веретена плотностью 1–2 на 2–3 см окружности железы, расположенных в псевдокапсуле (рис. 2).
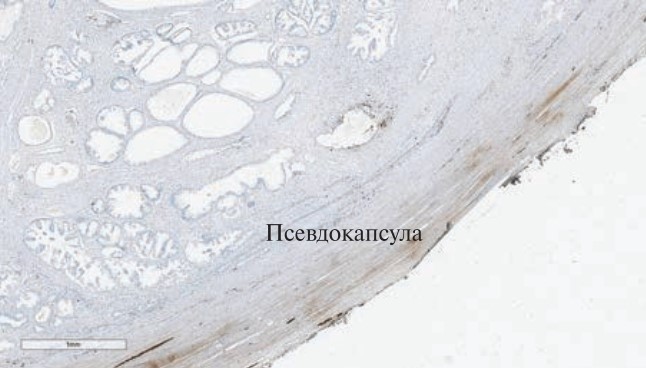 Рис. 1. Радикальная простатэктомия с сохранением Ретциева пространства ИГХ, Ѕ100. Нервные волокна в псевдокапсуле практически не определяются
Рис. 1. Радикальная простатэктомия с сохранением Ретциева пространства ИГХ, Ѕ100. Нервные волокна в псевдокапсуле практически не определяются
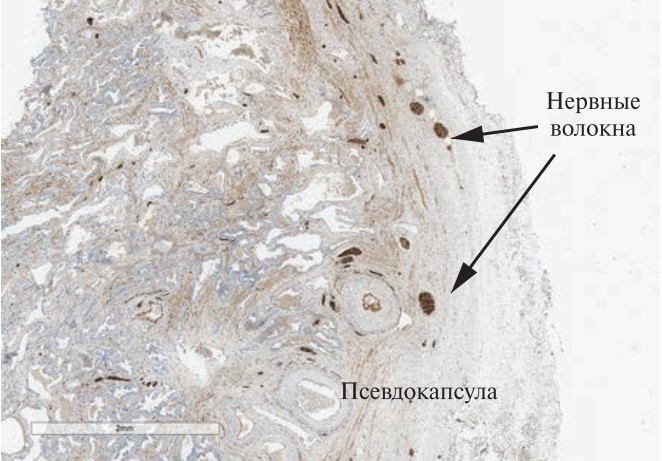 Рис. 2. Радикальная простатэктомия со стандартной техникой нервосохранения, ИГХ, Ѕ100. Плотность нервных волокон минимальная, составляет 1-2 на см длины окружности капсулы. Крупные нервные стволы просматриваются в наружном слое капсулы, жировая ткань отсутствует
Рис. 2. Радикальная простатэктомия со стандартной техникой нервосохранения, ИГХ, Ѕ100. Плотность нервных волокон минимальная, составляет 1-2 на см длины окружности капсулы. Крупные нервные стволы просматриваются в наружном слое капсулы, жировая ткань отсутствуетТаблица 1
Характеристика пациентов, участвовавших в исследовании
| Показатель | Первая группа | Вторая группа |
|---|---|---|
| Количество пациентов | 29 | 25 |
| Средний возраст, лет (M±SD)* | 62,2±5,7 | 63,3±6,8 |
| Индекс массы тела (M±SD)* | 26,6±3,8 | 28,5±4,9 |
| Предоперационный уровень общего ПСА, нг/мл (Me, 25–75% перцентилей)* | 6,69 (5,1–8,8) | 6,54 (5,2–11,8) |
| МИЭФ-15 (домен эректильной функции) (M±SD)* | 27,74±6,12 | 27,28±6,02 |
| Клиническая стадия Т, % | cT1c – 39,20 cT2a – 31,05 cT2b – 23,12 cT2c – 6,63 |
cT1c – 41,2 cT2a – 33,83 cT2b – 22,14 cT2c – 2,83 |
*p >0,05.
С целью сравнительной оценки представлены препараты, когда РПЭ выполнялась без нервосохранения. В прилежащей жировой ткани просматриваются нервные сплетения с ганглиями, удаленные вместе с железой (рис. 3). Их плотность очень высокая, но наиболее важным моментом является радикальность удаления нервных сплетений: парасимпатических и симпатических волокон вместе.
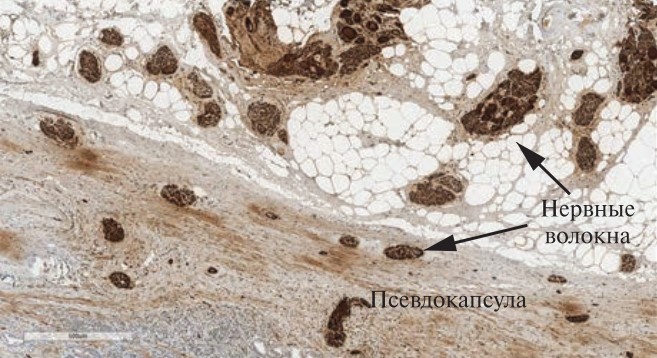
Рис. 3. Радикальная простатэктомия без нервосохранения, ИГХ, Ѕ100. Не только в наружном слое капсулы, но и в жировой ткани просматриваются крупные нервные стволы, удаляемые во время операции с предстательной железой
При сравнении периоперационных показателей, длительности операции (236,64 мин vs 243,60 мин, p>0,05) и объеме кровопотери (122,57 мл vs 131,20 мл, p>0,05) статистически значимых различий не отмечено.
Через неделю после удаления уретрального катетера в первой группе удержание мочи было достигнуто 54,13% пациентов, во второй – у 41,81%. Спустя месяц – у 68,12 и 59,21%. Через 3 мес. уровень удержания мочи вышел на плато и составил 94,15 и 90,63% в группах 1 и 2 соответственно. Через 6 мес. в первой группе мочу удерживали 98,54% пациентов, во второй – 97,12%. Спустя 9 мес. наблюдения частота удержания мочи составила 98,62 и 97,31%. По истечении 12 мес. в первой группе уровень удержания мочи составил 98,83%, во второй – 97,82 (табл. 2).
В обеих группах по окончании срока наблюдения отмечено стрессовое НМ I степени, частота которого в первой группе составила 1,17%, во второй – 2,18% (р<0,05). Стрессового НМ II и III степеней, требовавшего хирургического лечения, не наблюдалось.
Частота восстановления ЭФ через 12 мес. в 1-й группе составила 82,17%, во второй – 71,14%.
Таблица 2
Частота восстановления удержания мочи в группах
| Сроки наблюдения после удаления уретрального катетера | Процент пациентов, удерживающих мочу полностью | |
|---|---|---|
| первая группа, % | вторая группа, % | |
| Через 1 нед.* | 54,13 | 41,81 |
| Через 1 мес.* | 68,12 | 59,21 |
| Через 3 мес. | 94,15 | 90,63 |
| Через 6 мес. | 98,54 | 97,12 |
| Через 9 мес. | 98,62 | 97,31 |
| Через 12 мес. | 98,83 | 97,82 |
*p <0,05.
Обсуждение. Современная хирургия РПЖ ставит своей целью не только избавление пациента от опухоли, но и сохранение исходного качества жизни. Важно минимизировать влияние операции на функциональные исходы, при этом не рискуя онкологическими результатами [8,9]. По мере накопления знаний в области анатомии малого таза и клинико-морфологических работ становится возможным акцентировать внимание на анатомо-функциональных взаимосвязях структур, совершенствуя прецизионную технику исполнения НС-РПЭ [10, 11]. В свете такого подхода определенный интерес вызывает техника с сохранением Ретциева пространства.
При выполнении РПЭ (открытой, лапароскопической или робот-ассистированной) традиционный передний доступ к предстательной железе через позадилонное пространство предполагает прошивание и пересечение дорсального венозного комплекса, выделение пубопростатических связок, вскрытие эндопельвикальной фасции по латеральным поверхностям предстательной железы. Эти манипуляции в той или иной степени травмируют прилежащие структуры. В литературе присутствуют работы, подтверждающие их значимость в механизмах удержания мочи, продолжается дискуссия в отношении выбора оптимальной техники.
Целесообразность методики РРПЭ с сохранением Ретциева пространства состоит в сочетании преимуществ промежностного доступа и позадилонного. Промежностная техника выполнения РПЭ позволяет исполнять более деликатное выделение уретры и оставлять без пересечения дорсальный комплекс посредством заднего доступа к простате. Таким образом, удается избежать повреждений эндопельвикальной фасции и анатомических структур, окружающих предстательную железу по переднебоковым поверхностям.
Очевидным недостатком этого доступа является травма мышц тазового дна, что негативно влияет на восстановление удержания мочи. Напротив, позадилонная техника позволяет сохранять эндопельвикальную фасцию и мускулатуру тазового дна, но доступ в Ретциево пространство сопряжен с травматизацией в той или иной степени передней поверхности мочевого пузыря и простаты. Это обстоятельство неизбежно влечет за собой повреждение сосудисто-нервных структур, расположенных в этой области. Одним из возможных объяснений значимости сохранения анатомических структур, прилежащих к передней поверхности апекса простаты, является их поддерживающая и стабилизирующая функция в отношении наружного уретрального сфинктера. В ряде исследований доказано, что техника с сохранением Ретциева пространства демонстрирует более быстрое восстановление удержания мочи в послеоперационном периоде. Обращает внимание факт существенной разницы в скорости восстановления удержания мочи в ранние сроки после РПЭ [12–15]. По сообщению S. Lim et al., при сравнительной оценке функциональные исходы сопоставимы в группах с традиционной РРПЭ и с сохранением Ретциева пространства. Не отмечено статистически значимой разницы в кровопотере и частоте осложнений. Консольное время значительно ниже при использовании техники со сбережением Ретциева пространства, что, вероятно, обусловлено, уменьшением времени на реконструкцию [16]. При этом частота раннего восстановления удержания мочи существенно выше в группе пациентов, в отношении которых применялось сохранение Ретциева пространства. Так, в частности, A. Galfano et al. сообщили об уровне удержания мочи 91% через 1 нед. после РПЭ с использованием этой хирургической техники [17]. О подобных результатах сообщают S. Lim et al., через 1 мес. после операции 70% оперированных демонстрировали полное удержание мочи, тогда как в группе без сохранения Ретциева пространства – 50% [18]. По результатам нашей работы через неделю после удаления уретрального катетера в группе пациентов, в отношении которых применялась техника сохранения Ретциева пространства, удержание мочи было достигнуто 54,13% оперированных, в группе стандартной НС-РРПЭ – 41,81%. Спустя месяц – 68,12 и 59,21%. Таким образом, статистически значимые различия в частоте удержания мочи отмечены в ранние сроки после НС-РРПЭ. Через 3 мес. уровень удержания мочи вышел на плато и составил 94,15 и 90,63% в группах 1 и 2 соответственно. Следует отметить, что в предыдущих работах клиники по анализу восстановления функции удержания мочи после открытой позадилонной РПЭ показатель полного удержания мочи выходил на плато к 6-му месяцу после операции [19]. Сохранение естественной анатомии зоны мочевого пузыря и передней брюшной стенки оставляет возможность безопасного наложения супрапубикального катетера. По мнению ряда исследователей, техника временного отведения мочи в послеоперационном периоде позволяет снижать число инфекционных осложнений со стороны нижних мочевыводящих путей и обеспечивать интактность зоны УВА. Кроме того, в части случаев является более комфортным метод дренирования мочевого пузыря для пациентов [20]. Еще одним привлекательным моментом техники с сохранением Ретциева пространства является возможность более удобного дополнительного иссечения потенциально вовлеченных СНП для хирургов, использующих методику нейроSAFE (интраоперационных замороженных срезов с целью оценки возможности сохранения СНП при условии отрицательного хирургического края). Напротив, при позадилонном доступе необходима медиальная ретракция мочевого пузыря с целью лучшей визуализации проксимальных зон СНП, что приводит к нежелательному натяжению УВА [21, 22].
Таким образом, сочетая преимущества промежностного и позадилонного доступов в технике с сохранением Ретциева пространства, становится возможным сохранение естественной анатомии зоны хирургического вмешательства. Результаты последних работ в области хирургии рака простаты говорят о важности максимально возможного сбережения нормальной анатомии малого таза. Сохраненная анатомия сосудисто-нервной сети определяет восстановление функции удержания мочи. Ряд работ продемонстрировал, что нервные волокна, расположенные по переднелатеральной поверхности простаты, в том числе в области дорсального венозного комплекса (вне сосудисто-нервных пучков, идущих по боковым поверхностям железы), имеют значение в механизмах восстановления ЭФ и удержания мочи [23, 24]. Такой подход к нервосбережению предполагает технику высокого вскрытия эндопельвикальной фасции и сохранение переднелатеральных нервных волокон. R. Ganzer et al. исследовали срезы предстательной железы после НС-РПЭ. Основная часть нервных волокон располагалась по заднебоковой поверхности простаты, что созвучно с классической техникой нервосбережения СНП. Однако существенное количество нервной ткани обнаружено на передней и передне-латеральных поверхностях простаты. И это обстоятельство создает предпосылки к технике с сохраением Ретциева пространства [25]. В нашей работе совместно с клиническими морфологами обнаружено, что при гистологическом исследовании после стандартной НС-РРПЭ отмечается минимальное количество нервных волокон на единицу поверхности в капсуле железы. После РРПЭ с сохранением Ретциева пространства нервные волокна в капсуле простаты практически не определяются. В числе дискутабельных моментов остается выяснение того, что эти волокна иннервируют строму предстательной железы или проникают в кавернозные тела [26]. A.Costello et al. провели иммуногистохимический анализ сосудисто-нервных структур, расположенных в перипростатической зоне. Основной целью работы стала оценка анатомической локализации и типа нервных волокон, что определяет их функциональное значение. По результатам морфологического анализа обнаружено, что из всех нервных волокон приблизительно 27,8% располагались на передней поверхности предстательной железы, между тремя и девятью часами условного циферблата. Распределение парасимпатических волокон в базисе, средней части и апексе составило 4%, 5 и 6,8% соответственно. Симпатические нервные ветви в этой зоне составили около 15%. Таким образом, по передней поверхности простаты распределена относительно небольшая часть парасимпатических волокон. Вероятно, они вносят определенный вклад в восстановление механизмов ЭФ и удержания мочи. С точки зрения авторов, прецизионная техника высокого вскрытия эндопельвикальной фасции позволяет минимизировать тракцию и травматическое воздействие на сосудисто-нервные пучки. По передней поверхности простаты также расположены симпатические волокна, имеющие отношение к сосудистым структурам, стромальному компоненту [27].
Хирургическая техника с сохранением Ретциева пространства позволяет сохранять важные структурные единицы переднего связочного аппарата, препятствуя возникновению гипермобильности уретры, развитию пролапса и обеспечивая должную позицию УВА [28]. Таким образом, НС-РРПЭ с сохранением Ретциева пространства показывает лучшие результаты в восстановлении удержания мочи и анатомически обосновано. Методика, предполагающая значительно меньшую травматизацию связочного аппарата зоны УВА, перекликается с идеей реконструкции связочного аппарата.
Выводы. НС-РРПЭ с применением техники сохранения Ретциева пространства является приемлемой альтернативой стандартной НС-РРПЭ и может использоваться в центрах, располагающих большим опытом выполнения РПЭ. При схожих периоперационных данных (длительность хирургического вмешательства, объем кровопотери) операция со сбережением Ретциева пространства превосходит классическую технику в отношении функциональных результатов (частоте и скорости восстановления удержания функции, ЭФ). Вероятно, это обусловлено сохранением анатомических структур, расположенных в этой зоне (в частности, сосудисто-нервных волокон, расположенных по поверхности предстательной железы). Однако необходимы дальнейшие исследования в этой области с целью клинико-морфологического обоснования восстановления удержания мочи.








