Клинический случай: робот-ассистированная резекция почки по поводу крупной опухоли (т2)
Резюме
В статье представлен клинический случай робот-ассистированной операции, выполненной по поводу опухоли больших размеров правой почки, изложена техника операции, приведены основные периоперационные показатели.
Материалы и методы. У мужчины 39 лет по данным УЗИ и МРТ выявлено образование правой почки, в верхней трети киста размерами 105 × 85 × 79 мм с четкими ровными контурами, с плотностью содержимого от 13 до 22 HU, с васкуляризированными вегетациями вдоль капсулы и умеренным накоплением контраста в тонких перегородках (Bosniak IV), киста деформирует синус почки в верхнем отделе, паранефральная клетчатка не инфильтрирована.
Результаты. Опухоль почки удалена в пределах здоровой ткани. Продолжительность операции 290 минут. Консольное время составило 255 минут. Объем кровопотери не превышал 150,0 мл. Время тепловой ишемии почки — 33 минуты. Уровень гемоглобина снизился на 10 %, количество эритроцитов снизилось на 14 %. Увеличения уровня креатинина и мочевины сыворотки крови не отмечалось. Нахождение в отделении реанимации и интенсивной терапии — 1 сутки. После операции пациенту установлено 2 дренажа к зоне резекции, которые удалены на 4 и 5-е сутки. Больной был выписан из стационара на 10-е сутки после операции.
Выводы. Мы представляем клинический случай выполнения робот-ассистированной резекции крупной опухоли почки у пациента молодого возраста. Преимущества робот-ассистированной хирургии, заключающиеся в отличной визуализации, а также прецизионности и точности движений, в совокупности с высоким уровнем хирургического опыта, снижают риск интра- и послеоперационных осложнений и вероятность нефрэктомии, связанной с ними. Молодой возраст пациента и высокий риск возможной нефрэктомии, по нашему мнению, являются показаниями к выполнению робот-ассистированных вмешательств, что позволяет снизить риск неоправданных нефрэктомий.
Введение
Во всем мире почечно-клеточный рак (ПКР) занимает шестое место среди диагностируемых опухолевых заболеваний у мужчин и десятое — у женщин, составляя 5 и 3 % всех онкологических диагнозов соответственно [1–2]. В Европе и Северной Америке ежегодный прирост диагностируемых ПКР колеблется от 1,3 до 1,8 %. Согласно последним данным Всемирной организации здравоохранения, ежегодно происходит более 140 000 смертей, связанных с ПКР, который занимает 13-е ме- сто по распространенности среди причин смерти от рака во всем мире [3]. В России прирост составляет 3,9 % на 100 000 человек [4–9]. На сегодняшний день общепризнанным стандартом лечения почечно-клеточного рака стадии Т1 является резекция почки [10]. Существуют три основных способа выполнения данного вмешательства: открытый, лапароскопический и робот-ассистированный [11]. Первая робот-ассистированная резекция почки была описана Gettman и соавт. в 2004 году [12]. За- тем было доказано, что при опухолях почки T1b– T2b резекция не уступает радикальной нефрэктомии с точки зрения онкологической выживаемости [13–15]. В пользу робот-ассистированной резекции почки приводятся такие аргументы, как меньший период госпитализации; более низкий уровень послеоперационных осложнений; меньший процент положительного хирургического края; низкий объем интраоперационной кровопотери; обеспечение хорошего онкологического и функционального результата [16–19]. Тем не менее робот-ассистированная резекция почки для сТ2-опухолей представляет собой сложное вмешательство, и на сегодняшний день сообщается об очень небольшом числе оперативных случаев, в связи с чем показания к данному методу лечения остаются индивидуальными и за- висят от оперирующего хирурга [20].
Описание пациента
Пациент Г., 39 лет, поступил в урологическое отделение ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России 12.03.2018. Отмечал жалобы на умеренные тянущие боли в правой поясничной области. Считает себя больным с января 2018 года, когда с подозрением на субкапсулярную гематому правой почки был госпитализирован в урологическое отделение СПб ГБУЗ Клинической больницы Святителя Луки. При обследовании, по данным мультиспиральной компьютерной томографии (МКСТ), была обнаружена крупная киста правой почки (Bosniak IV). Объективно: почки не пальпируются. Поколачивание по поясничной области безболезненно с обеих сторон. Мочеиспускание самостоятельное, свободное, безболезненное. Макрогематурии не отмечал. Операции в анамнезе: 1988 год — аппендэктомия. Вес пациента — 97 кг, рост — 197 см; индекс массы тела — 25,0. Серьезными сопутствующими заболеваниями не страдал. По данным лабораторных исследований, при поступлении в биохимическом анализе крови: мочевина — 5,4 ммоль/л, креатинин — 75 мкмоль/л; в клиническом анализе крови при поступлении: уровень гемоглобина — 149 г/л, лейкоцитоза и нейтрофильного сдвига нет. В общем анализе мочи: без патологических изменений. По данным МСКТ брюшной полости и мочевыводящих путей 25.01.2018, правая почка размерами 167 × 74 × 73 мм, паренхима выражена достаточно, в верхней трети почки киста размерами 105 × 85 × 79 мм с четкими ровными контурами, с плотностью содержимого от 13 до 22 HU, с васкуляризированными вегетациями вдоль капсулы, умеренно накапливает контраст в тонких перегородках (Bosniak IV), киста деформирует синус почки в верхнем отделе, паранефральная клетчатка не инфильтрирована, к кисте подходит ветвь почечной артерии диаметром 3 мм, отходящая от ее верхней стенки на 25 мм дистальнее устья. По данным нефрометрической шкалы R.E.N.A.L., опухоль правой почки имела оценку 10P. При комплексном обследовании, проведенном в ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, признаков другой очаговой патологии и генерализации процесса у больного не выявлено.
Проведенные оперативные вмешательства
14.03.2018 больному было выполнено оперативное вмешательство в объеме робот-ассистированной резекции правой почки. Трансперитонеальный доступ был осуществлен из 5 эндопортов. Доступ в брюшную полость был осуществлен через переднюю стенку живота. Укладка пациента, расстановка эндоскопических портов и расположение операционной бригады и тележки пациента представлены на рисунках 1–3. По нашему мнению, важным этапом операции является выделение сосудистой ножки почки, в связи с чем, с целью минимизации риска возникновения кровотечения при диссекции почечных сосудов, роботическим манипулятором No 3 происходит тракция почки к париетальной брюшине боковой стенки живота и выделяется анатомическая структура «венозно-почечный» треугольник (рис. 4), который служит: анатомическим ориентиром для обнаружения почечных сосудов; полость треугольника является безопасной бессосудистой зоной; при возникновении экстренных ситуаций без труда можно наложить зажим Сатинского на всю почечную ножку.
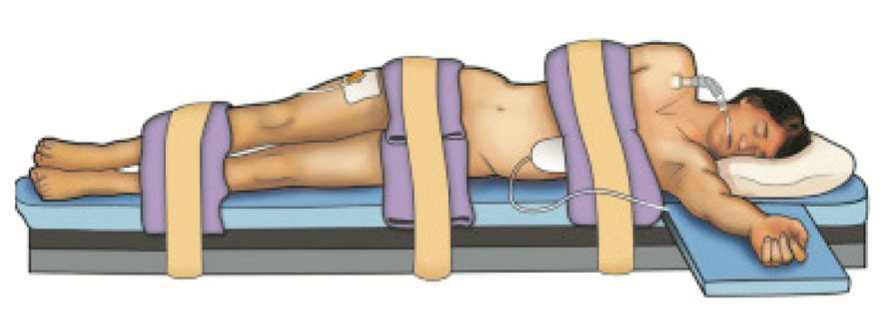 Рис. 1. Укладка пациента
Рис. 1. Укладка пациента
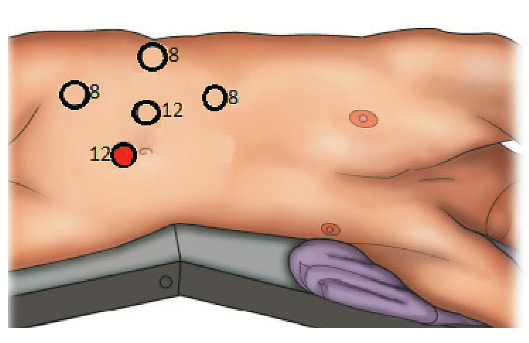 Рис. 2. Расстановка эндоскопических портов, красным цветом обозначен ассистентский порт
Рис. 2. Расстановка эндоскопических портов, красным цветом обозначен ассистентский порт
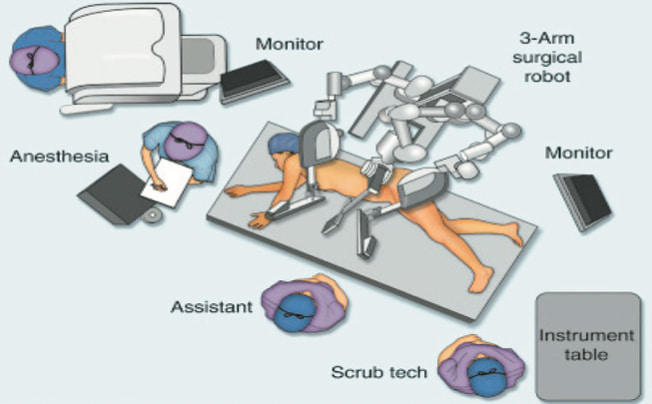 Рис. 3. Схема расположения операционной бригады и тележки пациента
Рис. 3. Схема расположения операционной бригады и тележки пациента
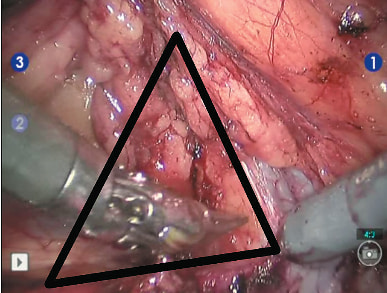 Рис. 4. Роботическим манипулятором No 3 происходит тракция почки к париетальной брюшине боковой стенки живота и выделяется анатомическая структура «венозно-почечный» треугольник
Рис. 4. Роботическим манипулятором No 3 происходит тракция почки к париетальной брюшине боковой стенки живота и выделяется анатомическая структура «венозно-почечный» треугольник
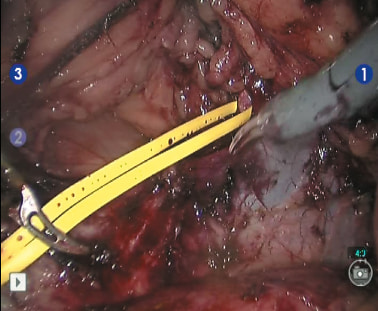 Рис. 5. Выделен почечно-венозный треугольник
Рис. 5. Выделен почечно-венозный треугольник
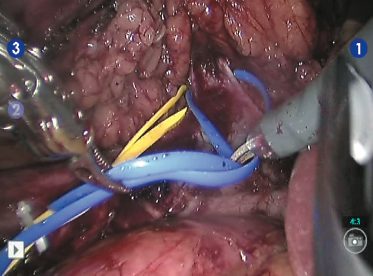 Рис. 6. Выделена и взята на турникет правая почечная вена
Рис. 6. Выделена и взята на турникет правая почечная вена
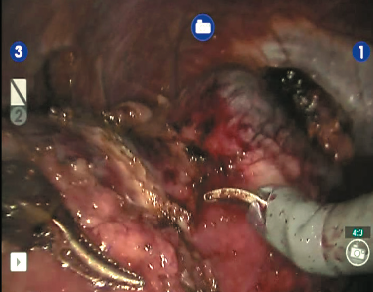 Рис. 7. Выделен верхний полюс правой почки, подготавливается площадка для резекции новообразования
Рис. 7. Выделен верхний полюс правой почки, подготавливается площадка для резекции новообразования
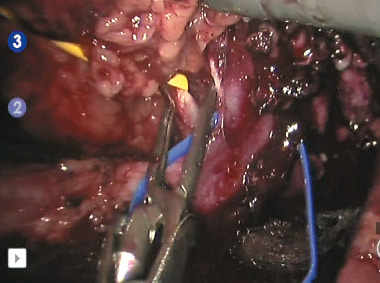 Рис. 8. Наложен сосудистый зажим по типу «бульдог» на правую почечную артерию
Рис. 8. Наложен сосудистый зажим по типу «бульдог» на правую почечную артерию
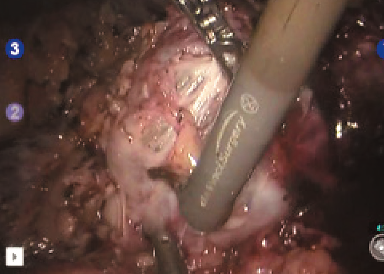 Рис. 9. Диссекция опухоли на тепловой ишемии
Рис. 9. Диссекция опухоли на тепловой ишемии
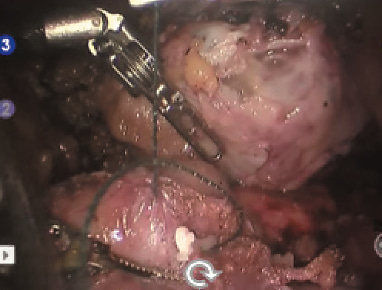 Рис. 10. Ушивание паренхимы зоны резекции методом «скользящей клипсы»одпись к изображению
Рис. 10. Ушивание паренхимы зоны резекции методом «скользящей клипсы»одпись к изображению
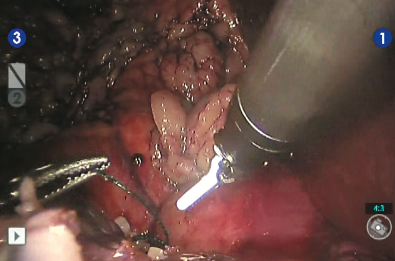 Рис. 11. Снятие зажима с почечной артерии и оценка гемостаза ушитого ложа опухоли
Рис. 11. Снятие зажима с почечной артерии и оценка гемостаза ушитого ложа опухоли
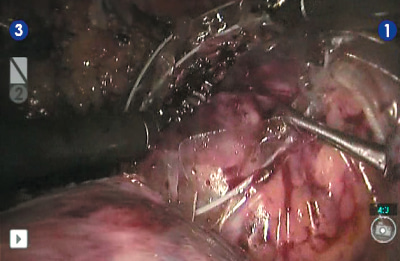 Рис. 12. Помещение удаленного препарата в эндоскопический эвакуатор
Рис. 12. Помещение удаленного препарата в эндоскопический эвакуатор
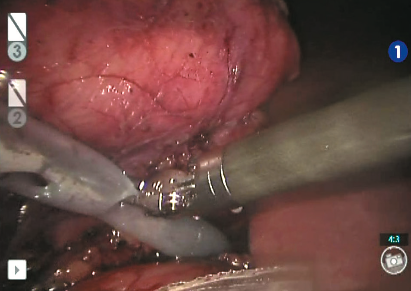 Рис. 13. Подведение силиконового дренажа к ложу резекции
Рис. 13. Подведение силиконового дренажа к ложу резекции
Выделена и взята на турникет правая почечная артерия (рис. 5). Выделена и взята на турникет правая почечная вена (рис. 6). Выделен верхний полюс правой почки, подготавливает- ся площадка для резекции новообразования (рис. 7). Наложен сосудистый зажим по типу «бульдог» на правую почечную артерию (рис. 8). Производит- ся диссекция опухоли на тепловой ишемии (рис. 9). Ушивание паренхимы зоны резекции методом «скользящей клипсы» (рис. 10). Снят зажим с почечной артерии и оценивается гемостаз ушитого ложа опухоли (рис. 11). Удаленный препарат помещен в эндоскопический эвакуатор (рис. 12). К ложу резекции подведен силиконовый дренаж (рис. 13). Продолжительность операции составила 290 минут, при этом консольное время составило 255 минут. Объем кровопотери не превышал 150 мл. Время тепловой ишемии почки составило 33 минуты. Гистологическое исследование операционного материала выявило светлоклеточную почечно-клеточную карциному (grade I (Fuhrman)). Таким образом, у больного был сформулирован заключительный диагноз: рак правой почки pT2bNoMo. В послеоперационном периоде у больного отмечалось незначительное снижение уровня гемоглобина (10 % от исходного), а также количества эритроцитов (на 14 % от исходного). Уровни креатинина и мочевины сыворотки крови не были увеличены. Пациент находился в отделении реанимации и интенсивной терапии в течение суток. На 4 и 5-е сутки произведено удаление дренажей из зоны резекции почки, уретральный катетер удален на 2-е сутки после операции. Больной был выписан из стационара на 10-е сутки после операции в удовлетворительном со- стоянии. Послеоперационный период был осложнен двусторонней полисегментарной пневмонией (по шкале Clavien-Dindo 1), без клинических проявлений (выявлена на основании лабораторных и инструментальных исследований), вероятно вследствие гиподинамии в течение раннего послеоперационного периода, по поводу чего проводилась антибактериальная, симптоматическая терапия.
В ходе периода наблюдения пациент проходил плановое обследование через 1, 6 и 12 месяцев после выписки. Выполнены контрольные исследования, МКСТ почек, по результатам которых данных о наличии местного рецидива, отдаленных метастазов не получено. В ходе контрольных лабораторных исследований в клиническом анализе крови и биохимическом анализе крови за весь период наблюдения признаков анемии и повышения уровня трансаминаз не обнаружили.
Выводы
Мы представляем клинический случай выполнения робот-ассистированной резекции крупной опухоли почки у пациента молодого возраста. Преимущества робот-ассистированной хирургии заключаются в отличной визуализации, а также прецизионности и точности движений и, в совокупности с высоким уровнем хирургического опыта, снижают риск интра- и послеоперационных осложнении и вероятность нефрэктомии, связанной с ними. Молодой возраст пациента и высокий риск возможной нефрэктомии, по нашему мнению, являются показаниями к выполнению робот-ассистированных вмешательств, что позволяет снизить риск неоправданных нефрэктомий.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Информация об авторах: Мосоян Мкртич Семенович, д.м.н., заведующий кафедрой урологии с курсом роботической хирургии, руководитель Центра роботической хирургии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, профессор кафедры урологии ФГБОУ ВО ПСПбГМУ им. акад. И. П. Павлова Минздрава России; Федоров Дмитрий Александрович, врач-уролог Центра роботической хирургии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Айсина Надежда Анатольевна, ассистент кафедры урологии с курсом роботической хирургии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Гилев Евгений Сергеевич, врач-уролог отделения урологии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.







