Клинический случай: робот-ассистированная лапароскопическая радикальная простатэктомия у пациента с выраженной средней долей
Введение. В статье приведен клинический случай робот-ассистированной лапароскопической радикальной простатэктомии у пациента с предстательной железой объемом 81 см3, со средней долей объемом 39 см3; изложена техника операции, приведены основные периоперационные показатели и кратко изложен период реабилитации. Целью исследования было выявить возможные трудности, которые возникают в данной ситуации, поделиться своим опытом и привлечь интерес коллег к этой теме.
Материалы и методы. Пациент, 73 года, как известно из анамнеза: уровень простатического специфического анигена — 18 нг/мл; по данным трансректальной мультифокальной биопсии предстательной железы, выполненной в марте 2017 года, — ацинарная микрокарцинома предстательной железы (латерально-медиальная зона слева), сумма баллов по Глисону 6 (3 + 3); по данным магнитно-резонансной томографии органов малого таза: предстательная железа 81 см3, ассиметричная с преобладанием левой доли; средняя доля объемом 39 см3 вдается в просвет мочевого пузыря на 4,6 см; простатический отдел уретры смещен влево, не расширен, данных за экстракапсулярную экстензию нет, лимфатические узлы — без особенностей, при остеосцинтиграфии признаков специфического поражения костной ткани не выявлено. Больному была выполнена нервосберегающая радикальная робот- ассистированная лапароскопическая простатовезукулэктомия.
Результаты. Длительность операции составила 200 минут. Консольное время — 155 минут. Объем кровопотери не превысил 120 мл. Уровень гемоглобина снизился на 7,6 % от исходного значения. Нахождение в отделении реанимации и интенсивной терапии — 1 сутки. Дренажная трубка из малого таза удалена на 2 сутки. Уретральный катетер удален на 7 сутки. Пациент выписан из стационара на 8 сутки после операции.
Выводы. При проведении робот-ассистированной радикальной простатэктомии у пациентов с выраженной средней долей хирург может столкнуться с несколькими проблемами: большими размерами предстательной железы, трудностью проведения реконструкции шейки мочевого пузыря, особого внимания требует мобилизация устьев мочеточников.
Список сокращений: МИЭФ-5 — международный индекс эректильной функции; ПСА — простатический специфический антиген; РАРП — робот-ассистированная радикальная простатэктомия; РПЖ — рак предстательной железы; УЗИ — ультразвуковое исследование.
Введение
Рак предстательной железы (РПЖ) является одним из наиболее распространенных заболеваний современной онкоурологии. В 2018 году, согласно данным Американского онкологического общества, зарегистрировано 174 650 новых случаев РПЖ и 31 620 летальных исходов от РПЖ [1]. В структуре заболеваемости злокачественными новообразованиями среди мужского населения в Российской Федерации в 2017 году РПЖ занимает 2-е место (14,5 %), зарегистрировано 40 785 новых случаев РПЖ и 12 565 летальных исходов [2]. По данным Европейской [3] и Американской [4] урологических ассоциаций, на сегодняшний день общепризнанной хирургической методикой лечения РПЖ является радикальная простатэктомия (РПЭ), которую возможно выполнить открытым, лапароскопическим или робот-ассистированным доступом. При этом радикальная робот-ассистированная простатэктомия ассоциируется с более низкими по-казателями госпитализации и кровопотери [5].
С момента зарождения робот-ассистированных операций на предстательной железе наличие средней доли ассоциировалось с возникновением дополнительных трудностей для хирурга. Альтернативные радикальные методы лечения — дистанционная лучевая терапия и брахитерапия у пациентов с большой средней долей связаны с высокой долей осложнений, одним из которых является острая задержка мочеиспускания [6, 7]. В 2005 году Sarle R, et al. (2005) [8] впервые описали «подводные камни» выполнения радикальной робот-ассистированной простатэктомии у пациента с выраженной средней долей: возможное повреждение дистальных отделов мочеточников, наличие положительного хирургического края и послеоперационное недержание мочи.
Ретроспективное исследование Hamidi N, et al. (2018) [9] с наблюдением в течение 1 года 924 пациентов с диагнозом «рак предстательной железы» и наличием выраженной средней доли, которым была выполнена робот-ассистированная радикальная простатэктомия (РАРП), показало, что наличие средней доли значительно увеличивает продолжительность операции и отрицательно влияет на формирование раннего удержания мочи (на 7,3 % по сравнению с контрольной группой). При этом не было продемонстрировано статистически достоверного влияния на периоперационные осложнения, интраоперационную кровопотерю, наличие положительного хирургического края и риска развития биохимического рецидива. В работе Keske M, et al. (2016) [10] пришли к выводу, что выполнение РАРП пациентам с большой предстательной железой и выраженной средней долей имеет ряд «минусов», связанных с увеличением среднего консольного времени (в среднем 158,2 минуты), временем удаления уретрального катетера (в среднем 9,1 дней), продолжительностью пребывания в стационаре (в среднем 3,8 дней), но сопоставимые функциональные и онкологические исходы, по сравнению с простатой средних размеров. Согласно исследованию Huang AC, et al. (2011): несмотря на эквивалентные онкологические результаты, работу одного и того же хирурга, наличие и величина средней доли предстательной железы значительно увеличивает консольное время [11]. Labanaris AP, et al. (2013) [12] в своем исследовании делают акцент на опыте хирурга и относят робот-ассистированную радикальную простатэктомию с большой средней долей к операциям повышенной сложности.
Материалы и методы
Пациент Г., 56 лет, поступил в урологическое отделение ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России 26.05.2017. В течение длительного времени пациент наблюдался у уролога с диагнозом «гиперплазия предстательной железы». Как известно из анамнеза, в 2015 году уровень простатического специфического антигена (ПСА), общ., составлял 6 нг/мл, была выполнена мультифокальная биопсия простаты — гистологически доброкачественная гиперплазия предстательной железы, в 2016 году — 8 нг/мл, никаких диагностических мероприятий не проводилось. На момент госпитализации жалобы на слабую струю мочи, ноктурию до 4 раз, периодически затрудненное мочеиспускание. По данным IPSS (опросник «IPSS» — между- народная система суммарной оценки симптомов болезней предстательной железы в баллах; ВОЗ, 1992 г.), 16 баллов (10 баллов — обструктивная симптоматика, 6 баллов ирритативная симптоматика), качество жизни пациент оценивает в 5 баллов (плохое). По данным IIEF-5 (МИЭФ-5 — международный индекс эректильной функции), 17 баллов, что соответствует эректильной дисфункции легкой степени. При пальцевом ректальном исследовании определяется плотно-эластической консистенции железа, увеличенная в размерах, незначительно болезненная при пальпации. Уровень ПСА — 18 нг/мл. По данным трансректальной мультифокальной биопсии предстательной железы, выполненной в марте 2017 года — ацинарная аденокарцинома предстательной железы (в одном столбике), сумма баллов по Глисону 6 (3 + 3). По данным магнитно-резонансной томографии органов малого таза: предстательная железа 81 см3, асимметричная с преобладанием левой доли; средняя доля объемом 39 см3, вдается в просвет мочевого пузыря на 4,6 см; простатический отдел уретры смещен влево, не расширен, данных за экстракапсулярную экстензию нет, лимфатические узлы — без особенностей. При остеосцинтиграфии признаков специфического поражения костной ткани не выявлено. Оценка по номограмме Партина: внутриорганное расположение опухоли — 66,2 %, эктракапсулярная экстензия оценивается в 30,4 %; инвазия в семенные пузырьки оценивается в 2,5 %, риск поражения лимфатических узлов в 0,9 %. При оценке по номограмме Бриганти — риск поражения лимфатических узлов оценивается в 2 %. Вес пациента составил 76,5 кг; рост — 171 см. ИМТ — 26,2 кг/м2. При комплексном обследовании, проведенном в ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, признаков другой очаговой патологии и генерализации процесса у больного не выявлено.
Результаты
27.05.2019 больному было выполнено оперативное вмешательство в объеме нервосберегающей радикальной лапароскопической робот-ассистированной простатэктомии. Операция выполнялась опытным роботическим хирургом (опыт — более 800 операций, в том числе опыт проведения робот-ассистированных радикальных простатэктомий — более 500 операций).
Трансперитонеальный доступ 5 эндопортов (рис. 1). Через переднюю стенку париетальной брюшины осуществлен доступ в предпузырное пространство. Выделена шейка мочевого пузыря, предстательная железа, значительно увеличенная в размерах, уретра. Ассистент осуществляет тракции катетера Фолея для определения места начала диссекции, учитывая наличие средней доли предстательной железы (рис. 2). Этапы проведения диссекции шейки мочевого пузыря: проведение передней резекции, вскрытие просвета уретры (рис. 3). Появление уретрального катетера свидетельствует о завершении этапа передней резекции (рис. 4). Средняя доля полностью выделена, выведена из просвета мочевого пузыря, визуализированы устья мочеточников (рис. 5). Следует отметить, что в некоторых случаях устья могут прилежать к средней доле, это может увеличить риск их повреждения. С другой стороны, «неадекватная» резекция может привести к наличию положительного хирургического края. В связи с этим крайне важным моментом является проведение тщательной и прецизионной диссекции в области устьев обоих мочеточников. Следующим этапом в пределах здоровой ткани произведено иссечение средней доли (рис. 6). Семенные пузырьки, семявыносящие протоки выделены и пересечены проксимально (рис. 7). Произведена диссекция задней поверхности предстательной железы с сохранением фасции Денонвилье, сосудистонервных пучков с двух сторон, а также пубопростатических связок. Апикальная часть простаты выделена, отсечена от дорзального венозного комплекса с перевязкой последнего; отсечена от уретры и помещена в лапароскопический эвакуатор (рис. 8). Тщательный гемостаз ложа предстательной железы путем наложения гемостатических швов с использованием рассасывающегося шовного материала (Vicryl 5-0) (рис. 9). Наложение уретровезикального анастомоза с использованием шовного материала V-Loc 3-0 на игле 17 мм (использовано 2 нити, непрерывный шов) реконструкцией шейки мочевого пузыря по типу «теннисной ракетки» (в данном случае, в связи с наличием средней доли больших размеров и, соответственно, широкого дефекта шейки мочевого пузыря, реконструкция последней иным способом представляется нежелательной из-за высокой вероятности повреждения мочеточников) (рис. 10, 11). К зоне сформированного анастомоза установлен дренаж.
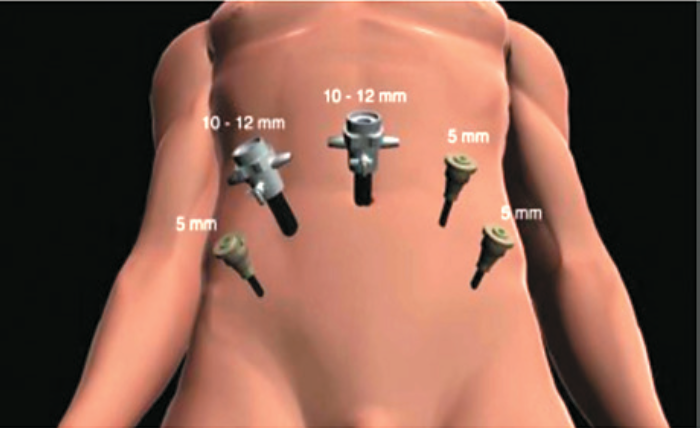 Рис. 1. Схема установки троакаров для выполнения трансперитонеальной робот- ассистированной радикальной простатэктомии
Рис. 1. Схема установки троакаров для выполнения трансперитонеальной робот- ассистированной радикальной простатэктомии
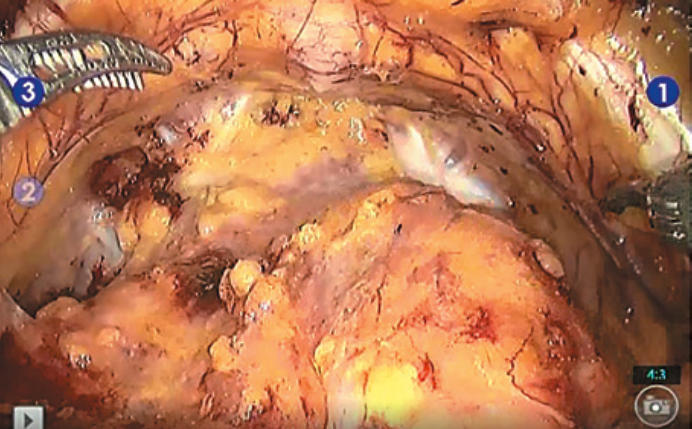 Рис. 2. Ассистент осуществляет тракции катетера Фолея для определения места начала диссекции, учитывая наличие средней доли предстательной железы
Рис. 2. Ассистент осуществляет тракции катетера Фолея для определения места начала диссекции, учитывая наличие средней доли предстательной железы
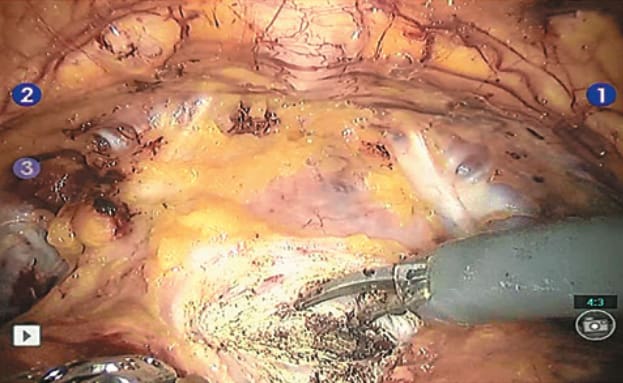 Рис. 3. Передняя резекция шейки мочевого пузыря, вскрытие просвета уретры
Рис. 3. Передняя резекция шейки мочевого пузыря, вскрытие просвета уретры
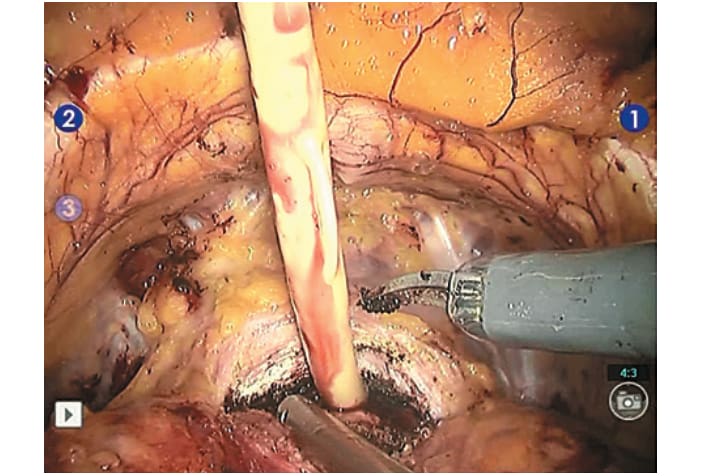 Рис. 4. Появление уретрального катетера свидетельствует о вскрытии просвета уретры
Рис. 4. Появление уретрального катетера свидетельствует о вскрытии просвета уретры
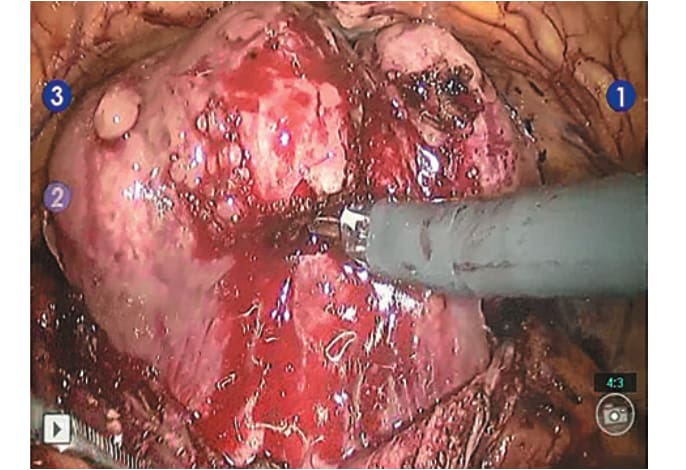 Рис. 5. Средняя доля полностью выделена, выведена из просвета мочевого пузыря, визуализированы устья мочеточников
Рис. 5. Средняя доля полностью выделена, выведена из просвета мочевого пузыря, визуализированы устья мочеточников
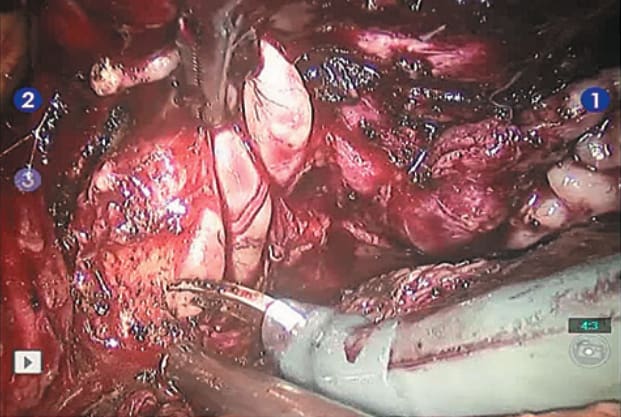 Рис. 6. Иссечение средней доли предстательной железы в пределах здоровой ткани
Рис. 6. Иссечение средней доли предстательной железы в пределах здоровой ткани
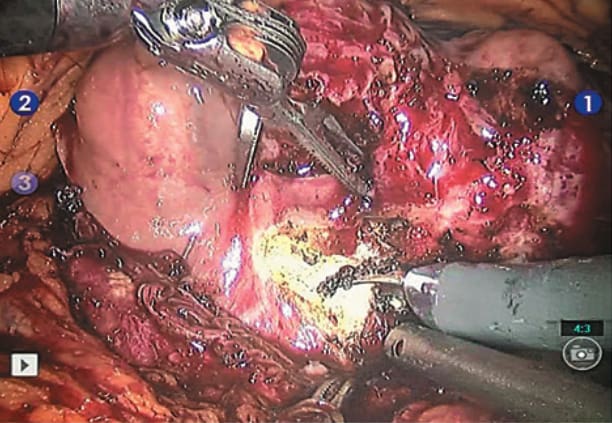 Рис. 7. Семенные пузырьки, семявыносящие протоки выделены и пересечены проксимально
Рис. 7. Семенные пузырьки, семявыносящие протоки выделены и пересечены проксимально
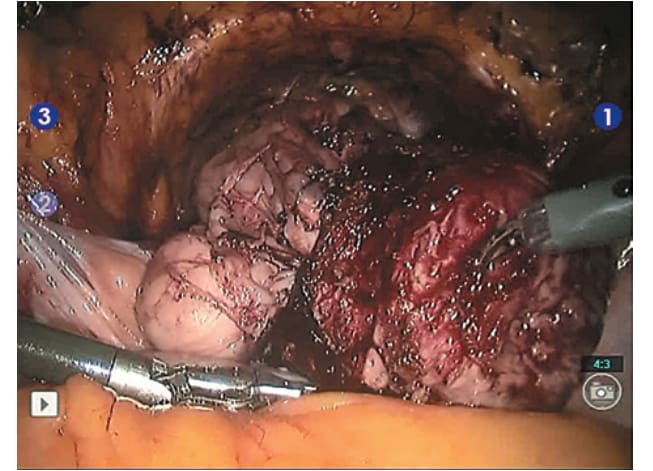
Рис. 8. Апикальная часть простаты выделена, отсечена от дорзального венозного комплекса с перевязкой последнего; отсечена от уретры и помещена в лапароскопический эвакуатор
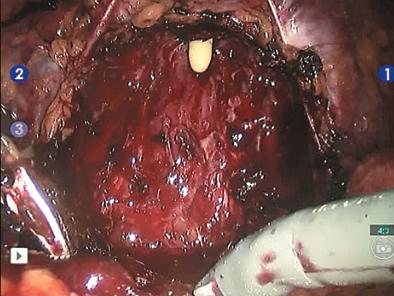 Рис. 9. Тщательный гемостаз ложа предстательной железы, сосудисто-нервные пучки с обеих сторон, фасция Денонвилье сохранены
Рис. 9. Тщательный гемостаз ложа предстательной железы, сосудисто-нервные пучки с обеих сторон, фасция Денонвилье сохранены
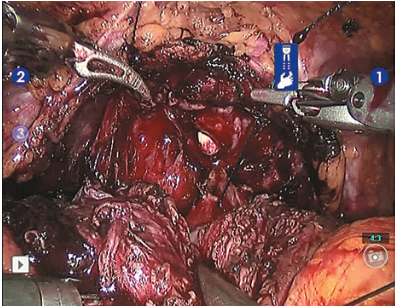 Рис. 10. Начальный этап наложения мочепузырно-уретрального анастомоза
Рис. 10. Начальный этап наложения мочепузырно-уретрального анастомоза
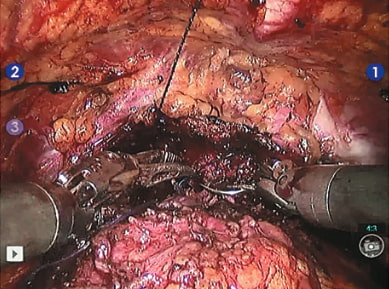 Рис. 11. Завершающий этап формирования мочепузырно-уретрального анастомоза с реконструкцией шейки мочевого пузыря по типу «теннисной ракетки»
Рис. 11. Завершающий этап формирования мочепузырно-уретрального анастомоза с реконструкцией шейки мочевого пузыря по типу «теннисной ракетки»
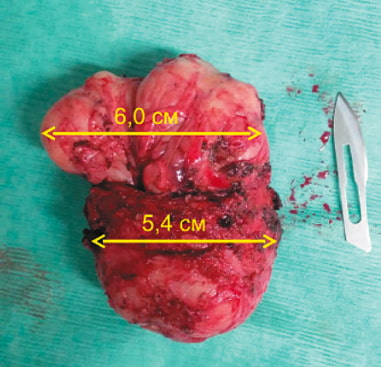 Рис. 12. Фото удаленной предстательной железы
Рис. 12. Фото удаленной предстательной железы
Длительность операции составила 200 минут. Консольное время — 155 минут. Объем кровопотери не превысил 120 мл. При гистологическом исследовании препарата удаленной предстательной железы выявлена умеренно дифференцированная аденокарцинома предстательной железы (рис. 12), опухоль поражает обе доли, не распространяется за пределы капсулы органа и на семенные пузырьки. Края хирургической резекции негативные (R0). Сумма Глисона 3 + 3 = 6, pT2c. Отдельно присланный участок «край резекции уретры» был без элементов опухоли. Таким образом, у больного сформирован заключительный диагноз «рак предстательной железы pT2сN0M0».
В послеоперационном периоде у пациента отмечалось клинически незначимое снижение гемоглобина (на 7,6 % от исходного), а также уровня эритроцитов (на 5,8 % от исходного). Остальные показатели оставались в пределах референтных значений. Пациент находился в отделении реанимации и интенсивной терапии 1 сутки. На 2 сутки про- изведено удаление дренажа из ложа простаты. Уретральный катетер удален после проведения контрольной цистографии на 7 сутки после операции. Мочеиспускание самостоятельное, свободное; явлений задержки, недержания не отмечается; отмечается раннее удержание мочи. По данным контрольного ультразвукового исследования (УЗИ) почек признаков нарушения уродинамики верхних мочевых путей не выявлено. По данным контрольных лабораторных исследований в клиническом анализе крови гемоглобин 127 г/л, эритроциты 3,85 × 1012, лейкоцитоза нет, в биохимическом анализе крови уровень креатинина — 73 мкмоль/л, мочевина — 5,9 ммоль/л. Выписан на 8 сутки после операции в удовлетворительном состоянии.
Больной находился под диспансерным наблюдением, проводились стандартные диагностические мероприятия — пальцевое ректальное исследование, измерение уровня ПСА, УЗИ малого таза (в том числе и ложа предстательной железы), оценка раннего удержания мочи и эректильной функции по опроснику МИЭФ-5 (международный индекс эректильной функции). ПСА через 24 месяца наблюдения составляет 0,002 нг/мл. Пациенту была рекомендована ежедневная гимнастика мышц тазового дна (упражнения Кегеля). Для оценки раннего удержания мочи мы пользовались тестом с прокладками («пад-тест»). В течение 1 месяца отмечалось выделение около 5–10 мл мочи, что соответствовало 2 стадии недержания мочи, в течение первых 2 недель 2 месяца количество мочи уменьшилось до 0, и пациент перестал пользоваться прокладками. В течение первого года на амбулаторном приеме проводилась оценка эректильной функции по опроснику IIEF-5 (МИЭФ-5), в котором отмечалось прогрессивное увеличение суммы баллов до 17 (8, 13, 17 и 17 баллов на 3, 6, 9 и 12 месяц соответственно), что является достаточным уровнем эрекции для проведения полового акта более чем в 50 % попыток с использованием или без ингибиторов фосфодиэстеразы 5-го типа (ИФДЭ5) [13]. В исследовании Müller A, et al. (2009) [14] было выявлено 4 предиктора восстановления эректильной функции после РАРП. Прежде всего это проведение нервосберегающей операции, возраст пациента до 60 лет, раннее начало фармакотерапии ингибиторами фосфодиэстеразы 5-го типа (ИФДЭ5) и отсутствие сопутствующей сердечной патологии. У данного пациента была проведена нервосберегающая операция, возраст на момент проведения операции составлял 56 лет, отсутствовала сопутствующая сердечно-сосудистая патология, но проведение фармакотерапии не было осуществлено. Тем не менее следует отметить, что у пациента эректильная функция в течение 9 месяцев достигла дооперационного порогового значения и не влияла на качество жизни пациента. При этом спонтанная ночная и утренняя эрекции возникала периодически и после операции (примерно на 4–5 неделю), а через 12 недель (3 месяца) больной начал жить половой жизнью.
При гистологическом исследовании препарата предстательной железы — края хирургической резекции негативны (0). Послеоперационных осложнений у пациентов не отмечалось. Результаты были оценены с позиции терминов трифекта (избавление от опухоли предстательной железы, восстановление удержания мочи, восстановление эректильной функции) [15] и «пентафекта» + отсутствие положительного хирургического края и послеоперационных осложнений в течение первых 3 месяцев после операции [16]. Резюмируя вышеперечисленные данные, следует отметить, что, несмотря на выраженную среднюю долю предстательной железы, возможно выполнение радикальной простатэктомии с достижением трифекты и пентафекты.
Выводы
Выполнение опытным хирургом РАРП у пациентов с большой предстательной железой, выраженной средней долей, пролабирующей в просвет мочевого пузыря, является возможным, эффективным и безопасным методом лечения со сходными онкологическими и функциональными исходами. При проведении РАРП у пациентов с выраженной средней долей хирург может столкнуться с не- сколькими проблемами. Во-первых, большой размер предстательной железы изменяет анатомию малого таза, затрудняя проведение резекции, что, в свою очередь, может привести к наличию положительного хирургического края. Во-вторых, возможно повреждение мочеточников при достаточно обширной резекции шейки мочевого пузыря. Устья мочеточников находятся очень близко к краю резекции, и работа в данной области требует особого внимания и во время резекции, и во время реконструкции (необходимо соблюдать максимальную осторожность при формировании анастомоза, чтобы свести к минимуму возможность обструкции мочеточника из-за шва). В послеоперационном периоде необходимо проводить контроль уровня креатинина и проведение контрольного УЗИ почек для исключения нарушения пассажа мочи.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Информация об авторах
Мосоян Михаил Семенович, д.м.н., руководитель центра роботической хирургии, заведующий кафедрой урологии с курсом роботической хирургии Института медицинского образования, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; профессор кафедры урологии ФГБОУ ВО ПСПбГМУ им. И. П. Павлова Минз- драва России; Федоров Дмитрий Александрович, врач-уролог, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Айсина Надежда Анатольевна, врач-уролог, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России; Васильев Артем Александрович, врач-уролог, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.







